基于双层探测器光谱CT定量参数分析直肠癌生物学特征
2022-12-20王莉莉郑文霞贾应梅陈杏彪魏照坤马小梅崔雅琼马颖杨大雄黄刚
王莉莉,郑文霞,贾应梅,陈杏彪,魏照坤,马小梅,崔雅琼,马颖,杨大雄,黄刚
直肠癌是最常见的消化系统恶性肿瘤之一,据2018年世界卫生组织/国际癌症中心团队最新统计数据显示,直肠癌的死亡率和发病率分别居全球癌症死亡和发病的第2位和第3位[1],在我国的病死率和发病率分别为10.9/10万和23.7/10万[2-3]。根据美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN) 指南,直肠癌的低分化程度、脉管浸润、神经侵犯和切缘阳性都是影响患者生存和预后的病理特征,其中脉管浸润不仅是侵袭性行为的生物学表现,也是评价直肠癌术后复发的高危因素和判断术后治疗效果的良好指标[4-5]。尽管MRI对术前判别大于3 mm的脉管是否存在浸润有较高的准确性,但无法评估微小的脉管浸润;其次,由于术前直肠活检取材有限,无法全面评估病变组织的脉管及神经侵犯。因此,对直肠癌脉管侵犯的准确评价目前仍比较困难[6-8]。探索能在术前预测直肠癌脉管神经侵犯的影像生物标记物,早期预测直肠癌的侵袭性和预后情况,具有重要的临床意义。本文通过对比分析动脉期和静脉期光谱CT定量参数在有或无脉管神经侵犯和淋巴结转移组及不同分化程度组之间的差异,旨在探讨光谱CT定量参数在直肠癌预后评估中的临床应用价值。
材料与方法
1.临床资料
前瞻性将2020年6月-2021年1月本院连续收治的直肠癌患者纳入观察,最终将符合本研究要求的70例直肠癌患者纳入本研究。其中,男41例,女29例,年龄35~70岁,平均(50.1±16.2)岁。纳入标准:①病理证实的直肠癌患者,在术前1周完成光谱CT检查;②在CT检查前无放疗或化疗等病史;③术后临床资料和病理资料完整。排除标准:①图像伪影大或肿瘤较小无法测量;②术后病理证实为腺瘤、间质瘤及炎症;③肿瘤位于直肠与乙状结肠交界区;④直肠癌复发者。所有患者已签署知情同意书。
2.光谱CT扫描方法
使用Philips IQon Spectrcal CT机,常规行动、静脉期增强扫描。注射对比剂碘克沙醇(320 mg I/mL),剂量1.0 mL/kg,注射流率3.0 mL/s,动脉期和静脉期延迟时间分别为20和60~70 s。扫描参数:扫描范围为髂棘至耻骨联合下缘水平,120 kVp,自动管电流调制技术,螺距0.969,0.5 s/r,矩阵512×512,准直器宽度64×0.625 mm。一次扫描同时获得两组图像,分别是厚层常规混合能量图像和薄层光谱图像。常规混合能量采用迭代重建算法,层厚和层间距均为5.0 mm;薄层光谱图像的层厚0.9 mm,层间距0.7 mm。经后处理后得到常规120 kVp混合能量图像(polyenergetic image,PI)、虚拟平扫(virtual non-contrast images,VNC)图像、40keV虚拟单能量图(vir-tual monoenergetic images,VMI)、无水碘密度图、碘密度图和有效原子序数(Eff-Z)图等。
3.光谱数据分析
将动脉期和静脉期常规120 kV PI和光谱图像传至Philips IntelliSpace Portal星云工作站,在常规混合能量120 kVp PI和光谱基图像上在病灶内勾画ROI,ROI面积为35~55 mm2,避开非肿瘤区、水肿区及血管结构。测量得到120 kVp PI、VNC图像及40 keV-VMI上病灶的CT值、无水碘密度和Eff-Z等定量参数;测得的病灶碘密度除以同层面髂动脉的碘密度即为标准化碘密度(normalized iodine density,NIC),在测量髂动脉碘密度时应注意避开血管壁的动脉硬化斑块(图1)。
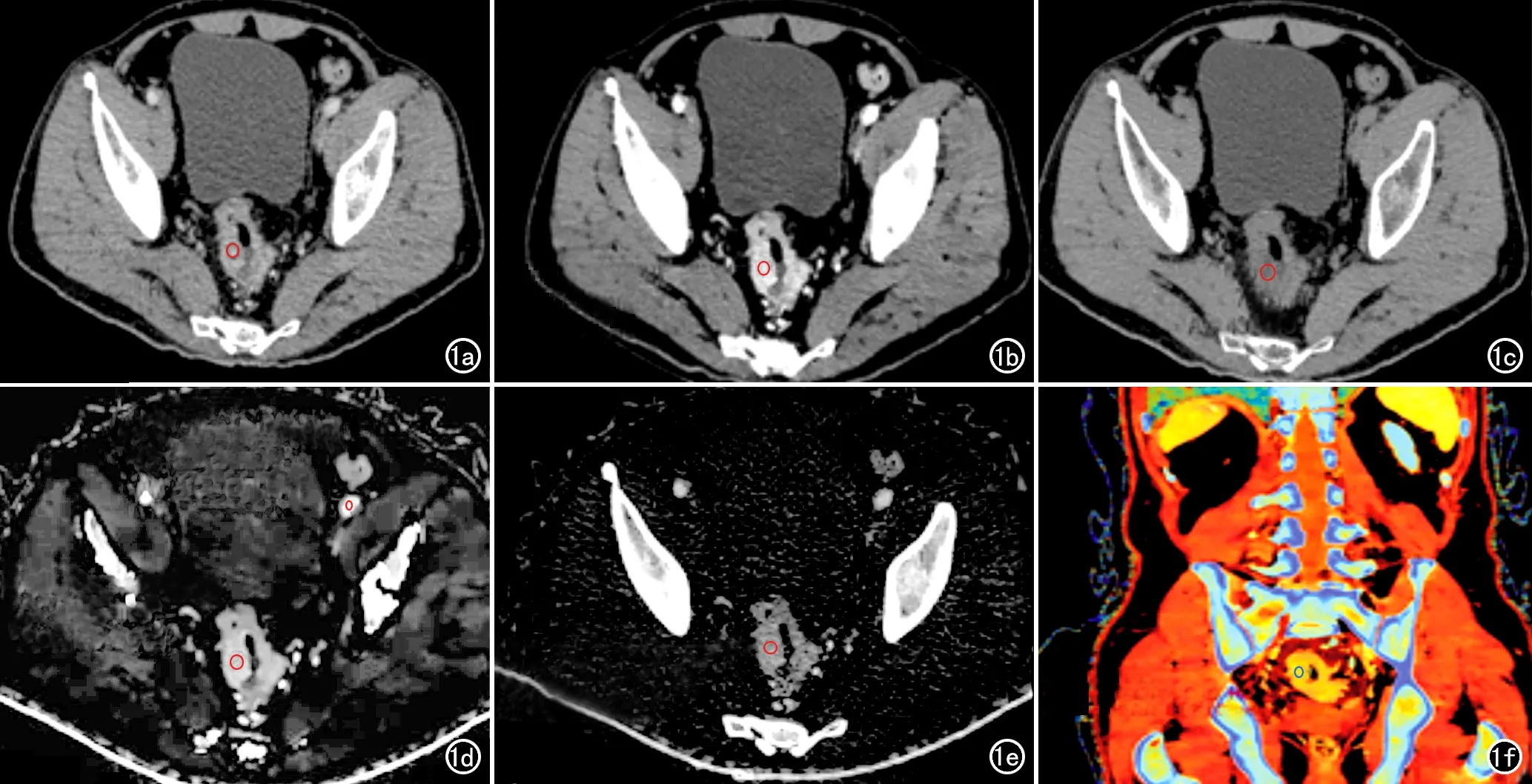
图1 男,74岁,直肠中段中分化腺癌伴有血管、淋巴管和神经侵犯。a)120 kVp PI,直肠癌病灶的CT值约88 HU;b)40 keV VMI,直肠癌病灶的CT值约174.7 HU,碘强化效果和图像的密度分辨率较PI提高;c)VNC图像,直肠癌的CT值为43 HU;d)碘密度图像,测得直肠癌的碘密度为1.53 mg/mL,髂动脉的碘密度约2.96 HU,计算两者的比值,得到NIC;e)无水碘密度图,显示同层面直肠癌的无水碘密度值为1.53 mg/mL;f)Eff-Z伪彩图,测得直肠癌的有Eff-Z值为8.28。
4.病理及免疫组化检查
采用BenChmark-XT罗氏仪器及免疫组化方法检测脉管神经侵犯情况。由两位病理专家对免疫组化染色结果进行判断,判断结果不一致时经协商达成一致意见。诊断标准:①血管腔内发现癌细胞即可判定为血管浸润阳性;②淋巴管内皮标记物免疫组化染色显示淋巴管内皮细胞的胞浆内和(或)胞膜上可见清晰的棕黄色或棕褐色颗粒为阳性表达;③如观察到肿瘤侵犯至神经周围且至少累及33%的神经周径,或者肿瘤细胞侵及神经外膜、神经鞘膜和神经内膜的任何一层,即判定为神经侵犯阳性,反之为阴性。
5.统计学分析
使用SPSS 23.0软件对所有测量数据进行统计分析。比较光谱CT各参数在不同病理及免疫组化特征组之间的差异。首先对各变量的数据进行正态分布检验,结果显示数据均符合正态分布,两组间比较采用独立样本t检验。利用ROC曲线分析动脉期和静脉期光谱CT定量参数对脉管神经侵犯的诊断效能。以P<0.05为差异有统计学意义。
结 果
1.病理和免疫组化结果
70例直肠癌患者中,中高分化组61例,低分化组9例;血管侵犯阳性组48例,血管侵犯阴性组22例;淋巴管侵犯阳性组59例,淋巴管侵犯阴性组11例;神经侵犯阳性组40例,神经侵犯阴性组30例;有淋巴结转移组49例,无淋巴结转移组21例。
2.光谱CT定量参数值及组间比较
动脉期和静脉期直肠癌不同分化程度组和不同脉管神经侵犯组之间能谱CT定量参数值及组间比较结果见表1~5。
动脉期:无水碘密度、CT值40 keV-VMI、NIC和Eff-Z在脉管侵犯组与无脉管侵犯组之间的差异有统计学意义(P<0.05);CT值PI和CT值VNC在脉管侵犯组与无脉管侵犯组之间的差异无统计学意义(P<0.05);各项光谱CT参数值在有和无神经侵犯组、中高分化组与低分化组以及有和无淋巴结转移组之间的差异均无统计学意义(P>0.05)。
静脉期:无水碘密度、CT值40 keV-VMI、NIC和Eff-Z在有和无脉管侵犯组之间的差异均有统计学意义(P<0.05);而CT值PI和CT值VNC在有和无血管侵犯组及有和无淋巴管侵犯组之间的差异均无统计学意义(P>0.05)。仅Eff-Z在有和无神经侵犯组、不同分化程度组以及有和无淋巴结转移组之间的差异有统计学意义(P<0.05)。
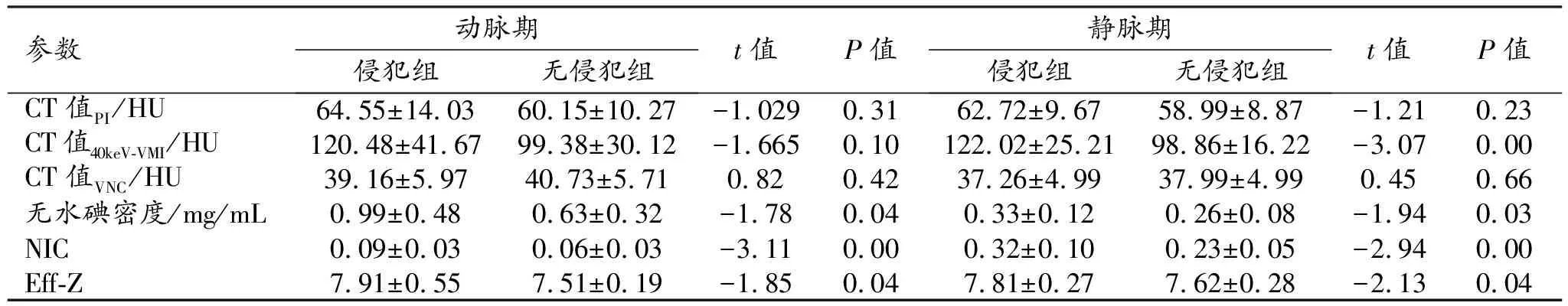
表2 有和无血管侵犯组双期光谱CT参数值的比较
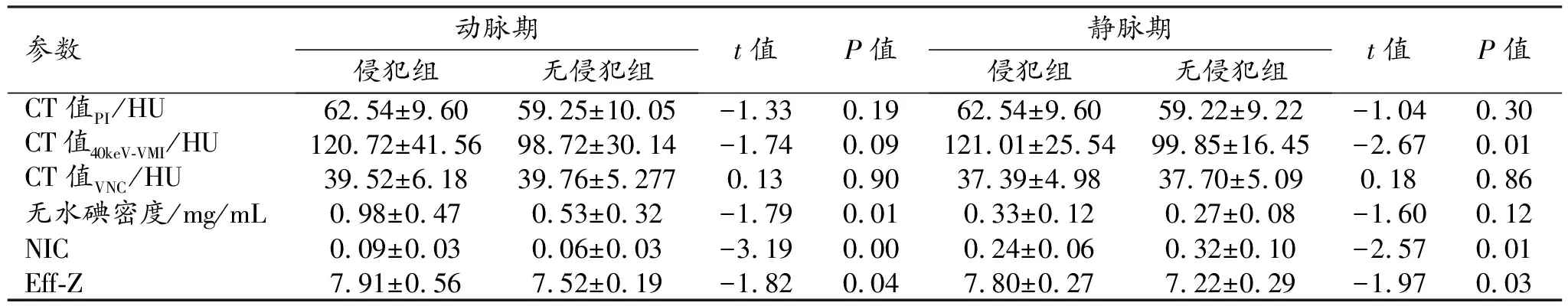
表3 有和无淋巴管侵犯组双期光谱CT参数值的比较
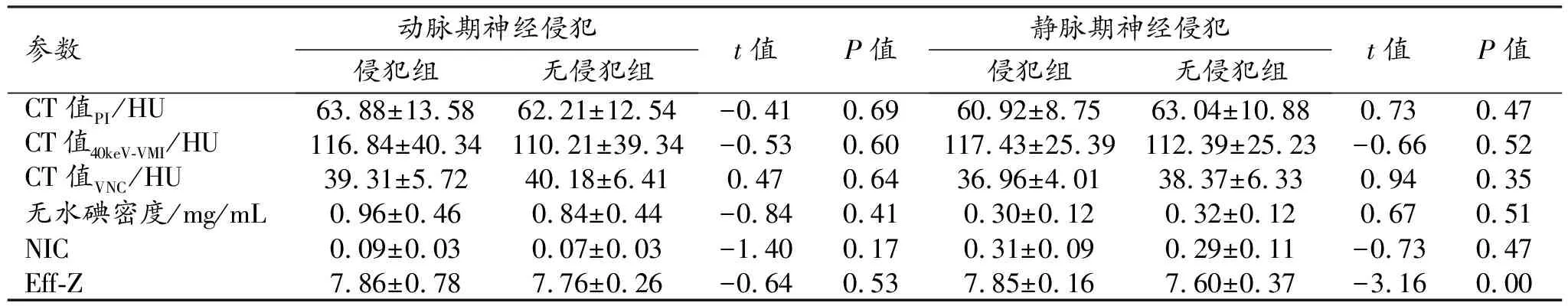
表4 有和无神经侵犯组双期光谱CT参数值的比较
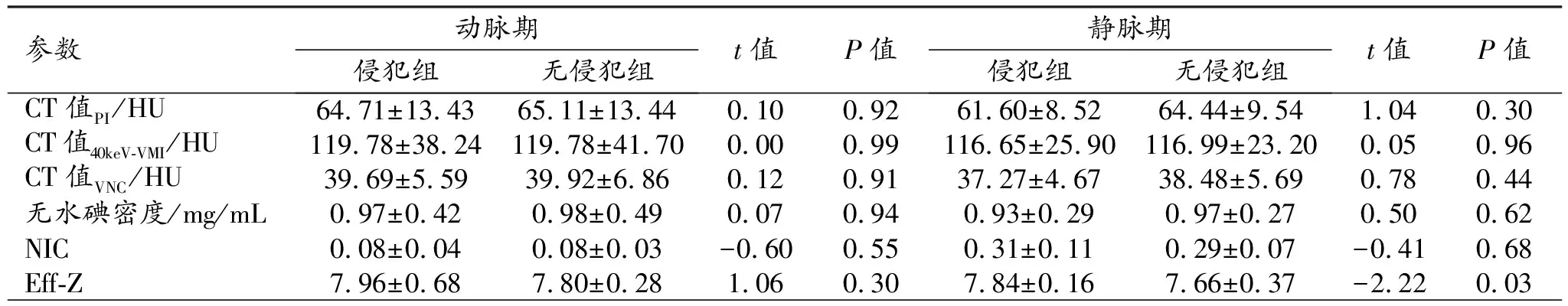
表5 有和无淋巴结转移组双期光谱CT参数值的比较
ROC曲线分析结果显示:动脉期无水碘密度、CT值40 keV-VMI、NIC和Eff-Z评价直肠癌淋巴管浸润的最佳阈值分别为0.06、100、0.05和7.62,AUC分别为0.74、0.69、0.75和0.74;评价直肠癌血管侵犯的最佳阈值分别为0.06、100、0.06和7.70,AUC分别为0.73、0.68、0.75和0.75。静脉期无水碘密度、CT值40 keV-VMI、NIC和Eff-Z评价淋巴管浸润的阈值分别为0.28、99.43、0.24和7.79,AUC分别为0.68、0.68、0.75和0.74;评价直肠癌血管浸润的阈值分别为0.27、99.55、0.24和7.78,AUC分别为0.71、0.76、0.76和0.72(图2)。

图2 光谱CT定量参数预测直肠癌脉管侵犯的ROC曲线。a)动脉期无水碘密度、CT值40keV-VMI、NIC和Eff-Z预测血管浸润的AUC分别为0.68、0.68、0.75和0.74;b)动脉期无水碘密度、CT值40keV-VMI、NIC和Eff-Z预测淋巴管浸润的AUC分别为0.71、0.76、0.76和0.72;c)静脉期无水碘、CT值40keV-VMI、NIC和Eff-Z预测直肠癌血管侵犯的AUC分别为0.73、0.68、0.75和0.75;d)静脉期无水碘、CT值40keV-VMI、NIC和Eff-Z预测直肠癌淋巴管浸润的AUC分别为0.74、0.69、0.75和0.74。
新型双层探测器光谱CT是基于探测器端实现能谱技术的CT设备,其独特的双层探测器设计能对单一千伏扫描时的高、低能量进行分离和解析,无需额外扫描,就能同时得到常规图像和能谱图像,数据的采集实现了同时、同源、同向和同步[9]。有效减少患者的照射剂量,提高图像的信噪比。获得的能谱图像可测量CT值40keV-VMI、CT值VNC、无水碘密度和Eff-Z等多种定量参数。40~60 keV VMI可以提高碘对比剂的强化效果,提高图像的密度分辨率。VNC是基于碘物质的识别,通过去除CT增强图像上的碘强化效果而获得的图像,测得的CT值与真实平扫接近,因此可替代CT平扫,从而降低检查过程中的辐射剂量。由于常规增强图像的碘密度值对肿瘤血供的评估准确性不够高[10],为了消除因个体循环和对比剂不同造成的差异,本研究中采用了NIC,即病灶内碘密度与同层面髂动脉碘密度的比值,这一概念在既往关于双能量成像的文献中已得到认同[11]。而无水碘密度图是一种水样组织被识别和抑制,从而增强显示各种含碘物质的图像。Eff-Z是人体化合物或混合物所对应的有效原子序数,如水的Zeff通常为7.4~7.5。
肿瘤脉管浸润包括血管浸润和淋巴管浸润,是指在脉管内存在肿瘤细胞簇或单个肿瘤细胞,或指肿瘤细胞破坏淋巴管壁和血管壁,也称脉管侵犯[12]。研究表明肿瘤在淋巴结内生长的前体可能是由于癌细胞通过淋巴管或小静脉的扩散造成的,且直肠癌脉管浸润时通常具有更高的侵袭性和更差的预后[13]。而判断脉管浸润的标准是通过免疫组化染色将血管的内皮细胞层染成棕褐色,若在棕褐色的管腔中出现了癌细胞即判断为血管侵犯,若肿瘤组织的淋巴管内有癌巢提示淋巴管内有侵犯[14]。本研究结果显示静脉期无水碘密度、CT值40keV-VMI、NIC和Eff-Z对判断肿瘤脉管侵犯有统计学意义(P<0.05)。分析原因,笔者认为无水碘密度、CT值40keV-VMI和NIC均是反映组织内含碘量的参数,直肠癌脉管侵犯时,肿瘤内新生血管扩张、管腔不规则、分支紊乱、管壁内皮细胞不成熟而通透性高、新生血管壁薄、没有或者只有游离的周细胞和疏松的基底膜等,当肿瘤侵犯脉管时,管壁进一步破坏,故对比剂外渗增加,肿瘤组织内及新生血管内对比剂易滞留。因此,脉管侵犯组的肿瘤内碘含量增加,用于评价肿瘤强化程度的无水碘密度、CT值40 keV-VMI和NIC可间接反映肿瘤内血管生长和脉管浸润情况。
有研究表明碘密度较CT值能更客观直接地反映肿瘤的血供和血管生成情况[15],与本研究得到的结果一致,本研究结果显示NIC在直肠癌脉管侵犯组与未侵犯组之间的差异有统计学意义(P<0.05),而CT值PI和CT值VNC在两组间的差异无统计学意义(P>0.05)。由于NIC能真正反映组织的强化特点,较CT值PI和CT值VNC能更准确反映肿瘤强化和脉管侵犯情况。同时本研究结果显示,脉管侵犯阳性组的CT值PI和CT值VNC明显大于阴性组,既往亦有文献报道双层探测器光谱CT测量的CT值40keV-VMI不仅能够提高对胰腺导管癌和肝脏乏血供肿瘤的诊断效能[16-17],且在对胰腺及胸部病变的观察方面40 keV VMI图像质量优于120 kVp PI[18-19]。
万幸等[20]认为双层探测器光谱CT成像中动脉期的碘密度及能谱曲线斜率对术前预测结直肠癌淋巴结转移具有一定价值。Liu等[21]的研究显示静脉期NIC判断直肠癌淋巴结转移更有价值,本研究结果亦显示静脉期NIC在判断脉管浸润方面明显优于动脉期NIC。分析原因笔者认为恶性肿瘤新生血管网丰富但欠成熟、血管脆性大,因此血流量、血容量和血管通透性明显增加。静脉期较动脉期除了采集时间不一致外,还可能与静脉期中病灶的强化是血管内增强和血管外空间对比剂渗透两种因素共同作用的结果[22],故静脉期NIC及无水碘密度能更准确地反映肿瘤组织的强化情况。
Eff-Z不同于CT值,其特点在于为每个像素加入了物质成分的信息,光谱CT扫描获得的Eff-Z图用色彩量化的方式反映ROI内所有物质的有效原子序数值。既往研究认为双层光谱探测器CT扫描测得的Eff-Z可用于定性和定量分析肿瘤的物质成份[23]。本研究结果显示静脉期Eff-Z较动脉期能更准确地反映直肠癌分化程度、脉管神经侵犯及淋巴结转移情况。原因是病灶强化越明显,碘含量越高,由于碘的原子序数值高,所以强化病灶的有效原子序数值就越高,这就增加了强化病灶与周围组织的对比,有利于更敏感地发现病灶及其对周围结构的侵犯,提高诊断准确性。
本研究存在以下不足之处:①为单中心和小样本研究,可能存在选择偏倚;②本研究中部分直肠癌患者肠道准备欠佳。③采用的是单个小ROI的勾画方法,未测量整个病灶的数据,可能造成偏倚,影响数据测量的准确性。
综上所述,双层探测器光谱CT定量参数可反映组织微观结构的变化,从而能够较准确地反映直肠癌的生物学特征,为临床提供直肠癌预后评估的影像生物标记物。
