CT影像组学预测肾透明细胞癌核分级:扫描期相及ROI勾画策略
2022-12-20徐向东罗诗维韦瑞丽张婉丽姚旺丁文双庞欣蕊王晔杨蕊梦赖胜圣
徐向东,罗诗维,韦瑞丽,张婉丽,姚旺,丁文双,庞欣蕊,王晔,杨蕊梦,赖胜圣
肾细胞癌(renal cell carcinoma,RCC)是最常见的肾脏原发恶性肿瘤,约占肾脏肿瘤的90%~95%[1]。其中,透明细胞肾细胞癌(clear cell renal cell carcinoma,ccRCC)是RCC中最常见的亚型,预后最差[2]。既往研究证实:病理核分级是判断ccRCC预后的独立影响因素,对其个体化治疗措施的制订尤为重要[3]。现阶段,Fuhrman核分级系统是最常用的ccRCC病理核分级体系[4],但其诊断依赖于经皮穿刺活检或术后组织样本,存在有创性、滞后性或易出现并发症及取样偏倚等缺点[5]。
近年来,基于无创性医学影像检查的影像组学在临床肿瘤领域的应用受到越来越多的关注,它可以通过高通量提取医学图像的信息定量评估肿瘤分期、病理分型和治疗预后,进而指导临床决策的制定[6]。既往研究报道采用影像组学方法对ccRCC进行病理高低核级别预测,并取得了良好的预测效果,然而,肾脏的CT四期动态扫描各具特点,对纳入影像组学分析的最优CT期相选择尚不统一[7-10]。此外,作为影像组学分析流程中的重要一环,感兴趣区(region of interest,ROI)的勾画策略仍存在争议[11,12]。有研究者建议选用肿瘤最大层面2D-ROI,认为2D-ROI已能提供足够的影像信息,且勾画较为简便;而有研究者认为三维全瘤感兴趣区(3D-ROI)能提供更全面的信息,如3D形态学特征等。因此,本研究旨在探讨不同CT扫描期相及不同ROI勾画策略(2D-ROI或3D-ROI)对影像组学方法预测ccRCC核分级效能的影响。
材料与方法
1.病例资料
回顾性搜集2011年1月-2019年1月在本院就诊且符合研究要求的137例ccRCC患者的临床和影像资料。纳入标准:①病理证实为ccRCC且有完整的Fuhrman核分级信息;②术前行腹部CT平扫及三期增强扫描。排除标准:①囊性ccRCC;②CT图像上有明显伪影,图像质量欠佳。
2.病理检查和Fuhrman分级
病理切片Fuhrman核分级由具有9年泌尿系统病理诊断经验的病理医师完成。为确保病理诊断的可重复性和减少观察者间差异性,传统的4级Fuhrman核分级系统被简化为低级别(1级和2级)和高级别(3级和4级)。
3.CT检查方法
使用Toshiba Aquilion One(14例)、Siemens Somatom Definition(36例)、GE HiSpeed 16(14例)和Philips Brilliance 64(73例)螺旋CT机。扫描参数:120~140 kV,自动管电流调控。增强扫描采用高压注射器经肘静脉注入非离子型碘对比剂(剂量1.0~2.0 mg/kg)。依次采集4个期相的CT图像:平扫期(unenhanced phase,UP);增强扫描肾皮髓质期(corticomedullary phase,CMP),注射对比剂后约30 s启动扫描;增强扫描肾实质期(nephrographic phase,NP),注射对比剂后约70 s启动扫描;增强扫描肾排泄期(excretory phase,EP),注射对比剂后180~300 s启动扫描。
4.ROI的勾画方法
由两位分别有4年及5年影像诊断经验的放射科医师在不知病理结果的情况下使用ITK-SNAP软件完成肾脏肿瘤2D-ROI及3D-ROI的勾画。选取病灶最大层面沿病灶边缘进行2D-ROI的勾画;按照上述方法逐层勾画病灶的ROI,软件即可自动生成病灶的3D-ROI。先在肾实质期图像上进行勾画,再将所获得的各层2D-ROI复制到其它3个期相的图像上,依据情况进行略微调整(图1)。采用集合相似度度量函数Dice系数来评估两位医师所勾画ROI的相似度。对于Dice系数>0.9的病例,取两位医师勾画区域的交集;对于Dice系数<0.9的病例,两位医师通过进一步分析和讨论来解决沿病变边界勾画ROI时的差异问题,以达成一致。
5.影像组学特征的提取及模型建立
首先,使用Pyradiomics软件,在每个期相的图像上分别基于2D-ROI和3D-ROI提取病灶的形态学特征、直方图特征及纹理特征。然后采用22种特征选择方法[conditional infomax feature extraction (CIFE),conditional mutual information (CMIM),double input symmetrical relevance (DISR),interaction capping (ICAP),joint mutual information (JMI),mu-tual information based feature selection (MIFS),mutual information maximisation (MIM),minimal redundancy maximum relevance (MRMR),fisher_score,lap_score,relevant features (reliefF),spectral feature selection (SPEC),trace_ratio,ll_121,ls_121,multi-cluster feature selection (MCFS),nonnegative discriminatve feature selection (NDFS),robust feature selection (RFS),unsupervised discriminative feature selection (UDFS),f_score,gini-index,t_score]分别与8种分类算法[逻辑回归(logistic regression,LR),支持向量机(support vector machine,SVM),朴素贝叶斯(naïve bayers),K-近邻算法(K-nearest neighbor,KNN),决策树(decision tree,DT),Bagging引导聚类算法,随机森林(random forest,RF),自适应增强算法(adaptive boosting,AdaBoos-ting)]进行组合用于构建影像组学模型,共建立了176(22×8)个预测模型,并采用五折交叉检验法验证模型的效能。为了减少病例队列数据数量不均衡产生的影响,通过引入合成特征样本,采用合成少数类过采样技术(synthetic minority oversampling technique,SMOTE)对高级别ccRCC组进行过采样。模型的鉴别效能采用ROC曲线下面积(area under the curve, AUC)、符合率、敏感度和特异度等指标进行定量分析。
6.统计学分析
使用SPSS 20.0软件进行统计学分析。比较ccRCC核分级高级别组和低级别组之间临床特征及影像学特征的差异。计量资料的组间比较采用独立样本t检验,二分类变量的组间比较采用卡方检验。以P<0.05为差异有统计学意义。
结 果
1.临床及常规影像学特征的比较
137例中低级别ccRCC组96例(1级15例,占10.9%;2级81例,占59.1%)及高级别ccRCC组41例(其中3级32例,占23.4%;4级9例,占6.6%)。两组患者的临床和病灶特征的比较见表1。两组之间年龄、性别构成和病灶直径的差异均无统计学意义(P>0.05)。
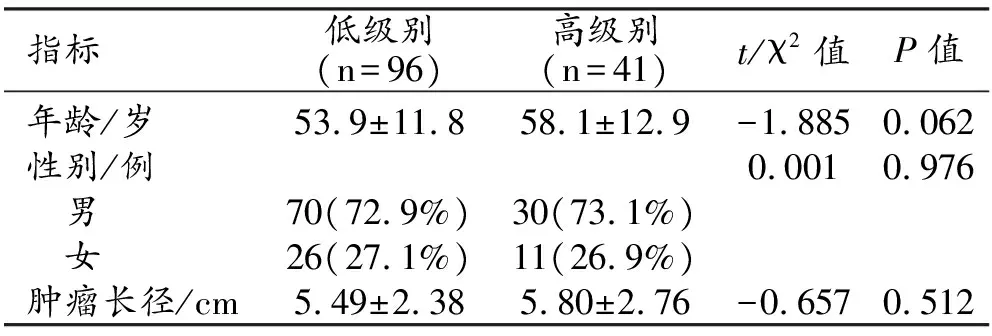
表1 高、低核分级ccRCC患者临床和影像学特征的比较
2.模型诊断效能对比
每个期相的图像上,基于2D-ROI或3D-ROI各提取了107个组学特征,基于不同的算法组合,各建立了176个预测模型。采用ROC曲线分析模型预测高级别ccRCC的效能,每个期相中基于2D-ROI和3D-ROI构建的模型中AUC最大的5个模型的效能指标的平均值见表2。结果显示,每个期相基于3D-ROI构建模型的AUC平均值要大于2D-ROI,相应的符合率、敏感度和特异度大部分也有类似表现,即基于3D-ROI的影像组学模型显示出更好的预测能力。此外,在四个期相中,平扫期的平均AUC明显高于其它3个期相,提示基于平扫图像的组学特征模型具有更好的诊断效能。基于2D-ROI和3D-ROI的平扫期各组学模型的AUC热图见图2。总体而言,基于3D-ROI的模型与基于2D-ROI的模型相比预测效果更好。其中KNN分类算法在两组中均显示出较好的效能,而DT算法在两组均表现不佳。
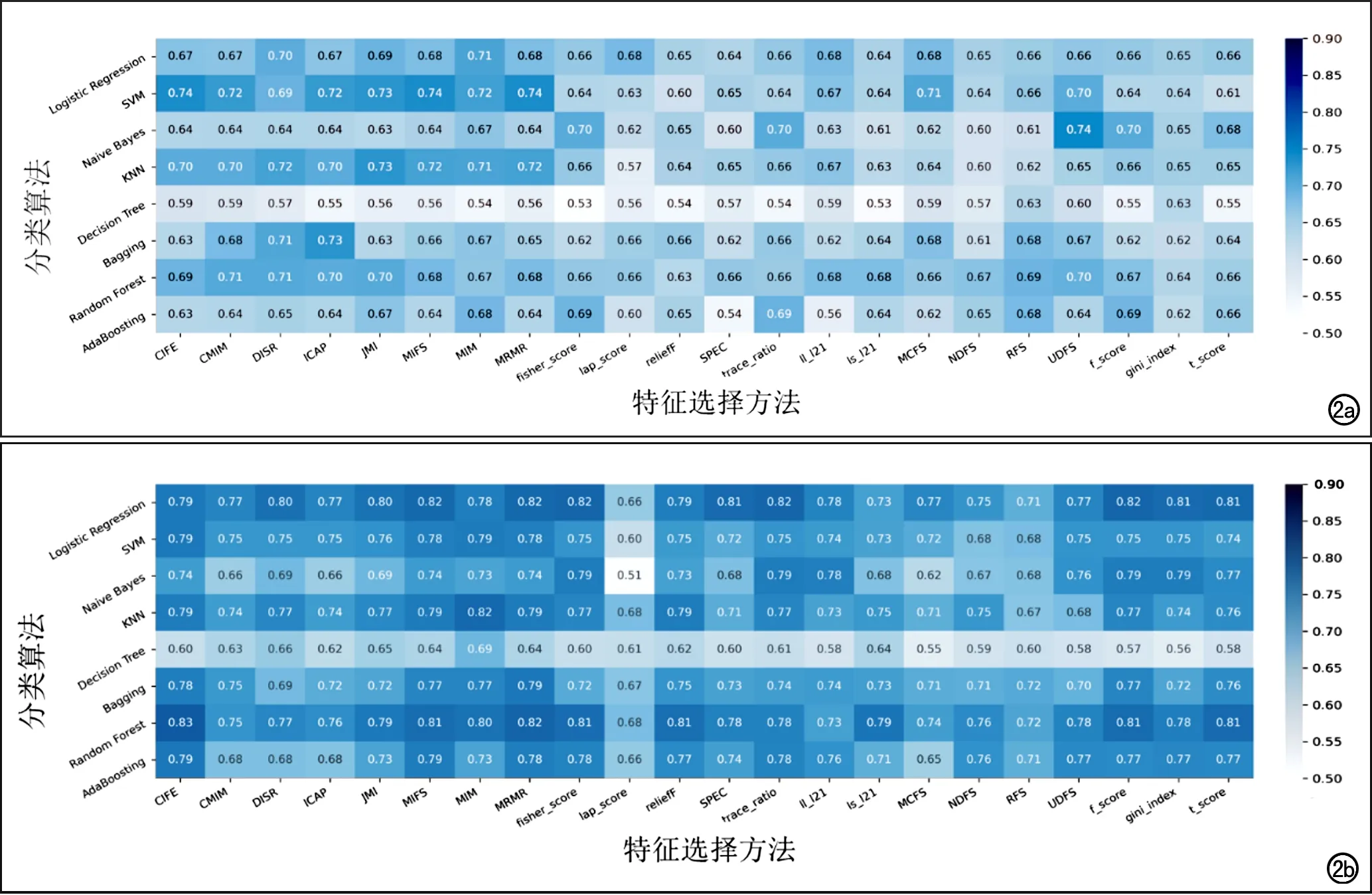
图2 平扫期CT图像上基于2D-ROI(2a)和3D-ROI(2b)提取的影像组学特征构建的176个预测模型的AUC热图。
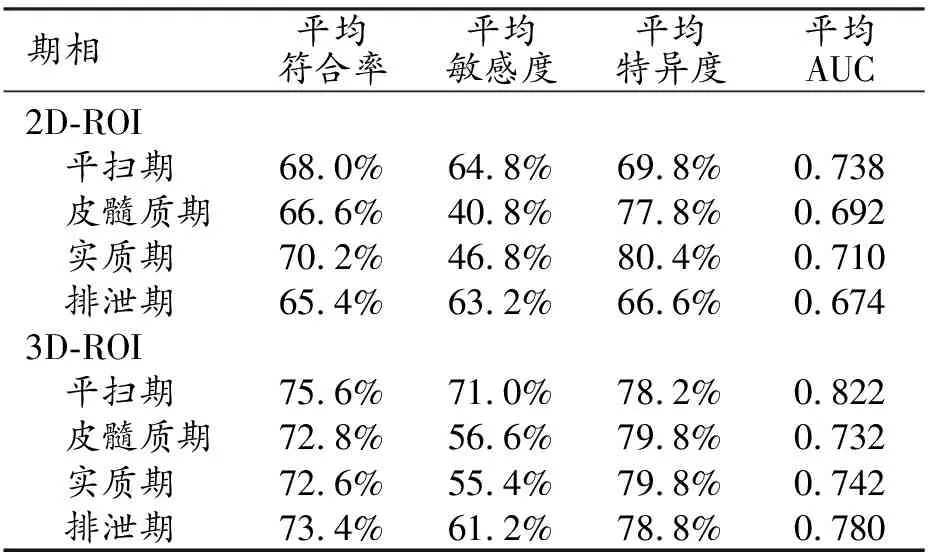
表2 四期CT图像基于2组构建的组学模型的效能指标值
讨 论
核分级作为ccRCC的独立预后因素,可为治疗策略的制订提供重要参考[13]。若能在术前了解ccRCC的核分级信息,将对临床诊疗的实施提供关键性帮助[2]。穿刺活检是术前评估肾肿瘤的常用手段,但其为有创性检查存在发生并发症的可能,而且其诊断效能依赖于取样技术和经验等[14]。影像学检查作为临床上广泛应用的无创性评估肾肿瘤的方法,为临床诊疗提供了很多指导和帮助,而近年来出现的影像组学方法可进一步挖掘医学影像的潜在价值,有望为临床诊疗提供更多信息。
目前基于CT的影像组学方法已经广泛应用于腹部疾病的研究[15],在肾脏肿瘤方面的研究主要集中在肾脏良恶性肿瘤的鉴别和肾细胞癌的核分级[16-18]。ROI的勾画作为影像组学分析基本流程中至关重要的一环,影响到所提取的影像组学特征的可重复性和稳定性,进一步决定了后续机器学习模型的效能[19]。其中,选择肿瘤最大层面的2D-ROI还是肿瘤多个层面的3D-ROI一直存在争议。2D-ROI更容易获得,耗费的人力更少,复杂度更低,后续的计算速度更快。而3D-ROI包含了肿瘤的每一个层面,可提供更多关于肿瘤的信息,如三维形态学信息,但其勾画比较耗费人力和时间。Yang等[20]对比了基于2D-ROI和3D-ROI的CT纹理分析在预测肺腺癌淋巴管和血管侵犯方面的效能,结果显示基于2D-ROI的预测效能优于3D-ROI。Shen等[12]对比分析了二维和三维CT影像组学特征在预测非小细胞肺癌(NSCLC)预后方面的效能,发现两者预测能力相似,但考虑到二维ROI更容易获取,因此更推荐采用二维特征进行预测。Xu等[11]探索了应用二维和三维影像组学特征在多种肿瘤(肝内胆管细胞癌、高级别骨肉瘤、胰腺神经内分泌肿瘤)早期复发、淋巴结转移、5年生存率及病理分级预测中的效能,结果显示两种方法提取的组学特征都有一定的预测效能,但三维影像学特征的表现优于二维,因此更推荐在影像组学研究中采用三维影像特征。在本研究中,我们对比了2D-ROI和3D-ROI对CT影像组学模型预测ccRCC核分级的影响,结果显示基于3D-ROI的组学模型的综合诊断效能更优,为后续肾癌影像组学研究提供了参考。
在肾癌影像组学研究中,在扫描期相的选择方面也一直存在争议。有研究者仅选取单个期相进行影像组学研究。如Bektas等[7]自门静脉期CT图像上提取二维纹理特征,建立多个机器学习分类器来预测ccRCC核分级,结果显示基于SVM的模型表现最佳,AUC达0.860。Kocak等[9]的研究中仅在平扫CT图像上提取病灶的纹理特征,并分别采用人工神经网络和二进制逻辑回归分析建立模型来预测ccRCC的核分级,相应的AUC分别达0.714和0.656。更进一步的研究中,有学者选用多个增强扫描期相的图像提取影像组学特征,探讨哪一期相或哪几个期相联合构建的模型能取得更好的效果。Haji-Momenian等[21]选取小ccRCC(<4 cm)的平扫期、皮髓质期和实质期CT图像进行影像组学分析,并采用4种算法(KNN、SVM、随机森林和决策树)构建组学模型来预测ccRCC核分级,结果显示这4种算法利用皮髓质期的直方图特征构建的模型的预测效果最佳,AUC达0.97。Shu等[22]选用皮髓质期和实质期增强CT图像进行影像组学分析来预测ccRCC的核分级,结果显示基于皮髓质期、实质期和两者联合的组学模型的AUC分别为0.766、0.818和0.822。在本研究中,我们发现不论是选用2D-ROI还是3D-ROI,平扫期对ccRCC核分级的鉴别效果均优于其它期相。对此可能的解释是ccRCC病理核分级由肾癌细胞核大小、不规则性及核仁显著性决定,相较于反映肾癌血流动力学情况的动态增强期相而言,保留肿瘤细胞核的形态学特征的平扫期对核级的鉴别效果更好。
本研究存在一定的局限性:①纳入研究的样本量较小,且缺乏外部验证集,这是由于病例纳入标准较为严格,需要具备4期CT图像,后续需进一步扩充样本量;②本研究采用的是Fuhrman核分级系统,没有选择新的WHO/ISUP核分级系统,这是由于我们自2011年开始搜集数据,当时主要采用的是Fuhrman核分级,WHO/ISUP对病理医师评判时病理切片的放大倍数有严格要求,有些病例的病理组织切片已缺失;③目前仅对单个扫描期相进行研究,未对多种期相组合的情况进行探索,后续有待完善;④本研究中病例检查采用了多台CT扫描设备,可能对影像组学特征的稳定性造成影响,但这在一定程度上也可以弥补缺乏外部验证集的不足。
综上所述,本研究结果初步表明基于3D-ROI建立的影像组学模型在预测ccRCC核分级方面的表现优于2D-ROI建立的模型,基于平扫期的组学模型比其它期相的表现更佳。这为ccRCC影像组学的应用提供了参考,也需要进一步探索改进分割的方法,更好地推进影像组学在医学领域的应用。
