基于临床-影像组学列线图模型术前预测进展期胃癌神经侵犯的价值
2022-12-20黄钰迅李瑞张宝腾牛猛刘钊郭顺林
黄钰迅,李瑞,张宝腾,牛猛,刘钊,郭顺林
胃癌是全球癌症死亡的主要原因之一,是仅次于结直肠癌的消化道第二大常见肿瘤[1]。早期胃癌症状不明显,大多数患者在就诊时已为进展期。外科手术是胃癌主要的治疗方式,但预后较差,在我国,约42.5%的患者在根治性切除术后两年内复发[2],肿瘤复发已成为胃癌患者主要的死亡原因[3]。一系列研究表明周围神经侵犯(perineural invasion,PNI)与进展期胃癌(advanced gastric cancer,AGC)的复发和不良预后有关[4-6]。PNI是指肿瘤周围的神经束膜或神经束被癌细胞侵袭的过程,是肿瘤发生转移的途径之一[7],只能在术中和术后进行评估。若能术前无创性预测PNI,经术中扩大手术切除及淋巴结清扫范围(包括腹主动脉旁淋巴结清扫)以及术前、术后使用5-氟尿嘧啶联合顺铂辅助化疗(FP方案),可有效改善AGC患者的预后[8-9]。目前,还没有结合临床和影像组学特征的列线图模型对AGC患者进行术前预测PNI的相关报道。本文拟探讨基于增强CT影像组学特征和临床独立危险因素构建的列线图模型术前预测AGC患者发生PNI的价值,旨在优化术前决策,改善AGC患者的预后。
材料与方法
1.研究对象和临床资料
搜集2018年6月-2021年8月本院收治的符合本研究要求的171例AGC患者的病例资料。纳入标准:①术前行腹部增强CT检查;②行胃癌根治性切除术,术后病理确诊为AGC且伴有PNI;③临床资料完整。排除标准:①术前已接受过AGC相关治疗;②CT图像质量较差或病灶太小,影响ROI的勾画;③有其它肿瘤病史。按7∶3的比例将所有病例随机分为训练集(119例)和验证集(52例),训练集的数据用于构建模型,验证集的数据用于验证模型。
记录患者的术前临床资料,包括年龄、性别、血清白蛋白、中性粒细胞与淋巴细胞比值(NLR)、糖类抗原19-9(carbohydrate antigen 19-9,CA19-9)和癌胚抗原(carcinoembryonic antigen,CEA)、病理结果、以及CT报告的T、N分期、肿瘤最大径和肿瘤部位。病理检查是由两位资深的病理科医师对所有标本的HE染色和S-100染色切片进行分析,S-100染色阳性判断为PNI阳性[10]。S-100染色阳性是指在显微镜下,细胞质和细胞核的抗原位点出现黄色或棕黄色着色。
2.CT检查方法
使用Siemens Somatom go.Top 64排螺旋CT机。扫描参数:120 kV,110 mAs,层厚1.0 mm,矩阵512×512,视野350 mm×350 mm,球管旋转一周时间0.5 s,螺距0.8。扫描前经肘静脉注射碘佛醇(320 mg I/mL),注射流率2.5~3.5 mL/s,剂量1.0 mL/kg,于注射后60 s行静脉期增强扫描。
3.影像组学分析
勾画ROI和提取影像组学特征:使用ITK-SNAP3.8.0软件,由两位资深放射科医师独立在每例患者的横轴面静脉期CT图像上沿着肿瘤边缘逐层勾画ROI,避开肉眼可见的坏死区和血管,软件自动生成病灶全容积ROI(volume of interest,VOI)的三维图像(图1)。然后将VOIs导入3D-Slicer 4.10.2软件,提取直方图、形态、灰度相关矩阵(gray level dependence matrix,GLDM)、灰度共生矩阵(gray level co-occurrence matrix,GLCM)、灰度游程矩阵(gray level run length matrix,GLRLM)、灰度大小区域矩阵(gray level size zone matrix,GLSZM)和邻域灰度差矩阵(neighbouring gray tone difference matrix,NGTDM)参数共1037个影像组学特征。使用 Z-scores[=(x-μ)/σ;其中x表示特征值,μ表示所有患者该特征值的平均值,σ表示对应的标准差]对所有特征进行归一化处理,采用组内相关系数(interclass correlation coefficient,ICC)评价基于2位医师勾画ROI所提取的各项影像组学特征的一致性,并选取ICC大于0.75的特征用于后续分析[11-12]。
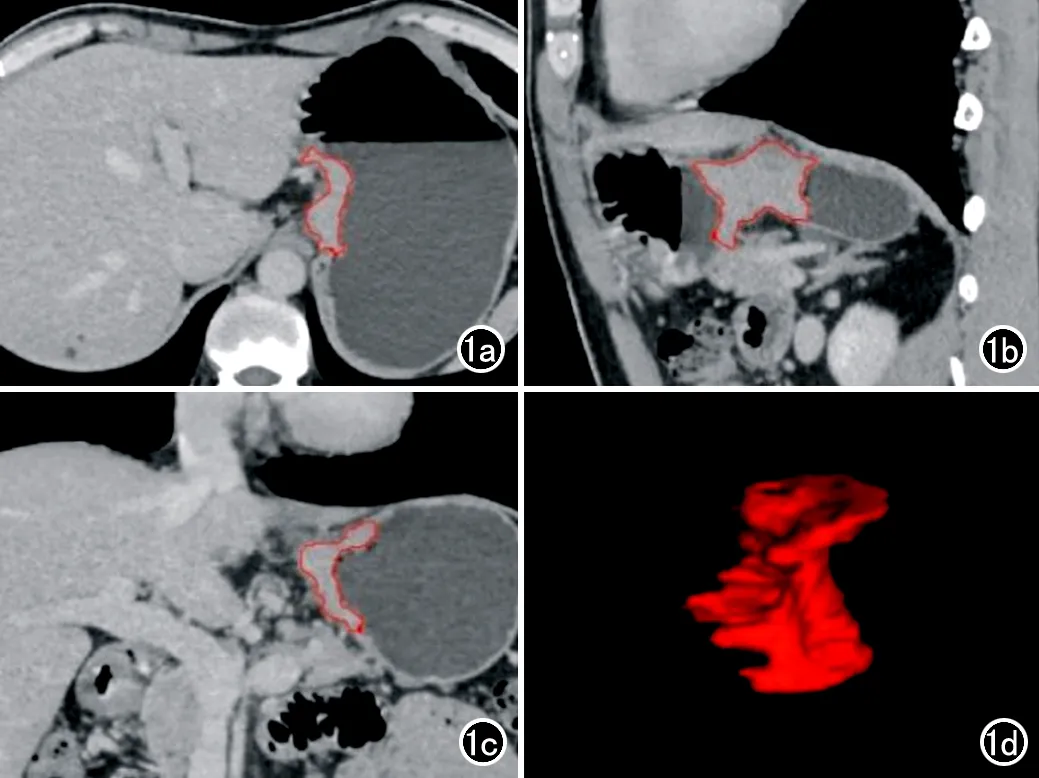
图1 肿瘤ROI勾画示意图。a)横轴面图像;b)矢状面重组图像;c)冠状面重组图像;d)病灶分割后获得的VOI三维图像。ROI勾画主要在横轴面上进行,矢状面及冠状面重组图像供参考和调整使用。当病灶边界及其范围不太确定时,需要多个方位观察病灶,进行综合判定,此时可以参考其它2个方位的图像,对所画ROI进行调整。此处勾画ROI用到的软件ITK-SNAP,在横轴位勾画ROI后,会自动把其它两个方位图像的ROI也显示出来。
依次使用Spearman相关性分析(系数ρ为0.9)和最小绝对收缩与选择算子(least absolute shrinkage and selection operator,LASSO)进行特征降维,筛选出最具预测价值的影像组学特征,然后将筛选出的特征纳入多因素logistic回归并构建影像组学模型(V)。然后根据各项特征的回归系数,计算每个患者的影像组学标签(Radscore)值,计算公式为:
(1)
其中αi表示回归系数, Xi表示特征值,β表示截距。
4.模型的构建
对纳入的临床资料先后进行单因素和多因素logistic回归分析,将筛选出的临床独立危险因素构建临床预测模型(C),然后结合V-Radscore来构建组合模型(V+C),并构建列线图。然后将验证集数据代入列线图模型进行验证。
5.统计学方法
使用SPSS 25.0软件进行统计分析,以P<0.05为差异具有统计学意义。分类变量和不符合正态分布的连续变量分别用数量(百分比)和M(Q1~Q3)表示,组间比较分别采用χ2检验和Mann-WhitneyU检验。使用Hosmer-Lemeshow检验和校准曲线评估列线图模型的拟合程度,采用ROC曲线下面积(AUC)和决策曲线分析(decision curve analysis,DCA)衡量模型的鉴别效能和临床应用价值,利用DeLong检验进行各模型间AUC差异的比较。
结 果
1.临床资料比较
PNI组和无PNI组患者各项临床资料的单因素分析结果见表1。
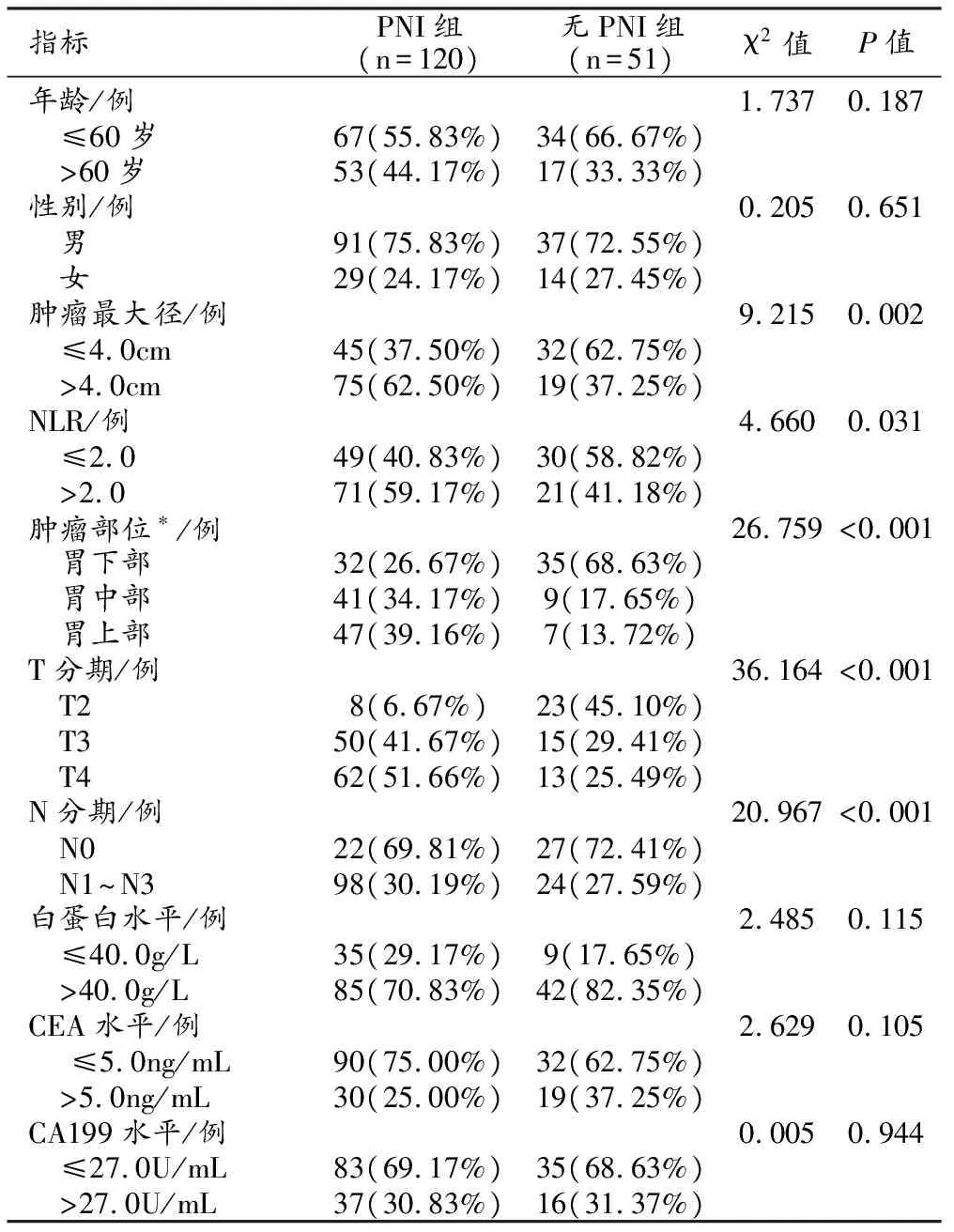
表1 患者临床资料单因素分析结果
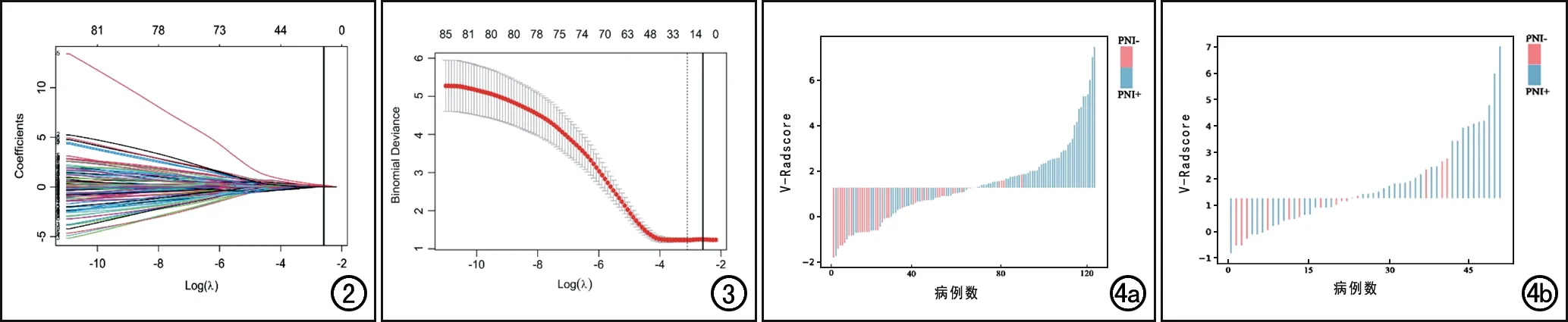
图2 LASSO回归的变量解析路径图。每条线代表一个变量,图片上方的数字是剩余非零系数变量的个数。图3十折交叉验证图。图中红点及所在线段上下端之间分别表示每个log(λ)值对应的二项式偏差的均值及其范围,黑色实线对应的log(λ)值为通过十折交叉验证确定的最优惩罚系数(-2.59),对应的变量数为8个。 图4影像组学标签值直方图,显示2个数据集中,PNI组的Radscore值显著高于无PNI组。a)训练集;b)验证集。
肿瘤最大径、NLR、肿瘤部位、T分期及N分期在两组间的差异均有统计学意义(P<0.05),而的年龄、性别及术前白蛋白、CEA和CA199水平的组间差异均无统计学意义(P>0.05)。
2.特征筛选和模型构建
基于每位医师在增强CT静脉期图像病灶得到的VOIs,共提取了1037个影像组学特征。对两位医师勾画ROI获得的组学特征进行一致性分析,结果显示一致性均较好,ICC值的中位数为0.861(95%CI:0.758~0.920)。对ICC值>0.75的927个组学特征进行筛选和降维(图2~3),最终筛选出8个最佳组学特征。
将这8个特征纳入多因素logistic回归分析并构建组学模型,得到回归方程的截距和特征对应的回归系数,截距为1.2795,特征对应的系数见表2。同时根据构建的影像组学模型,计算每例患者的V-Radscore值,详见图4。无论是在训练集还是验证集中,PNI组的Radscore值[1.53(0.72,2.48);1.74(0.64,3.44)]均高于无PNI组[0.16(-0.70,0.97);1.02(0.06,1.35)],差异均有统计学意义(Z=5.328,P<0.001;Z=2.030,P<0.05)。
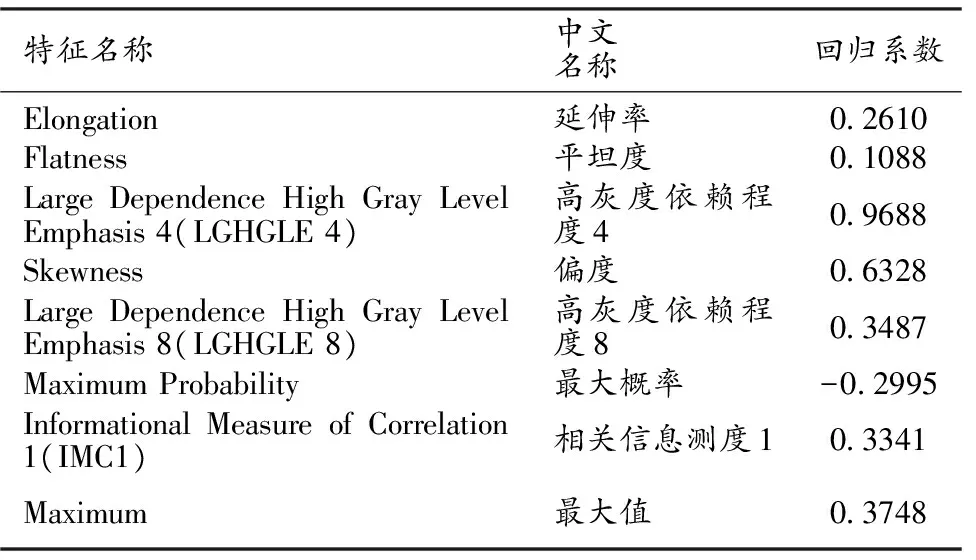
表2 筛选出的8个组学特征的回归分析结果
然后,将P<0.05的临床指标和V-Radscore纳入多因素logistic回归分析,结果见图5。各项临床指标中仅CT报告的T、N分期和肿瘤部位是PNI的独立危险因素(P<0.05);此外,V-Radscore也是PNI的独立危险因素。获得的临床预测模型(C)和联合模型(C+V)的表达式:
(2)
(3)
其中,a=0.830×site2+1.452×site3+1.622×T3+2.203×T4+1.022×N1-1.883;b=0.561×site2+1.108×site3+1.669×T3+1.855×T4+1.259×N1+0.769×Radscore-2.611(公式中site代表肿瘤部位,site1代表胃下部,site2代表胃中部,site3代表胃上部;N1~N3分期的分值相应为1~3,T1~T4分期的分值相应为1~4)。随即,根据C+V公式中各变量的权重系数,绘制联合模型的列线图(图6)。
3.各类模型诊断效能的评估
采用ROC曲线分析临床、影像组学模型和列线图模型在训练集和验证集中预测PNI的效能,结果见表3和图7。三个模型中,列线图模型在训练集和验证集中都具有最大的AUC(0.881、0.865)。DeLong检验显示,列线图模型与临床、影像组学模型之间AUC的差异均具有统计学意义(训练集:P值分别为0.003和0.026;验证集:P值分别为0.035和0.037),表明列线图模型为最佳预测模型,诊断效能最高。
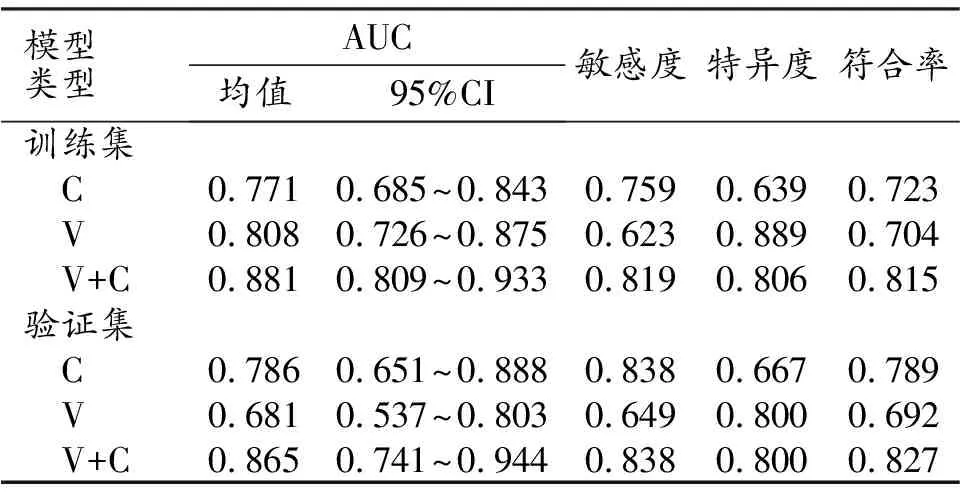
表3 各个模型预测效能指标值
采用Hosmer-Lemeshow检验评估列线图模型的诊断效能,结果显示列线图模型拟合良好,在训练集和验证集中的卡方值分别为5.846(P=0.664)和8.170(P=0.417)。绘制列线图模型在训练集和验证集中的校准曲线(图8)。在训练集和验证集中,列线图的理论校准曲线和实际校准曲线与参考线基本重合,表明预测概率与实际概率一致性良好。
图5 多因素logistic回归分析森林图,OR为比值比。 图6基于临床特征和V-Radscore构建的术前预测进展期胃癌PNI的列线图。计算方法:将每个变量对应的值垂直投射到最上方的评分标尺(Points),可得到一个评分值,把所有指标的评分值相加得到的总分投射到总评分标尺(Total Points),最后定位到概率(Possibility)轴,得到的值即为存在PNI的概率。
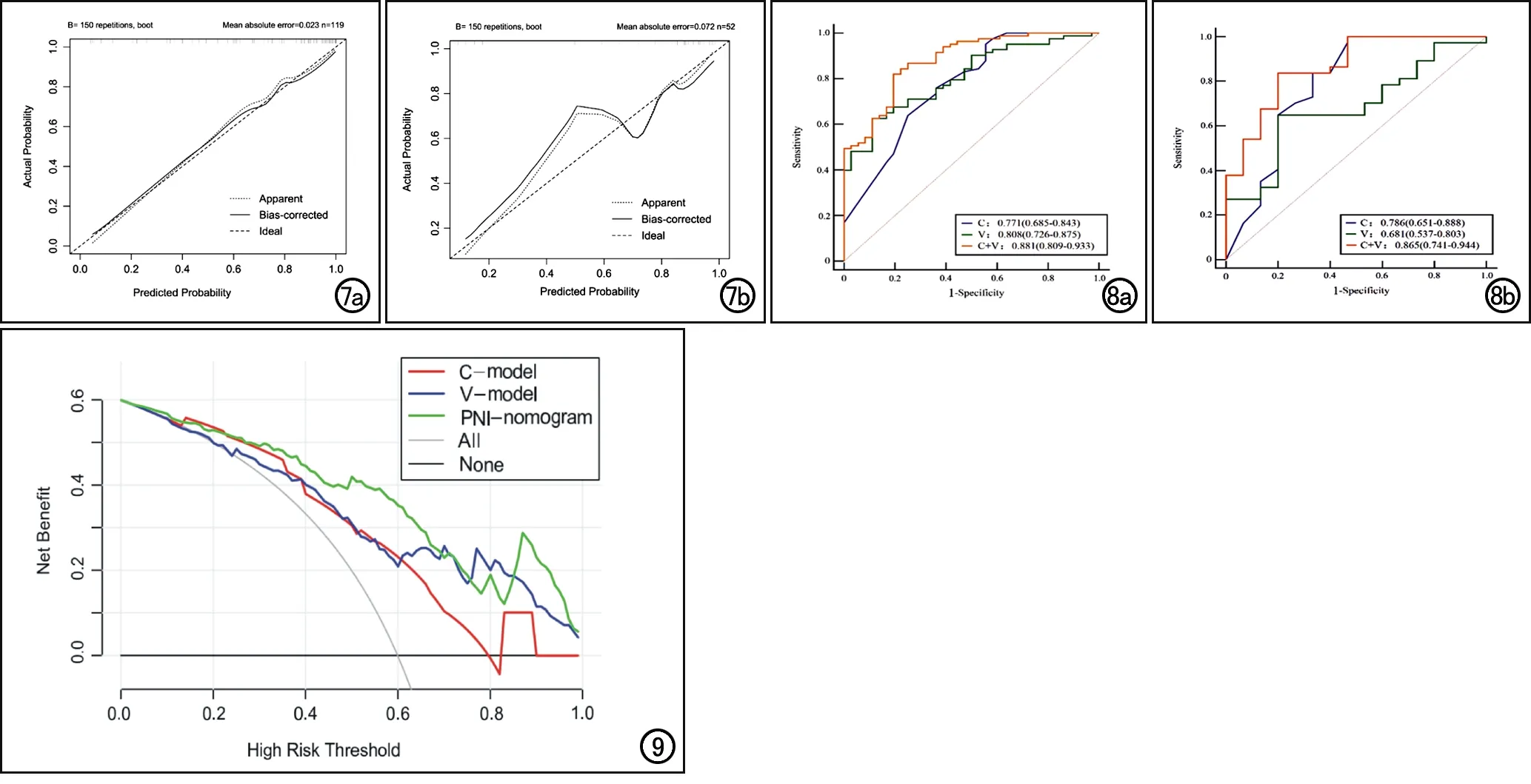
图7各模型的ROC曲线,2个数据集中均以联合模型的AUC值最大。a)训练集;b)验证集。 图8列线图模型的校准曲线。纵轴为实际存在PNI的概率,横轴为列线图模型预测存在PNI的概率。Apparent指理论校准曲线,Bias-corrected指实际校准曲线,Ideal指参考线,理论校准曲线和实际校准曲线越接近参考线说明列线图的预测结果与实际结果的一致性就越好。a)训练集中,理论校准曲线和实际校准曲线与参考线基本重合,表明列线图的预测概率与实际概率一致性良好;b)验证集中,理论校准曲线和实际校准曲线与参考线基本重合,表明列线图的预测概率与实际概率一致性良好。 图9三个模型术前预测PNI的DCA曲线。横坐标为阈值概率,纵坐标为净效益。横线为所有患者均不干预,净效益为0;灰线为所有患者均进行干预,净效益为斜率为负值的反斜线。图中显示在大部分的阈值概率范围内,列线图模型比临床模型和影像组学模型具有更高的净效益。
采用DCA方法评估3个模型的临床价值。与临床和影像组学模型相比,列线图模型在大部分阈值概率范围内净获益最高(图9),表明其临床应用价值最大。
讨 论
近年来有研究显示PNI是胃癌潜在的转移方式[6-7],与胃癌的生物学行为密切相关,且被证实为胃癌术后复发和预后的独立危险因素[13-14]。既往研究多探讨PNI对胃癌预后的影响,而关于PNI术前预测的报道较少[15-16],本研究构建了临床与影像组学特征相结合、用于术前预测PNI的列线图模型,该模型基于患者的术前资料,具有较好的临床应用普适性。
在模型纳入的临床独立危险因素中,PNI的发生与肿瘤部位有显著相关性(P=0.045),可能是由于胃靠近腹腔神经丛的原因,其中胃上部肿瘤发生PNI的风险最大(OR=3.788),与既往研究结果基本一致[17];在CT报告的T分期中,PNI阳性率从T2期的25.81%增加到了T3和T4期的76.92%和82.67%,表明PNI与肿瘤浸润深度之间也存在显著相关性(P=0.012),这可能是因为肿瘤浸润深度越深,越容易侵犯腹腔神经丛;此外,CT报告的N分期方面,N1~N3期患者的PNI阳性率显著高于N0期(P=0.019),Yang等[18]的研究也表明T、N分期与胃癌PNI关系密切。因此对于浸润深度较大、有淋巴结转移且位于胃上部的胃癌患者,可在围手术期行FP化疗方案,术中扩大切除及淋巴结清扫范围,术后密切随访,可提高生存率。本研究中PNI的发生与肿瘤最大径无显著相关性(P=0.902),与De等[19]的研究结果不同,可能与样本量较少或本组病例中肿瘤最大径较小[(4.84±2.12)cm]有关。
本研究中列线图模型纳入的静脉期影像组学标签与PNI阳性密切相关(P<0.001)。为避免多重共线性及过拟合等问题,本研究中采用LASSO回归共筛选出延伸率等共8个特征。延伸率显示ROI形状中两个最大主成分之间的关系;平坦度显示ROI形状中最大和最小主成分之间的关系,它们与肿瘤浸润深度密切相关;高灰度依赖程度衡量图像中灰度值的相关性和联合分布,可表现肿瘤在多尺度上的空间异质性[20];偏度可度量直方图关于均值的不对称程度;最大值指最大灰度强度,用于描述ROI内体素强度的分布[21];相关信息测度1评估两目标体素概率分布之间的相关性,可量化纹理的复杂性;最大概率指联合出现的一对最大相邻灰度的强度值,它们可衡量肿瘤区域间的异质性差异[22]。
目前,构建列线图模型进行胃癌术前PNI预测的报道较少。Liu等[15]报道患者术前体质指数、IgA水平以及CT报告的T、N分期是胃癌PNI的独立预测因子,但该研究中没有纳入影像组学特征进行综合分析。刘等[16]纳入Lauren分型和淋巴结转移情况等指标建立的列线图模型能较好地在术前预测胃癌PNI,然而胃癌的Lauren分型为胃镜检查结果,胃镜检查不仅有创,且由于活检点较局限易导致分型结果不准确; Yardmc等[8]使用基于CT纹理分析的机器学习方法进行PNI预测,但结果并不理想(AUC的95%CI为0.482~0.754),且他们采用的是二维图像分割。有研究表明VOIs能更全面地反映肿瘤内部的异质性[23]。另外有研究者将多期动态增强CT测量的病灶定量参数用于PNI术前预测,虽有较好的诊断效能,但其样本量(48例)较小,易导致结果出现假阳性[24]。针对以上不足,本研究纳入了171例病例,对肿瘤采用三维分割方法,将临床和影像组学特征相结合构建列线图模型,具有良好的诊断效能,有望辅助临床医师优化术前决策。
本研究存在一定的局限性:①本研究为单中心回顾性研究,虽然列线图模型在训练组和验证组有较好的诊断效能,但尚需大样本、前瞻性和多中心研究进一步验证;②本研究仅在静脉期增强扫描图像上勾画ROI,后期研究如能在平扫、动脉期及延迟期图像上勾画ROI进行影像组学分析并构建联合模型,可有望提高模型的诊断效能。③本研究纳入分析的临床指标中肿瘤最大径、T分期和N分期都来自CT诊断报告,一定程度上可能受到放射科医师的经验和主观因素的影响。
总之,我们构建了用于术前预测AGC患者PNI的列线图模型,为临床医师术前识别PNI(可疑)阳性的胃癌患者提供一种新的策略。
