终末期肾病维持性血液透析患者神经血管耦合功能的MRI研究
2022-12-20邱翔曾学文秦梦邓利俊蔡叶
邱翔,曾学文,秦梦,邓利俊,蔡叶
终末期肾病(end stage renal disease,ESRD)是各种慢性肾脏疾病的终末阶段,患者的肾小球滤过率通常低于15 mL/(min·1.73m2)[1]。ESRD患者通常需要通过透析或肾脏移植进行替代治疗。维持性血液透析(maintenance hemodialysis,MHD)为终末期肾病患者首选治疗方案,通过排出机体内毒素和改善电解质紊乱的方式,达到减轻症状、延缓疾病进展的目的。但MHD患者认知功能障碍的发生率较高[2-3],常出现不同程度的认知功能障碍,如注意力障碍、记忆力和任务执行能力降低等,严重影响了生活质量,后期可能伴发痴呆、癫痫发作、昏迷甚至死亡[4-7]。
皮质神经元兴奋直接引起脑内小动脉和毛细血管扩张,这种自发性功能性充血的功能称为神经血管耦合(neurovascular coupling,NVC)[8]。NVC的功能破坏是多种中枢神经系统疾病的重要发病机制之一。NVC存在3种脑血流的神经血管调控机制:①皮质内神经元-神经递质调控机制;②皮质下核团-神经递质调控机制;③外周交感/副交感神经节后神经元-血管活性物质调控机制。血管周间隙和血脑屏障等生理结构的破坏以及血管紧张素等体液因素的异常均可导致NVC功能障碍[8]。NVC具有多结构参与、多通路调控的特征,与大脑内稳态的维持密切相关。NVC这种优势特征在探索神经、精神疾病发病机制中得到广泛应用,如阿尔兹海默病、焦虑症和慢性疼痛等[9-11]。虽然肾移植是目前治疗ESRD最有效的方式,可能有助于改善MHD患者认知功能障碍,但费用昂贵[12-13]。对于不能移植的MHD患者,需要了解认知功能障碍的发生机制,并探索有效的干预措施来改善认知功能。外源性神经刺激可能成为恢复NVC功能的潜在干预途径[8]。因此本研究将NVC用于探索MHD患者认知功能障碍的神经病理生理机制,为临床发现早期MHD患者认知功能障碍提供新的依据,从而制订个体化治疗方针及早期干预患者认知功能异常。
材料与方法
1.研究对象
将2021年1月-2021年11月川北医学院附属医院血液透析中心收治的29例ESRD维持性血液透析患者纳入本研究。其中,男14例,女15例;年龄21~66岁,平均(41.24±12.59)岁。同期招募29例性别、年龄相匹配的健康志愿者作为正常对照组。其中,男13例,女16例;年龄19~66岁,平均(41.10±12.23)岁。患者组纳入标准:①根据慢性肾脏病的肾脏病预后质量指南(kidney disease outcomes quality initiative,K/DOQI)分类确诊为终末期肾病[14];②接受维持性血液透析(每周3次,每次>3.5 h)至少3个月;③没有肾移植或急性肾衰竭病史;④右利手;⑤无脑外伤、脑卒中、脑肿瘤、颅内感染、重大精神疾病及其它慢性疾病史;⑥无药物或酒精滥用史;⑦临床和实验室检查资料完整,采用稳定透析间实验室数据(以减少潜在偏倚的影响);⑧无MRI检查禁忌证,如体内有心脏起搏器和心脏支架及有幽闭恐惧症者;⑨能配合MRI检查,且MRI检查前一天能完成神经心理学测试。所有受试者自愿参加本研究并签署知情同意书。
2.认知功能评估
由一位接受过培训的神经内科医师采用蒙特利尔认知评估量表(montreal cognitive assessment scale,MoCA)对所有MHD患者进行评估,此量表的评估内容包括视空间和执行功能、命名、注意、语言、抽象思维、延迟回忆和定向共7个子项目,总分为30分,26分以下诊断为认知功能障碍,为校正文化程度的影响,若患者受教育年限在12年以下,最终得分加1分[15]。
3.MRI检查方法
使用GE Discovery MR750 3.0T磁共振仪和32通道颅脑线圈。嘱受试者在放松状态下闭眼但保持清醒,避免系统性思维活动。使用软垫固定头颅并用软耳塞以减少噪音。①首先行常规序列颅脑MRI扫描,排除颅脑内有明显异常病变的受试者。②采用三维颅脑容积成像(three-dimension brain volume imaging,3D-BRAVO)序列3D-T1WI获得高分辨率脑结构图像,扫描参数:层数136,TR 8.2 ms,TE 3.2 ms,翻转角12°,视野240 mm×240 mm,矩阵256×256,层厚1.2 mm,层间距0 mm,激励次数1。③采用EPI序列进行静息态功能磁共振成像(resting-state functional MRI,rs-fMRI)扫描,扫描参数:240个时间点,TR 2000 ms,TE 30 ms,翻转角90°,视野240 mm×240 mm,矩阵64×64,层厚4.0 mm,层数33。④三维准连续动脉自选标记(three-dimensional pseudo-continuous arterial spin labeling,3D-pCASL)扫描参数:TR 4632 ms,TE 10.5 ms,视野240 mm×240 mm,层厚4.0 mm,带宽62.5 Hz/pixel,激励次数3,标记延迟时间(post labeling delay time,PLD)1.8 s,层数32。
4.图像后处理
rs-fMRI数据的预处理及低频振荡振幅(amplitude of frequency fluctuation,ALFF)的计算采用MATLAB_2013b平台上加载的DPABI和SPM8工具包,数据预处理步骤包括格式转换、去除前10个时间点数据、时序校正、头动校正(排除头动平移大于1.5 mm及转动角度大于1.5°被试)、功能像配准、空间标准化、平滑(6 mm半宽高)及去线性趋势,将得到的基础图像转换为Z值,频段选取0.01~0.08 Hz,使其保持低频振荡振幅。
3D-pCASL序列的图像经随机软件处理后得到脑血流量(cerebral blood flow,CBF)图像,基于Matlab_2013b平台选用SPM8工具包,对患者组和对照组的CBF数据进行预处理,主要步骤包括检查CBF图像质量、空间标准化(配准到SPM工具包自带PET全脑灌注图)、检查标准化后CBF的图像质量、数据归一化和平滑(6 mm半宽高)。然后将ALFF图及CBF图重采样(体素大小2 mm×2 mm×2 mm),分别计算每例受试者灰质模板内CBF与ALFF的比值,得到单位低频振荡振幅需要消耗的血流,即神经血管耦合图。
5.统计学分析
采用SPM8软件中的双样本t检验分析神经血管耦合图,加入年龄、性别和受教育年限作为协变量,结果进行FDR矫正,以P<0.05为差异具有统计学意义。最后采用DPABI软件依据自动解剖标记(AAL)模板将大脑分为90个脑区,提取MHD组与对照组神经血管耦合图上差异脑区,并提取差异脑区的NVC值。使用SPSS 22.0 统计学软件,对MHD组和对照组的临床资料、神经心理学资料和NVC值进行分析,计量资料采用均数±标准差进行描述。采用Pearson相关性分析评估MHD组有差异脑区的NVC值与临床资料和MoCA评分相关性。以P<0.05为差异具有统计学意义。
结 果
1.两组受试者的临床资料
MHD组和对照组主要临床资料的比较结果见表1。两组间年龄、性别和受教育年限的差异无统计学意义(P>0.05)。MHD组的MoCA评分低于对照组,差异具有统计学意义(P<0.001)。
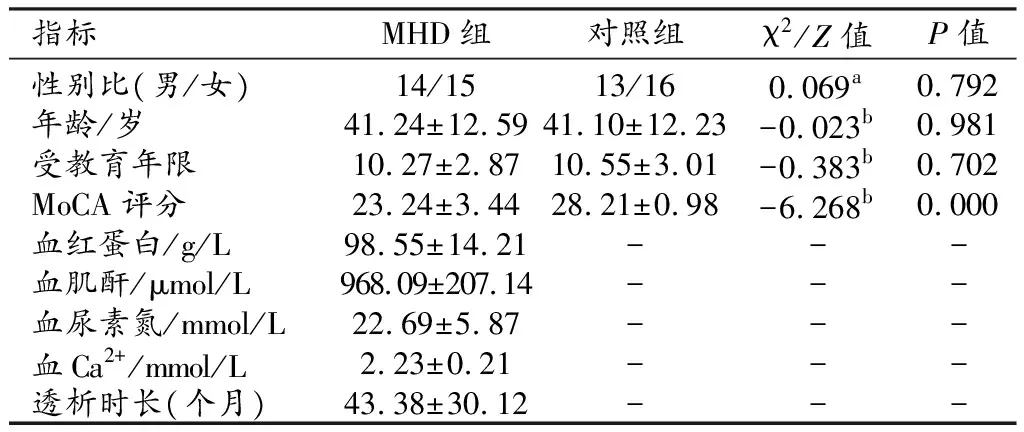
表1 两组受试者临床数据及神经心理测试评分比较
2.两组间NVC比较
与对照组相比,MHD组的双侧海马、双侧颞下回、双侧豆状壳核、左侧梭状回、右侧海马旁回、右侧内侧和旁扣带回及右侧尾状核的NVC值明显减小(P<0.05, FDR校正)。MHD组未发现有NVC升高的脑区(表2、图1)。
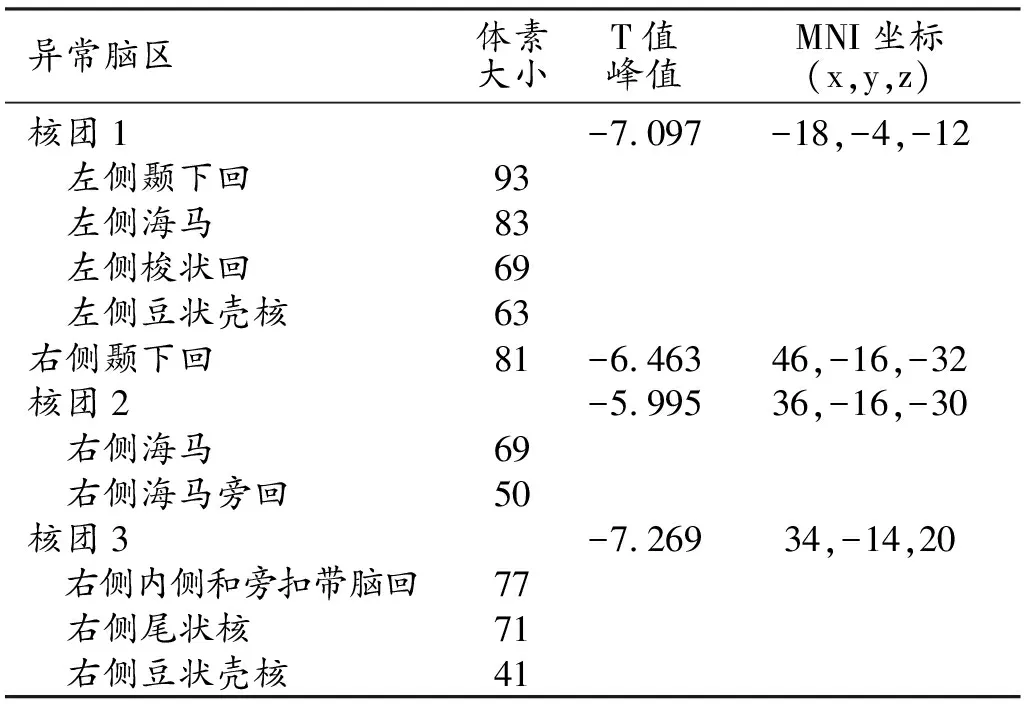
表2 MHD组较对照组NVC值有差异的脑区
3.相关性分析
对有差异脑区的NVC值与临床资料和MoCA评分进行相关性分析,有统计学意义的结果详见表3。MHD组左侧颞下回和右侧海马旁回的NVC值与视空间和执行能力评分呈负相关;右侧豆状壳核的NVC值与语言功能评分呈正相关;左侧海马和左侧梭状回的NVC值与血肌酐水平呈正相关,与透析时长呈负相关;右侧尾状核的NVC值与透析时长呈负相关(P均<0.05)。
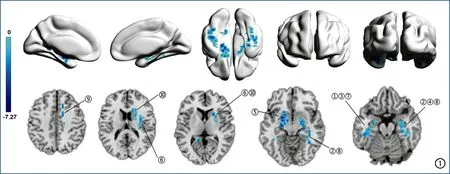
图1 脑组织内的蓝色区域为MHD组较对照组NVC值减低的脑区(P<0.05,FDR校正),主要包括左侧海马(①)、右侧海马(②)、左侧颞下回(③)、右侧颞下回(④)、左侧豆状壳核(⑤)、右侧豆状壳核(⑥)、左侧梭状回(⑦)、右侧海马旁回(⑧)、右侧内侧和旁扣带回(⑨)及右侧尾状核(⑩)。
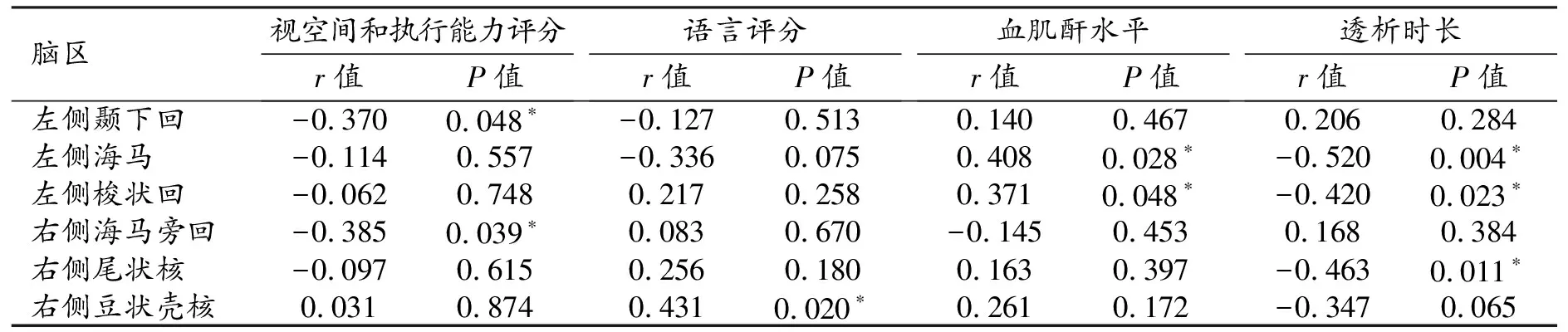
表3 MHD组有差异脑区的NVC值与临床资料和MoCA评分的相关性分析结果
讨 论
本研究结果显示ESRD维持性血液透析患者存在认知功能障碍,并通过神经血管耦合方式发现MHD患者双侧海马、双侧颞下回、双侧豆状壳核、左侧梭状回、右侧海马旁回、右侧内侧和旁扣带脑回及右侧尾状核的NVC值减小。这些脑区主要位于边缘系统和脑基底神经节。未发现MHD患者较正常对照组NVC值增高的脑区,这与Jin等[2]的研究结果基本一致。此外,本研究结果显示MHD患者的神经血管耦合值与视空间和执行能力评分、语言能力评分、血肌酐水平和透析时长具有相关性(P均<0.05)。以往对慢性肾病患者出现认知功能障碍的发生机制主要有2种假说,即血管性假说和神经退行性假说[16]。但本研究结果显示MHD患者的NVC功能发生了改变,表明MHD患者出现认知功能障碍可能是神经血管相互作用的结果。
皮质内神经元-神经递质调控通路介导NVC通路具有“快速响应”的特点,为大脑多种重要活动提供支持[8]。既往有许多研究证实ESRD患者多伴有边缘系统连接功能受损[16-18]。边缘系统参与情绪、学习和记忆等功能活动的调节过程[19]。吴宝林等[16]发现ESRD患者旁边缘-边缘网络、右侧颞横回和左侧颞上回的节点效率较对照组明显减低。MHD患者出现焦虑和抑郁状态的比例较高,合并抑郁情绪的ESRD患者杏仁核-前额叶-后扣带回皮层-边缘系统环路受损[17]。Zheng等[18]发现ESRD引起的肠道生态失调与促炎细胞因子、杏仁核功能异常与情绪表现密切相关。本研究发现终末期肾病MHD患者的边缘系统NVC功能受损,可能是边缘系统NVC皮质内调控通路受损所致,从而导致患者出现认知功能障碍。
皮质下核团-神经递质调控通路参与维持脑实质内血管基础舒缩张力,调控脑实质内血流[8]。以往研究发现通过兴奋皮质下基底节区胆碱能纤维,能够激活皮质内血管毒蕈碱M受体及尼古丁N受体,扩张皮质血管并增加脑血流[8]。本研究发现MHD患者双侧豆状壳核和右侧尾状核的NVC值较正常对照组减低,且右侧尾状核的NVC改变与语言能力相关。推测终末期肾病MHD患者可能通过基底节区NVC皮质下核团-神经递质调控通路参与认知功能调节。
此外,本研究发现左侧海马和左侧梭状回的NVC改变与血肌酐和透析时长相关,右侧尾状核的NVC改变与透析时长相关。血液透析会导致快速液体转移,往往导致血压大幅波动。透析过程中的低血压与脑萎缩有关,而血液透析中的血流动力学不稳定与脑损伤有关[20]。Dong等[21]研究发现肾功能可能是预测脑组织结构变化的关键因素。较低的肾小球滤过率和蛋白尿的存在与严重的认知功能障碍有关[22]。大脑内血管周间隙代谢物清除率下降、血管紧张素增加,会损伤NVC功能,并导致大脑内稳态失衡[8]。本研究结果表明MHD患者肾功能及透析时长与部分脑区的NVC改变具有相关性,笔者分析可能是由于肾功能异常及透析时长影响机体代谢,间接损害NVC功能,从而参与MHD患者认知功能障碍的发生。
本研究存在一定的局限性:本实验样本量较小,需多中心、大样本实验对本研究结果进行验证;其次,本研究中仅选用维持性血液透析患者作为受试者,未对透析前及透析后远期神经血管耦合的改变进行纵向研究。最后,肾脏疾病的病因可能会对大脑功能产生影响,故需要今后根据不同病因进行分类研究。
综上所述,维持性血液透析患者神经血管耦合改变与认知功能损害有关,NVC通过不同神经血管调控通路调节MHD患者的认知功能。此外透析时长、血肌酐水平可能与NVC功能受损具有相关性。上述研究结果为维持性血液透析患者认知功能障碍的潜在病理生理机制提供了一个新的视角,NVC有可能成为潜在的影像学生物标记物。
