不同流式微球分析法多重细胞因子检测试剂对比与分析*
2022-12-20高丽丽赵仁彬王娅婕李增政撒亚莲杨同华
高丽丽,赵仁彬,王娅婕,李增政,撒亚莲,杨同华△
昆明理工大学附属医院/云南省第一人民医院/云南省血液疾病临床医学中心/云南省血液病医院:1.血液科;2.临床医学中心,云南昆明 650032
细胞因子是由免疫原、丝裂原或其他刺激剂诱导多种细胞合成、分泌的一类具有广泛生物学活性的小分子蛋白或多肽,可分为白细胞介素(IL)、干扰素(IFN)、肿瘤坏死因子(TNF)、集落刺激因子(CSF)、趋化因子和生长因子等,其同机体的免疫细胞和免疫器官构成人体复杂的网络关系,并作用于靶细胞后介导各种疾病的保护性或破坏性免疫应答[1-2]。正常生理状态下,人体内细胞因子的水平是不可检测或是非常低的。但在病理状态下,细胞因子会出现异常表达。因此,对细胞因子的检测有助于判断机体的免疫功能,指导治疗,评估患者的疗效与预后。
双抗体夹心酶联免疫吸附试验(ELISA)是检测细胞因子最经典的一种方法,但由于所需标本量较大,灵敏度低,稳定性差,操作起来耗时耗力,效率低,缺乏多重性,一次只能检测一种细胞因子,已不能满足临床所需。而流式微球分析法所需标本量少,且一次检测可快速实现多个目标蛋白的定性和定量检测,能反应细胞因子之间的网络关系,体现出免疫动态演变关系。有研究显示,流式微球分析法和ELISA的结果具有很好的一致性,且流式微球分析法具有更高的特异度和灵敏度,对于小体积标本的适用性良好,可广泛适用于临床研究及实验室进行高通量细胞因子检测[3-4]。本实验中所用的3种试剂盒都是基于流式微球技术研发而成,不同的是各试剂盒的具体验操作步骤和检测的细胞因子组合。
1 资料与方法
1.1一般资料 选取2020年1月至2021年12月在云南省第一人民医院(下称本院)确诊为急性淋巴细胞白血病(ALL)、急性髓系白血病(AML)、慢性髓系白血病(CML)、噬血细胞综合征(HPS)和多发性骨髓瘤(MM)的50例患者(病例组)分别作为ALL组、AML组、CML组、HPS组和MM组,每组10例。病例组男28例、女22例,年龄27~65岁。ALL、AML、CML、HPS和MM的诊断及分型标准分别参照2016版《中国成人急性淋巴细胞白血病诊断与治疗指南》[5]、2017版《成人急性髓系白血病(非急性早幼粒细胞白血病)中国诊疗指南》[6]、2016版《中国慢性髓性白血病诊断与治疗指南》[7]、2018版《噬血细胞综合征诊治中国专家共识》[8]、2018版《多发性骨髓瘤诊治指南解读》[9]。另选取同期健康体检者12例作为健康组,其中男5例、女7例,年龄25~60岁。本研究经本院伦理委员会批准,所有受试者签署知情同意书。
1.2仪器与试剂 NovoCyte 2060R流式细胞仪[艾森生物(杭州)有限公司];A试剂(天津矿博同生生物技术有限公司);B试剂(青岛瑞思凯尔生物科技有限公司);C试剂(江西诺德医疗器械有限公司)。
1.3方法
1.3.1标本采集及处理 采集各组受试者入院或体检时外周血3~5 mL,注入真空分离胶促凝管,室温自然凝固,离心5 min,取上层血清500 μL备用,标本收集后于4~6 h内检测,如无法及时检测,收集后立即-20 ℃保存,长期保存l置于-80 ℃条件下,忌反复冻融。血清标本的处理过程严格按照各试剂盒说明书操作。采用3种不同试剂(A、B、C试剂)检测健康组血清标本6种细胞因子(IL-2、IL-4、IL-6、IL-10、TNF-α、IFN-γ)水平,并用筛选后试剂检测6组血清标本14种细胞因子(IL-4、IL-5、IL-6、IL-8、IL-10、IL-12P70、IL-1β、IL-2、IFN-γ、TNF-α、TNF-β、IL-17A、IL-17F、IL-22)水平。
1.3.2检测数据获取及分析 标本上机前行流式细胞仪质控检测分析,检查各参数的测试数据是否在标准范围内,以此确保仪器的稳定可靠运行;完成实验后收集数据,使用回归系数来拟合标准曲线,检测结果参照标准曲线得出精确水平,输出数据文件,A试剂和C试剂的数据分析软件为BD FCAP Array v3.0.1,B试剂的数据分析软件为其自带的分析软件。
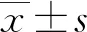
2 结 果
2.1健康组6种细胞因子检测结果比较 采用A、B、C试剂分别检测健康组6种细胞因子水平,检测结果见表1。A试剂的检测值范围宽,高、低值差异明显,C试剂和 B试剂的检测值低,且较集中。C试剂和A试剂对IL-6、IL-10、IFN-γ的检测结果比较,差异均有统计学意义(P<0.05);A试剂和B试剂对IL-4、IL-6、IL-10、IFN-γ的检测结果比较,差异均有统计学意义(P<0.05);C试剂和B试剂对IL-2、IL-4、IL-6、IL-10、TNF-α、IFN-γ 6种细胞因子的检测结果比较,差异均无统计学意义(P>0.05)。
2.2健康组6种细胞因子的变异系数(CV) A、B、C试剂检测结果的CV见表2,A试剂检测结果的CV比较均一。

表1 A、B、C试剂分别对健康组6种细胞因子检测结果比较
表2 A、B、C试剂分别检测6种细胞因子的CV
2.3A试剂检测各组14种细胞因子水平 筛选的A试剂对各组14种细胞因子的检测结果显示,ALL组、AML组、CML组和MM组IL-8检测结果明显高于正常参考值,HPS组IL-10检测结果明显高于正常参考值,差异均有统计学意义(P<0.05)。健康组血清标本的检测结果在A试剂正常参考值或正常参考值上限的3倍以内,病例组5组患者的检测结果覆盖范围宽。筛选的A试剂能很好地区分健康组与病例组标本。见表3。

表3 A试剂对各组14种细胞因子的检测结果比较
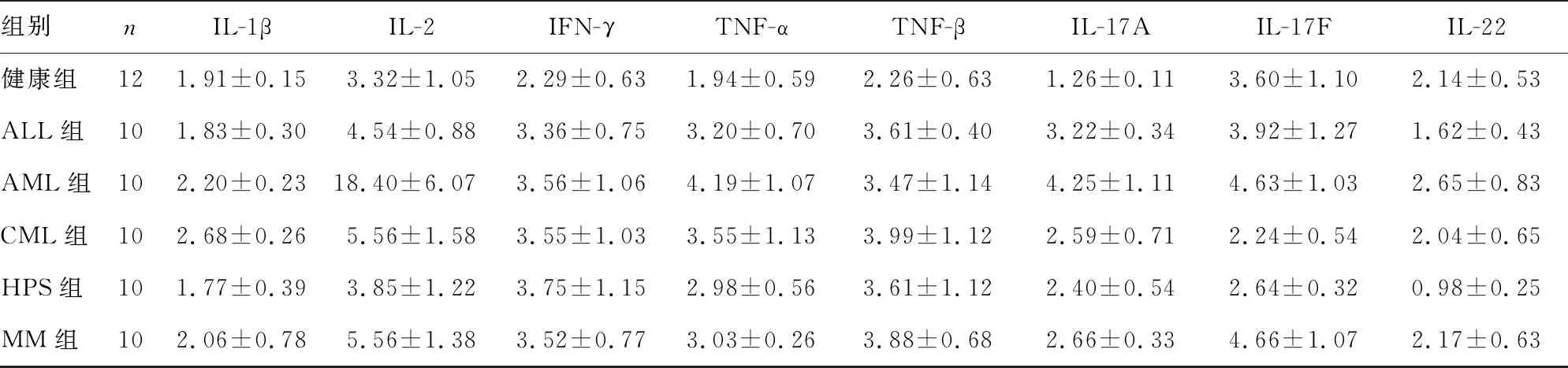
组别nIL-1βIL-2IFN-γTNF-αTNF-βIL-17AIL-17FIL-22健康组121.91±0.153.32±1.052.29±0.631.94±0.592.26±0.631.26±0.113.60±1.102.14±0.53ALL组101.83±0.304.54±0.883.36±0.753.20±0.703.61±0.403.22±0.343.92±1.271.62±0.43AML组102.20±0.2318.40±6.073.56±1.064.19±1.073.47±1.144.25±1.114.63±1.032.65±0.83CML组102.68±0.265.56±1.583.55±1.033.55±1.133.99±1.122.59±0.712.24±0.542.04±0.65HPS组101.77±0.393.85±1.223.75±1.152.98±0.563.61±1.122.40±0.542.64±0.320.98±0.25MM组102.06±0.785.56±1.383.52±0.773.03±0.263.88±0.682.66±0.334.66±1.072.17±0.63
3 讨 论
流式微球技术是一种仅需少量标本即可快速完成多种可溶性蛋白成分的定性和定量检测的分析技术,是集微球技术、ELISA和流式细胞术等优点于一身的液相蛋白检测技术,具有高通量、高灵敏度、重复性好、成本低等诸多优点[10]。流式微球技术的原理是将一系列带有不同荧光强度、包被有捕获抗体的不同大小的微球作为载体,特异性捕获液相标本中相应的抗原,再结合生物素检测抗体,形成双抗体夹心结构,以流式细胞术作为检测平台,探测不同荧光信号的强度达到对待测标本抗原定性和定量的目的[11]。
因各试剂盒中使用的微球、抗体及孵育时间不同,细胞因子的检测结果有所差异[12]。不仅如此,标本的留取及处理、标准品的稀释倍数、标曲的拟合、仪器设备的条件及数据分析,每个步骤若操作不当均可影响检测结果。在标本的留取及处理过程中需着重注意以下3点:(1)首先要确保标本的合格,若标本发生溶血,血细胞碎片、血红蛋白等均会影响细胞因子与微球的结合。通过多次洗涤细胞及标本上机前将流式细胞仪调至最佳状态可以有效去除血清中的杂质[13]。此外,细胞因子标本的留取采用乙二胺四乙酸(EDTA)抗凝全血获取,并于收集后0 ℃立即离心,或暂存于4 ℃条件下4 h内离心分离出血浆的标本是最好的[14]。(2)标本与微球结合的过程中若混匀的不够充分,会造成微球成团,导致细胞因子分群异常,影响结果的分析[13]。(3)当标本中待测指标的水平过低时会出现检测值不在标准曲线上,以致没有检测结果。低灵敏度主要是由标准曲线的设计而引起的,通过增加标准曲线的低水平标准点或重新制作标准曲线可以解决此问题[13,15-16]。
本实验室中3种试剂的标本处理及标准品的制备各有不同。标本处理:C试剂和B试剂标本孵育均在流式管中进行,C试剂标本孵育一步完成,B试剂标本孵育分两步完成,孵育过程中未持续振荡混匀,单枪加样,效率低,洗涤后需离心去上清,容易致微球损失。A试剂标本孵育分三步完成,使用96孔滤膜板,排枪加样,孵育过程中持续振荡混匀,每完成一步都通过真空泵抽滤反复洗涤细胞,微球不易丢失,整个操作过程方便快捷,极大地降低了人力、物力和时间成本。标准品的制备:C试剂2倍倍比稀释,覆盖范围较窄,较低浓度的细胞因子不易检出;A试剂3倍倍比稀释,覆盖范围更宽,低值更灵敏,同时兼顾中高值;B试剂4倍倍比稀释,跨度过大,CV、重复性差。可见标准品的稀释倍数不同可致每组检测敏感区间有所差异。通过对比三者的实验操作过程及检测结果,A试剂相对于C试剂和B试剂有更多的优势所在,更适用于临床。在多项研究中,A试剂也体现了其可用性[17-19]。
总之,细胞因子的准确检测对于诊断和评估不同的疾病状态至关重要。优化细胞因子检测试剂盒的设计和提高实验人员的操作水平,可提高细胞因子结果的准确性,有利于指导临床诊疗。
