地塞米松磷酸钠注射液仿制制剂与原研制剂有关物质比较*
2022-12-20路惬楠张轶华
路惬楠,王 柳,孙 婷,张轶华
(河北省药品医疗器械检验研究院·国家药品监督管理局仿制药质量控制与评价重点实验室,河北 石家庄 050200)
地塞米松磷酸钠注射液为人工合成的长效糖皮质激素,是泼尼松龙的氟化衍生物,具有抗炎、抗病毒、抗休克、免疫抑制作用,是抢救危重症患者不可缺少的急救药品。由主药地塞米松磷酸钠与辅料烟酰胺、无水亚硫酸钠、亚硫酸氢钠、依地酸二钠制成,其中无水亚硫酸钠为抗氧剂。目前,已有对醋酸地塞米松原料药[1-2]和地塞米松磷酸钠注射液[3-7]中杂质Ⅰ开展的研究。为此,本研究中以原研Aspen公司在英国上市的地塞米松磷酸钠注射液为参比制剂,根据仿制药一致性评价的相关规定,采用反向分析技术,对标原研制剂质量。本品变更处方,不再添加抗氧剂亚硫酸钠,故不存在杂质Ⅰ。采用反相高效液相色谱法有效分离主成分与7 个已知杂质A-G,对仿制制剂和原研制剂的有关物质进行了研究。现报道如下。
1 仪器与试药
1.1 仪器
Waters e2695型高效液相色谱仪(美国Waters公司),配有Waters e2695泵、2489型紫外可见光检测器、Empower色谱工作站;XPR26/A型电子天平(瑞士梅特勒公司,精度为0.01 g);KS-7200XDS型超声仪(昆山洁力美超声仪器有限公司,功率为400 W,频率为40 kHz)。
1.2 试药
乙酸铵和乙酸均为分析纯,购自天津科密欧化学试剂有限公司;甲醇(色谱纯,Merck 公司);试验用水为超纯水;地塞米松磷酸酯对照品(批号为101116 -201803,含量为99.1%),倍他米松磷酸钠(杂质B)对照品(批号为100180-201804,含量为92.2%),均购自中国食品药品检定研究院;地塞米松磷酸钠《欧洲药典》(EP)系统适用性对照品[批号为Y000147(2.0)],包含地塞米松(杂质A)及杂质C,D,E,F,G;原研制剂(AspenPharma⁃TradingLimted,批号为16083TB23,规格为3.8 mg∶1 mL);仿制制剂(批号分别为2102203,2102204,2102205,规格为1 mL∶5 mg)。
2 方法与结果
2.1 色谱条件与系统适用性试验
色谱柱:Kromasil C8柱(250 mm × 4.6 mm,5 μm);流动相:以0.1 mol/L 乙酸铵溶液(用乙酸调pH 至3.8)-甲醇(65∶35,V/V)为流动相A,以0.1 mol/L 乙酸铵溶液(用乙酸调pH至4.0)-甲醇(30∶70,V/V)为流动相B,梯度洗脱(洗脱程序见表1);流速:1.0 mL/min;柱温:30 ℃;检测波长:254 nm;进样量:20 μL。系统适用性试验溶液在此色谱条件下的色谱图见图1,地塞米松磷酸钠与各杂质分离度良好。理论板数按地塞米松磷酸钠峰计应不低于3 000,杂质B 与地塞米松磷酸钠的分离度应不低于1.5。
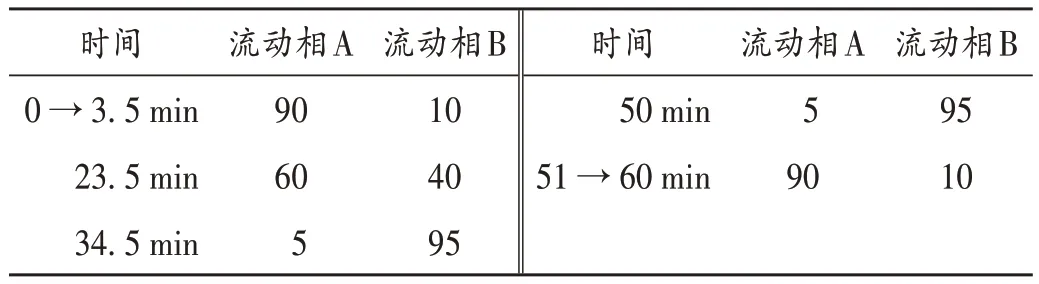
表1 流动相梯度洗脱程序(%)Tab.1 Program of gradient elution of mobile phase(%)
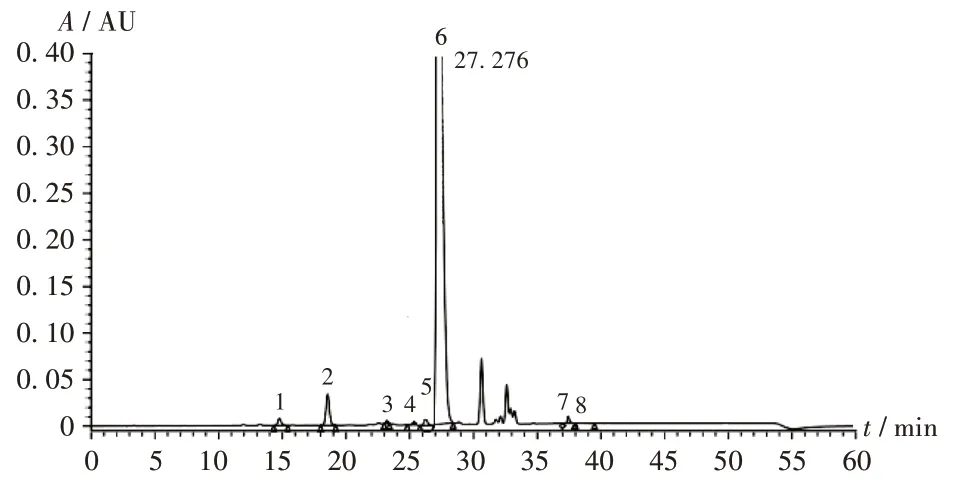
图1 系统适用性试验高效液相色谱图Fig.1 HPLC chromatograms of the system suitability test
2.2 溶液制备
取杂质B 对照品2 mg,精密称定,置100 mL 容量瓶中,用流动相A 定容,摇匀,即得杂质B 对照品溶液。取地塞米松磷酸钠EP系统适用性对照品(包含杂质A,C,D,E,F,G)2 mg,精密称定,置2 mL 容量瓶中,加上述溶液1 mL,再用流动相A 定容,摇匀,即得系统适用性试验溶液。取样品适量,加流动相A 制成每1 mL 含地塞米松磷酸钠1 mg 的供试品溶液。精密量取供试品溶液1 mL,置200 mL容量瓶中,用流动相A定容,摇匀,即得对照品溶液。
2.3 方法学考察
线性关系考察:取杂质B 对照品2.50 mg,精密称定,置10 mL 容量瓶中,加流动相A 超声2 min 使溶解并定容,摇匀,作为杂质B对照品贮备液;取地塞米松磷酸酯对照品2.75 mg,精密称定,置10 mL 容量瓶中,加流动相A超声2 min使溶解并定容,摇匀,作为地塞米松磷酸酯对照品贮备液。分别精密量取上述对照品贮备液,用流动相分别稀释制成线性关系考察溶液。分别精密量取20 μL,按拟订色谱条件进样测定。结果见表2。

表2 线性关系考察结果、相对保留时间和相对校正因子Tab.2 Results of the linear relation test,relative retention time and relative correction factors
检测限和定量限确定:取对照品贮备液适量,用流动相A逐步稀释成不同的质量浓度,按2.1 项下色谱条件分别进样20 μL。以信噪比(S/N)为3 和10 时的含量为检测限和定量限。结果主成分地塞米松磷酸钠、杂质B的检测限分别为4 ng和10 ng,定量限分别为12 ng和30 ng。
精密度试验:取2.2 项下供试品溶液,按拟订色谱条件连续进样6次,记录色谱图。结果地塞米松磷酸钠、杂质B峰面积的RSD分别为0.21%和0.48%(n=6)。
稳定性试验:取2.2 项下供试品溶液,分别于室温下放置2,4,8,12 h时按2.1项下色谱条件重复进样2次,记录色谱图。结果地塞米松磷酸钠含量的RSD分别为0.33%,0.78%,1.02%,1.13%(n= 2);杂质B 含量的RSD分别为0.53%,0.92%,1.51%,1.63%(n=2),表明供试品溶液室温下放置12 h内稳定性良好。
加样回收试验:取地塞米松磷酸酯对照品及片剂空白辅料,按处方比例制备空白溶液,分别加入高、中、低浓度地塞米松磷酸酯、杂质B 对照品,按拟订色谱条件进样测定,以外标法分别计算回收率,结果见表3。

表3 加样回收试验结果(n=3)Tab.3 Results of the recovery test(n=3)
2.4 仿制制剂和原研制剂有关物质测定
按2.1项下色谱条件进样测定,以加校正因子的自身对照法计算杂质A和B的含量,以自身对照法计算杂质C,D,E,F,G 和其他单个杂质。供试品溶液色谱图中如有杂质峰,以对照溶液中地塞米松磷酸酯峰面积计,杂质A,B(相对校正因子1.14),C,D,E,F,G 的含量均不得大于0.5%,其他单个杂质的含量不得过0.2%,各杂质总和不得过2.0%。仿制制剂和参比制剂高效液相色谱图见图2,含量测定结果见表4。

表4 有关物质含量测定结果(%)Tab.4 Results of content determination of related substances(%)
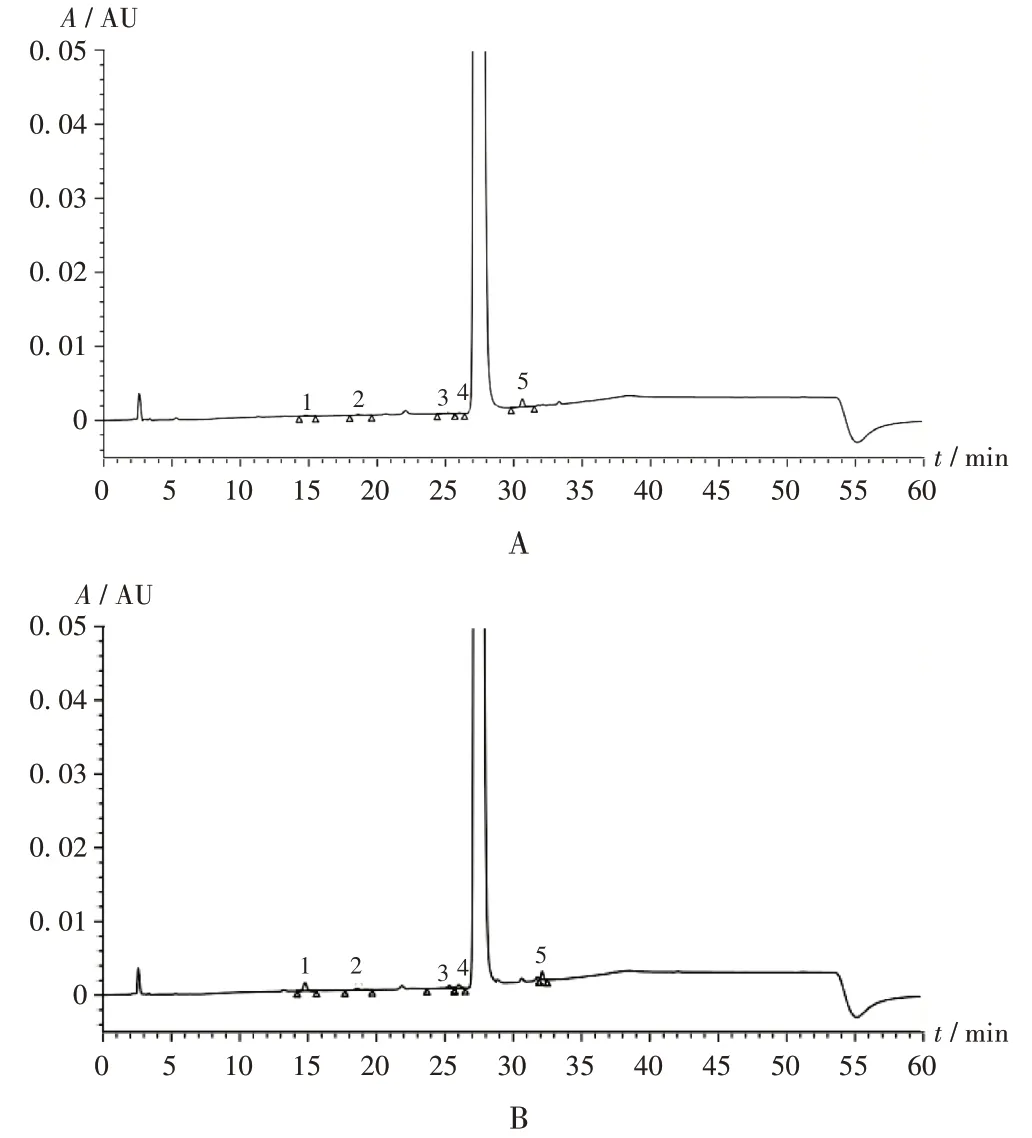
图2 高效液相色谱图Fig.2 HPLC chromatograms
3 讨论
本品主成分为地塞米松磷酸钠,以地塞米松磷酸酯对照品进行方法学考察,包括线性关系考察、检出限、定量限等,故均以地塞米松酸酯折算为地塞米松磷酸钠。2020 年版《中国药典(二部)》收载的地塞米松磷酸钠注射液标准中,将杂质Ⅰ作为已知杂质控制其含量。也有多篇文献对杂质Ⅰ的控制方法进行研究,且有文献指出,杂质Ⅰ是抗氧剂亚硫酸氢钠与主成分在高温下的加成产物[8-9]。经与原研制剂比较分析,变更仿制制剂的处方组成后不再添加抗氧剂(亚硫酸钠),经试验分析,未检出杂质Ⅰ,仿制制剂中杂质的种类和含量均与原研制剂一致。所建立方法可有效控制仿制制剂中的已知杂质和未知杂质。
注射剂中除溶剂外,可根据药物的理化性质加入适宜辅料,如pH 调节剂、助溶剂、抗氧剂、抑菌剂等。但地塞米松磷酸钠注射液中加入抗氧剂后,导致杂质Ⅰ的生成,致使主药药量减少,严重影响药物的有效性,且新增杂质毒性未知。为保证仿制制剂与原研制剂同等的疗效,有必要优化处方工艺,并重视药物与辅料的相容性考察,避免因处方中辅料与主药配伍不当而对产品质量产生不良影响,甚至对身体健康造成危害。
