宁波沿海地区水稻田稗草发生量及对丙草胺、丁草胺的抗药性检测—以6个样点为例
2022-12-19张琳玲林乐志陈宏宇柴伟纲谌江华
史 骏,张琳玲,林乐志,陈宏宇,柴伟纲,谌江华
(1.宁波市农业科学研究院,浙江 宁波 315040;2.慈溪市农业技术推广中心,浙江 慈溪 315300)
稻田杂草是导致水稻产量下降的一个重要因素,而稗草Echinochloacrus-galli(L.) Beauv.是稻田杂草中分布最广、危害最大的杂草之一[1]。化学除草剂因省工、经济的特点,深受稻农们青睐,在稗草治理上发挥着不可替代的作用。在长期、大量及高频次使用除草剂的过程中,稗草对除草剂产生了不同程度的抗药性[2]。
土壤封闭剂是较为重要的一类除草剂,如,丙草胺、丁草胺等,在提出“防早防小”的稗草防治概念以后,此类药剂的使用频率逐年增加、抗药性问题日渐加剧。自黄炳球等[3]于1993年首次对稻田丁草胺抗药性问题进行研究和报道以来,有关丁草胺抗药性的研究逐渐增多。廖庆生[4]、杨彩宏[5]先后对华南地区广州境内的稗草种群进行了检测,发现该地区稗草已对丁草胺产生不同程度的抗药性;付仲文[6]、王琼等[7]和张纪利等[8]也对湖北、安徽、江西、江苏等长江中下游地区的稗草种群进行了丁草胺的抗药性测试,表明上述各地也出现了丁草胺的抗药性。马洪文等[9]和刘亚光等[10]分别对我国西北地区的宁夏和东北地区的黑龙江的稗草种群进行了丁草胺的抗药性检测,结果同样表明丁草胺的抗性稗草存在于我国西北和东北地区;而贺奇等[11]对我国西北地区宁夏的稗草种群进行了丙草胺检测,结果发现该地区也存在丙草胺的抗药性问题。
截至目前,有关稗草种群对土壤封闭剂产生抗药性的现象已遍及我国各地,学者们主要通过‘样地采样-室内栽培生测’的方法对丙草胺、丁草胺等药剂的抗药性进行检测。上述研究报道中,部分样点来自典型的沿海地区,如,杨彩宏等的研究中涉及位于广东省沿海诸多地区的稻田,但此类研究并未关注过沿海不同盐碱度的土壤类型是否对除草剂药效发挥、除草剂抗药性等产生影响[12]。此外,温广月等也对上海市种植水稻的各区(县)的稗草种群进行了生测,结果表明上海沿海的东部、西部和南部稻区的稗草对丁草胺均存在较强抗药性[13]。该研究涉及的样点同样包含紧邻海岸线的诸多地点,但同样未考虑到不同的沿海样点的土壤在盐碱度上可能存在差异,以及该差异可能对稗草抗药性产生影响。
沿海地区不同地点的围垦历史、地形差异等因素,可能导致不同样点土壤盐化或碱化程度产生差异,从而影响除草剂药效的发挥、药剂的降解等,并最终影响到稻田稗草对其产生抗药性的进程。本研究基于宁波沿海稻田的土壤盐碱化现状,选取宁波沿海地区盐碱稻田、碱化稻田和非盐碱稻田在内的共计6块稻田作为样点,研究在不同土壤盐碱化程度下,稗草对丙草胺和丁草胺的抗药性程度及稗草发生量,为生产实践提供理论指导。
1 材料与方法
1.1 试验材料
供试药剂为300 g/L丙草胺乳油(EC)安徽富田农化有限公司;50%丁草胺乳油(EC)黑龙江吉翔农化有限公司。
供试杂草为稗草Echinochloacrus-galli(L.) Beauv.。稗草种子采集时间为2018年至2020年,采集地点为浙江省宁波市鄞州区邱隘镇、奉化区江口街道、慈溪市庵东镇和崇寿镇、象山县丹东街道和大徐镇6个街道/镇域内的稻田,各样点土壤类型的划分及各样点土壤理化性质见表1[14]。
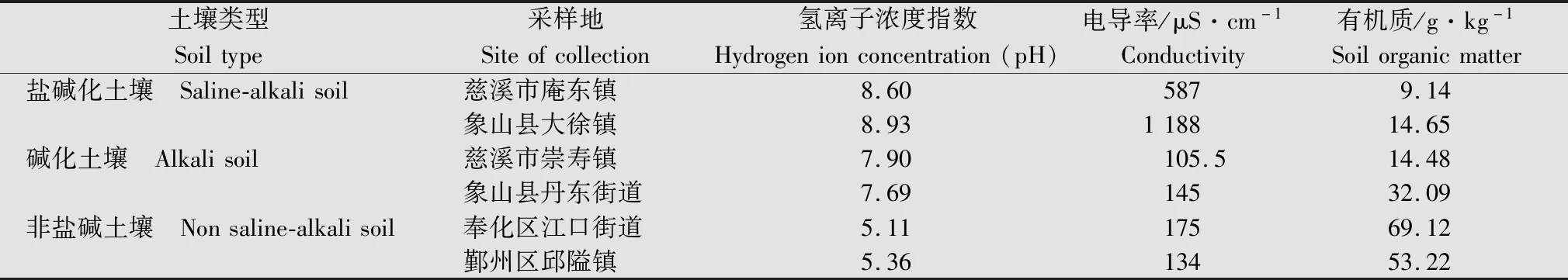
表1 供试杂草种子采集地及土壤理化性质Table 1 Soil physical and chemical properties and seed collection sites of tested weeds
1.2 杂草发生情况调查
调查田块于过去8年间仅连续施用单一丙草胺/丁草胺作为土壤封闭处理剂。于插秧后20~35 d,根据田间草相现状,施用茎叶处理剂1次。调查稻田的栽培方式以机插为主,耕作模式为稻-冬闲模式为主。于2018年-2020年,对稻田中的杂草种类和数量进行调查,每种样地的调查田块面积为667 m2,采用“W”形五点取样,每点放置1个1 m × 1 m的正方形样框,调查时间为水稻秧苗5至6叶期。统计指标包括发生密度、频度、多度。密度:单位面积内某一种杂草的株数(株/m2)。频度:某一种杂草出现的样点数占总调查样点数的百分比(%)。多度:某一种杂草总株数占调查各种杂草总株数的百分比(%)。被调查田块在水稻移栽后的15~30 d,根据杂草发生情况,喷施氰氟草酯、五氟磺草胺等茎叶喷雾除草剂1次。
1.3 土壤种子库调查
于2018年-2020年每年5月,采用直径5 cm的圆筒形土壤取样器,每样点选取土壤环境相对一致的田块1块,每块田随机选择4个点,每个点重复取土4次,取土深度为15 cm,共计16个土芯。土芯带回实验室后,每个点4次重复所取得的土壤混合均匀,置于50 cm×50 cm的正方形盘中,土壤推平至厚度均匀。自土壤带回实验室后的第2天,每日用喷雾器喷水至土壤水分饱和,置方盘于培养箱中(温度、光照及湿度设置:时段06:01-22:00为32℃,光照为5 000 lx,湿度为85%;时段22:01-06:00为22℃,光照为0 lx,湿度为65%),采用直接萌发法观察出草情况。自出草开始,每3~7 d统计1次稗草数量并将其拔除,直至停止出草为止,累计各阶段出草数量,并得到总出草数。
1.4 抗药性测定
试验于2021年3 月在宁波市农业科学研究院进行,采用盆钵土培法测定稗草对2种药剂的抗药性。将壤土与营养土(有机质含量≥46%,总养分≥2%)按2∶1混合均匀,置于100℃烘箱中5 h,杀死土壤中的杂草种子,再将混合土壤装入边长为8 cm的正方体花盆中,每盆含混合土壤约120 g。每盆播种150~200粒稗草种子,种子上方覆盖一层约0.2 cm的极薄土层,土表喷水至完全湿润,将花盆放入培养箱(温度、光照及湿度设置:时段06:01-18:00为32℃,光照5 000 lx,湿度85%;时段18:01-06:00为22℃,室内自然光,无其他补光,约为0~600 lx,湿度65%)。于稗草种子播后24~48 h后,每盆定苗100株,采用喷雾塔进行供试药剂喷雾,喷头孔径0.3 mm,喷雾压力0.3 MPa,雾滴直径100 μm,喷头流量 90 mL/min。其中,丙草胺和丁草胺的药剂浓度分别设置为0、318.75、637.50、1 275.00、2 550.00、5 100.00 g/hm2和 0、281.25、562.50、1 125.00、2 250.00、4 500 g/hm2。喷药后14 d,将稗草地上部分剪下,称其鲜重,重复4次。
1.5 数据处理
稗草发生量及土壤种子库分析:利用SPSS statistics v22.0软件,设稗草发生量及土壤种子库密度为因变量,设样点和调查年份为固定因子,采用一般线性模型,对稗草发生情况及土壤种子库密度进行分析,采用post-hoc(LSD),对各个样点内年际间稗草发生量及土壤种子库密度进行两两对比。此外,设稗草发生量及土壤种子库密度为因变量,设土壤类型、样点及调查年份为固定因子,采用线性混合模型,分析3种土壤类型条件下稗草发生量及土壤种子库差异。
抗药性分析:利用DPS v17.10软件,计算丙草胺和丁草胺的ED50,及ED50的 95%置信区间、相关系数r及相对抗性指数(RI)。RI=抗性生物型ED50/敏感生物型ED50,以 ED50最小的稗草生物型为敏感生物型,由此计算出各稗草生物型的相对抗性指数。抗性指数越大表示该稗草生物型的抗性水平越高。毒力回归方程如下:y=a+bx,其中,y为概率单位;a为截距;b为回归系数;x为以10为底的剂量对数值。鲜质量抑制率=(对照鲜质量-处理鲜质量)/对照鲜质量×100%[7,12,15]。本试验设定稗草对供试药剂的抗性水平评价标准为:低抗水平0 稗草发生数据显示,土壤盐碱化稻田中的稗草年发生量为16.23株/m2,显著高于土壤碱化稻田的11.70株/m2和非盐碱化稻田的10.10株/m2(表2)。2018年至2020年连续3年的调查结果显示,盐碱稻田2个样点的稗草发生密度整体呈现上升趋势。庵东镇和大徐镇分别从2018年的14.60株/m2和10.40株/m2,上升至2020年的23.20株/m2和19.80株/m2,上升趋势显著。在连续调查的3年间,土壤碱化稻田各样点的稗草发生密度较为接近,崇寿镇和丹东街道的稗草年平均发生密度分别12.27株/m2和11.13株/m2,且各样点3年间的稗草发生密度变化较小,差异不显著;非盐碱化稻田各样点的稗草发生密度变化不大,江口街道和邱隘镇的稗草年平均发生密度分别10.93株/m2和9.27株/m2,且各样点3年间的稗草发生密度变化较小,差异不显著(表2)。在6个样点中,庵东镇盐碱稻田稗草密度3年均值为18.33株/m2,显著高于其余5个样点的3年均值,其中,大徐镇盐碱稻田3年均值14.13株/m2,显著高于邱隘镇非盐碱化稻田的9.27株/m2(表2)。 水稻移栽后,秧苗5~7叶期时,盐碱化、碱化和非盐碱化稻田稗草的多度分别为62.92%、49.33%和39.10%,表明稗草种群在杂草群落中占据明显优势。其中,在盐碱化稻田中,稗草的种群优势最为明显,但随着土壤盐度下降,稗草在稻田杂草群落中的种群优势逐渐下降。此外,在土壤盐碱化及土壤碱化的稻田中,稗草的频度均为100%,在非盐碱稻田中则为92.50%,同样表明土壤盐碱化及土壤碱化情况下的稻田中,稗草种群在稻田杂草种群中的优势相对于非盐碱化稻田而言更明显(表2)。 土壤稗草种子库密度调查结果表明,土壤盐碱化稻田的土壤稗草种子库密度为19 169.17粒/m2,略高于土壤碱化稻田的17 224.83粒/m2,差异不显著但显著高于非盐碱化稻田的15 411.33的粒/m2(表3)。其中,土壤稗草种子库密度的显著性差异主要存在于土壤盐碱化的庵东镇样点和土壤非盐碱化的江口街道及邱隘镇;此外,显著性差异还存在于土壤盐碱化的大徐镇样点和非盐碱化的邱隘镇之间。此外,在土壤盐碱化的稻田中,仅庵东镇稻田稗草土壤种子库的密度在逐年增大,且2020年显著高于2018年;在土壤碱化的稻田中,2018年至2020年间,土壤稗草种子库密度并未发生显著变化;在土壤非盐碱化的稻田中,邱隘镇的土壤稗草种子库密度在年际间变化较大,呈现逐年降低的特征,且年际间存在显著性差异(表3)。 表3 2018年-2020年盐碱化、碱化及非盐碱化稻田土壤稗草种子库密度变化情况Table 3 Changes of Echinochloa crus-galli seed bank density in saline-alkali,alkalized and non-saline-alkali paddy fields in 2018-2020 稗草对丙草胺抗药性试验表明,土壤盐碱化稻田中的稗草对丙草胺的抗药性整体上高于非盐碱化稻田。盐碱稻田中,庵东镇和大徐镇的相对抗药性指数整体上呈增加趋势,分别从2018年的4.51和2.88增加至2020年的5.52和6.14,从低抗向中抗水平发展。土壤碱化稻田和非盐碱化稻田的稗草对丙草胺的抗药性水平在2018年-2020年3年中,始终处于低抗水平(表4)。 稗草对丁草胺抗药性数据显示,土壤盐碱化稻田的稗草对丁草胺的抗药性同样高于土壤碱化稻田。属于盐碱稻田的2个样点的庵东镇和大徐镇的相对抗药性指数在2020年均大于5.0,属于中抗水平,且抗药性程度呈现逐年上升的趋势。土壤碱化和非盐碱化稻田中,相对抗药性指数在2018年-2020年3年间均小于5.0,表明该样点的稗草对丁草胺处于低抗水平(表5)。 本研究表明,在宁波沿海地区,盐碱稻田的稗草种群发生量、土壤稗草种子库密度及稗草对丙草胺和丁草胺的抗药性程度均高于土壤碱化稻田和非盐碱化稻田的稗草种群;盐碱稻田的土壤盐度和碱度均增大时,稗草发生量、土壤稗草种子库密度及稗草对丙草胺和丁草胺的抗药性也有所增加;土壤碱化稻田和非盐碱稻田中,稗草发生量、土壤稗草种子库密度及抗药性程度较盐碱化稻田而言,相对较低。 在宁波沿海地区,作为盐碱地的庵东镇和大徐镇两个样点的稗草发生量大于土壤碱化稻田和非盐碱化稻田,导致这种现象的原因可能与宁波沿海地区围垦历史有关。庵东镇样点位于慈溪七塘以北,该地在1949年后开始围垦,而崇寿镇样点的土壤类型为碱化土,该点位于大古塘以南,为公元11世纪围垦[16]。因此,围垦年限上的巨大差异,会导致土壤发育进程、种植历史等方面的差异,由此也极可能影响到稻田生态系统中杂草群落的进化程度与方向[17]。其中,围垦年限相对较短的滨海稻田中,稗草往往因其较强的适应能力,作为先锋植物,较早进入稻田中定殖[18]。该阶段的稻田生态系统中,杂草物种多样性较低,率先建立种群的稗草较易成为优势种[19],占据更多资源和空间,并导致稗草发生量及土壤种子库密度升高。随着围垦年限增加,其他杂草逐渐进入盐碱稻田[20],并与稗草形成种间竞争,发生资源与空间的争夺,从而制约稗草种群的扩张[21-23]。随着更多不同杂草物种进入稻田,土壤理化性质也将进一步改变,如,碱蓬Suaedaglauca(Bunge) Bunge对盐分的富集以降低土壤盐分、杂草凋落物回田培肥等[24],促使盐碱地向非盐碱化方向发展,并进一步有利于其他杂草种群的定殖、建种,并参与沿海盐碱地杂草群落的演替。上述原因也解释了本研究中的土壤碱化稻田和非盐碱稻田的稗草种群发生量和种子库密度为何小于盐碱地、但其他杂草的多度和频度却高于盐碱地的现象。此外,本研究发现,稗草种群发生量并非随盐碱度升高而持续上升。当土壤盐碱化程度过高时,例如大徐镇的稻田中盐碱土的电导率高达1 188 μS/cm时,反而会抑制稗草种群规模,表明过高的盐碱度并不适合稗草发生。因此,在宁波沿海稻田中,盐碱稻田随着围垦年限拉长,土壤不断发育,土壤盐碱度将下降,有机质含量也将得到积累,稗草种群规模将在稻田杂草群落演替中逐渐缩小。 土壤稗草种子库密度与稗草发生及抗药性之间,其时空特征存在较强的相关性。稗草发生密度较高的盐碱稻田及对应的年份,其土壤种子库密度整体上也较高。然而,土壤种子库密度变化与稗草发生量也存在不一致的情况,如,邱隘镇的稗草发生量在过去几年间变化不大,但土壤稗草种子库的密度却急剧下降,导致这种情况的原因在于土壤种子库密度的年际变化与稗草发生可能存在一定的时滞。稗草种群发生量变化对种子库密度变化的响应可能稍晚于种子库密度的变化。然而,当稗草种子库密度降低至某个阈值,种子库密度对稗草发生量的影响将体现在稗草种群规模变化上。由于本研究仅对2018年至2020年之间的情况进行了调查分析,连续调查的年限较短也是导致未能找到明显时滞存在的原因。此外,土壤稗草种子库密度变化与抗药性之间存在较好的一致性,在土壤种子库密度较大的样点,稗草对土壤封闭除草剂的抗药性相对较强。 在宁波沿海地区,盐碱稻田的稗草对丙草胺和丁草胺的抗药性高于土壤碱化稻田和非盐碱稻田,其原因可能与稗草种群突变体的积累和土壤理化性质有关。一方面,宁波沿海的盐碱稻田中,由于稗草种群规模较大,同样的突变率将导致该类型稻田中的稗草突变体多于其他类型的稻田,而突变体的产生是杂草产生抗药性的遗传基础,是为内因[25-26]。另一方面,较高的土壤盐碱度则是稗草对除草剂产生抗药性的外因[27-28]。宁波沿海围垦年限较短的盐碱地的土质相对疏松,土壤吸附性差,除草剂的活性分子在土壤中容易移动,较难形成均匀一致的药土层,与内陆地区土质黏性好、有机质含量高的土壤相比,药效将降低[29]。对农业从业者而言,针对盐碱稻田土壤封闭剂药效的降低,常常通过增加除草剂剂量来防除杂草,往往导致除草剂实际施药量显著高于推荐量。同时,大部分农业从业者长期使用同一种或同一类除草剂,极少进行除草剂的科学复配或轮换使用[30],该用药习惯容易对稻田稗草形成较强的选择压,起到频繁筛选的效果,将筛选出并保留部分对某种或某类除草剂具有抗药性的突变个体,并促使抗药性基因积累、抗药性增强,最终形成高抗生态型种群[31]。 在稻田稗草抗药性问题上,通过科学合理地进行除草剂复配、轮换交替施药、精准施药,可在较大程度上降低稗草对某单一除草剂的抗药性风险,进而防止单抗、甚至多抗生态型稗草的产生[31-32];另一方面,可以加强研究绿色植保防控技术,通过各项除草剂技术的集成,减少除草剂的使用量和使用频率,实现除草剂的减量增效,进而遏制稻田稗草对除草剂产生抗药性[33-34]。 稗属杂草包括较多的种和变种,如稗草、光头稗E.colona、西来稗E.crus-gallivar.zelayensis等,不同稗草对某一除草剂的抗药性存在一定程度的差异[7],而本研究仅对稗进行了跟踪研究,得出的结论在生产实践中依然具有一定的局限性。此外,稻田中的杂草以群落形式出现,各种不同杂草间存在一定的互利共生或种间竞争等关系,其他杂草对除草剂的抗药性,同样会影响稗草的发生[35-36];而部分农业从业者往往对除草剂采用轮换或复配施药,这种情况下,稗草对除草剂的抗药性可以延缓发展[30]。最后,本研究的采样地点仅代表宁波沿海部分地区,也具有一定的局限性。 较高的土壤盐碱度将促进稻田稗草的发生,同时促进土壤稗草种子库密度的增加。土壤盐碱化程度较高时,稗草对土壤封闭剂丙草胺和丁草胺产生的抗药性也将增强。因此,在盐碱稻田中,土壤盐碱化程度对稻田稗草发生的影响不可忽视,为保证水稻产业的可持续发展,应加强对盐碱稻田土壤盐碱化的治理,从源头上解决盐碱地稻田杂草发生量大、种子库积累快及抗药性强的问题。2 结果与分析
2.1 稗草发生情况

2.2 土壤稗草种子库密度
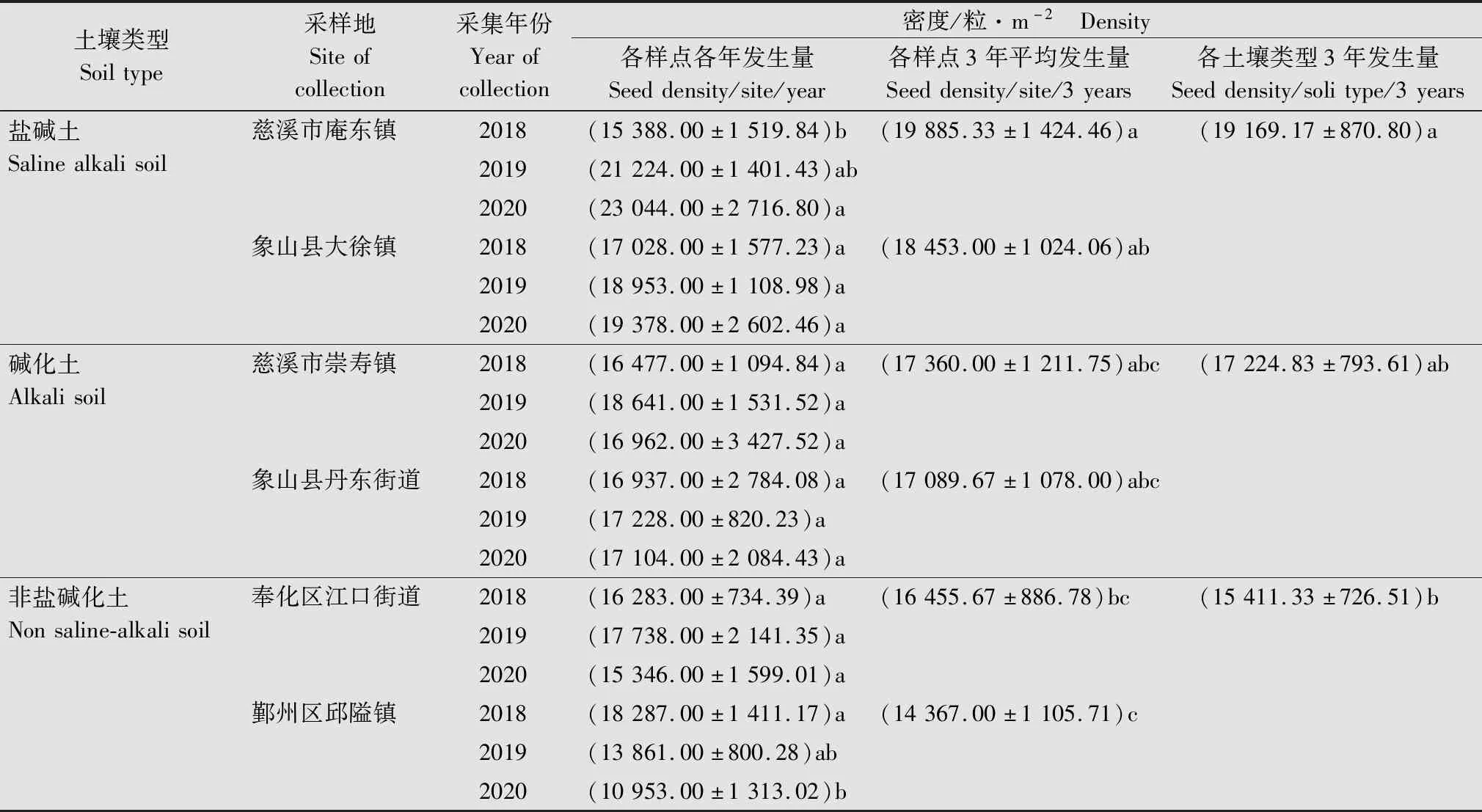
2.3 稗草对丙草胺和丁草胺的抗药性


3 讨论
3.1 稗草发生量与土壤盐碱化程度间的关系
3.2 土壤稗草种子库与稗草发生及抗药性之间的关系
3.3 产生抗药性的主要原因
3.4 延缓抗药性产生的策略、措施及本研究的不足之处
4 结论
