甘薯潜隐病毒莲藕分离物辅助成分-蛋白酶基因原核表达及抗血清制备
2022-12-19王凌琪董婷婷甘海锋徐小伟李良俊
王凌琪,董婷婷,陈 雯,甘海锋,徐小伟,秦 朗,李良俊,贺 振
(扬州大学园艺与植物保护学院,扬州 225009)
莲藕NelumbonuciferaGaertn.是莲科莲属多年生水生草本植物,原产中国、印度,是我国栽培面积最大的特色水生蔬菜[1]。近年来,江苏省莲藕主产区普遍出现一种“僵藕”现象,藕身瘦小,质地僵硬,表面布有棕褐色斑点、条斑,且深入表皮以下,严重影响莲藕的产量和品质。李良俊等在江苏地区“僵藕”叶片的叶肉组织发现有风轮状内含体,且在叶片的粗提取物中发现线条状病毒粒子,因此,认为“僵藕”可能是由植物病毒引起的[2]。目前,关于莲藕上的病毒的报道较少,主要包括黄瓜花叶病毒(cucumber mosaic virus,CMV)[3]、芋花叶病毒(dasheen mosaic virus,DsMV)[4]、甘薯潜隐病毒(sweet potato latent virus,SPLV)[5]和苹果茎沟病毒(apple stem groove virus,ASGV)[6]。
甘薯潜隐病毒是马铃薯Y病毒科Potyviridae马铃薯Y病毒属Potyvirus的正义单链RNA病毒。SPLV全基因组大约为10 kb,包含5′端和3′端的非编码区(non-translated region,NTR)及1个开放阅读框(open reading frame,ORF)。基因组5′端是VPg,3′端有一个Poly(A)尾。ORF编码一个大的多聚蛋白(polyprotein),可分割成10个成熟的蛋白产物,从N端到C端依次为第一蛋白(protein 1,P1)、HC-Pro、第3蛋白(protein 3,P3)、第1个6K蛋白(the first protein of 6 kD,6K1)、圆柱状内含体蛋白(cytoplasmic inclusion protein,CI)、第2个6K蛋白(the second protein of 6 kD,6K2)、病毒基因组连接蛋白(viral genome-linked protein,VPg)、核内含体蛋白a(nuclear inclusion body ‘a’ protein,NIa)、核内含体蛋白b(nuclear inclusion body ‘b’ protein,NIb)以及外壳蛋白(coat protein,CP)[7],其中P1、HC-Pro及NIa具有蛋白酶活性。此外,在P3蛋白中发现了1个小分子蛋白pretty interesting potyvirus ORF(PIPO)[8]。1979年在我国台湾的甘薯上首次发现SPLV[9],该病毒的介体昆虫为蚜虫,并且可随薯苗营养繁殖体及薯块进行传播[10]。
本实验室前期在莲藕中发现一种甘薯潜隐病毒分离物(sweet potato latent virus-lotus,SPLV-lotus)[11]。该分离物与SPLV甘薯分离物的序列差异很大,核苷酸相似性在76.28%~76.60%,处于国际病毒分类委员会(International committee on taxonomy of viruses,ICTV)制定的马铃薯Y病毒科病毒分种标准线附近(核苷酸相似性低于76%)。该分离物与SPLV甘薯分离物有4个蛋白酶水解切割识别位点存在差异,其编码PIPO的长度差异较大[5]。SPLV-lotus自然条件下能够侵染莲藕,并且通过接种后发现其能有效侵染豆科、藜科、葫芦科、茄科植物,但未见明显症状表现[11]。本研究克隆了SPLV-lotusHC-Pro基因,通过原核表达,将纯化后的HC-Pro重组蛋白作为抗原制备抗血清,以期为SPLV-lotus的检测和有效防治提供技术支持。
1 材料与方法
1.1 材料
携带SPLV的莲藕以及pGEX4T-1载体由本实验室保存。普通TaqDNA聚合酶、I-5TM2×High-Fidelity Master Mix购自擎科生物技术有限公司;T4 DNA连接酶、Premixed Protein Marker、反转录酶以及限制性内切酶、考马斯亮蓝R250购自TaKaRa公司;快捷型琼脂糖DNA回收试剂盒、PCR产物回收试剂盒和高纯质粒小量制备试剂盒购自BioTeke公司。大肠杆菌 Rosetta(DE3)购自上海唯地生物技术有限公司。引物合成和测序由擎科生物技术有限公司完成。GST标签蛋白纯化介质购自南京金斯瑞生物科技有限公司。超滤离心管Ultra-15(Millipore,美国)、谷胱甘肽、DTT、蛋白胨、酵母提取物、甲醇、氨苄青霉素(Amp)、SDS、Tris、LiCl购自生工生物工程(上海)股份有限公司;anti-CPPVX兔抗体为本实验室制备。NBT(Nitro blue tetrazolium)、BCIP(5-bromo-4-chloro-3-indolyl-phosphate)、彩虹180广谱蛋白marker、IPTG、PMSF、甘油、N′,N′-二甲基甲酰、溴酚蓝、β-巯基乙醇购自北京索莱宝科技有限公司;PVDF膜购自GE Healthcare。ELISA试剂盒购自上海桥杜生物科技有限公司。
1.2 SPLV-lotus HC-Pro基因的RT-PCR扩增及原核表达载体构建
根据甘薯潜隐病毒莲藕分离物全基因组序列合成一对引物:上游引物SPLV-lotus-F(5′-CCGGAATTCGCAGACACAGCCCAAAAGTT-3′,下划线部分为EcoRI酶切位点)和下游引物SPLV-lotus-R(5′-TTGCGGCCGCGACCCACAACATAGAATTTCAT-3′,下划线部分为NotI酶切位点)。采用LiCl法提取莲藕总RNA,经反转录后,以cDNA为模板,PCR扩增SPLV-lotusHC-Pro基因。50 μL PCR反应体系:10 μmol/L上下游引物各2 μL、cDNA 4 μL、RNase Free Water 17 μL、I-5TM2×High-Fidelity Master Mix 25 μL。PCR反应条件:98℃预变性2 min;98℃变性10 s,65℃退火15 s,72℃延伸1 min,30个循环;72℃延伸10 min;4℃保存。
PCR产物经1%琼脂糖凝胶电泳分离后,利用凝胶回收试剂盒回收纯化目的片段,用EcoRI和NotI进行双酶切,与同样用EcoRI和NotI双酶切的原核表达载体pGEX4T-1在16℃金属浴中过夜连接。连接产物转化大肠杆菌Rosetta(DE3)。经菌落PCR验证阳性克隆后,随机选取5个克隆由擎科生物技术有限公司进行测序,所得序列利用Blastn、BioEdit和DNAMAN软件进行序列比对和分析,从中选择测序结果正确的克隆,提取重组表达质粒。
1.3 SPLV-lotus HC-Pro的诱导表达及蛋白纯化
将转入大肠杆菌Rosetta(DE3)的阳性单菌落在LB平板上活化,之后接种到含100 mg/mL Amp的LB液体培养基中,37℃,200 r/min培养过夜。将过夜培养的菌液以1∶100的比例加入500 mL LB (含100 mg/mL Amp)中,37℃,200 r/min 振荡培养至OD600在0.6~0.8,加入诱导剂IPTG,使其终浓度为1 mmol/L,18℃,180 r/min 条件下诱导培养17 h后,在4℃条件下,9 000 r/min离心20 min。收集菌体,用蛋白缓冲液悬浮。加入终浓度为1 mmol/L PMSF,冰浴超声波破碎后,12 000 r/min 离心1 h。利用GST标签蛋白纯化介质进行蛋白纯化。SDS-PAGE电泳检测纯化蛋白。
1.4 抗血清的制备、效价检测及Western blot分析
利用纯化的重组蛋白免疫新西兰大白兔并获得多克隆抗血清PAb-HC-ProSPLV-lotus,通过间接ELISA测定抗血清效价。将检测到SPLV-lotus的莲藕阳性样品液氮冷冻后用研磨仪磨碎,每0.1 g样品加蛋白提取缓冲液500 μL,振荡混匀后静置10 min,再12 000 r/min 离心10 min。取100 μL上清液加入样品孔中,加盖在37℃恒温黑暗条件下反应4 h。将酶联板上的抗原溶液倒尽,加入PBST洗涤4次,300 μL/孔,30 s/次。加入封闭液(PBST+5% 脱脂奶粉)100 μL,37℃恒温黑暗条件下反应2 h。加入PBST稀释 (1∶2 000)蛋白抗血清,稀释至250、1 000、4 000、16 000、64 000、256 000倍,100 μL/孔,37℃温育2 h。PBST洗涤4次,每次30 s。加入用PBST稀释 (1∶5 000) 的AP酶标二抗100 μL,37℃孵育60 min。再用PBST洗涤4次,每次30 s。每孔加碱性磷酸酯酶底物显色溶液90 μL(二抗量的90%),37℃恒温黑暗条件下反应15 min到1 h。最后,每孔加50 μL 2 mol/L NaOH,而后用酶标仪测定OD405,保存数据,进行分析。
同时,通过Western blot检测抗血清特异性,具体试验方法如下。用液氮将检测到SPLV-lotus的莲藕阳性样品冷冻后研磨成粉末,加入100 μL 1×SDS上样缓冲液,涡旋振荡;将制备好的样品置于沸水中加热10 min后,12 000 r/min离心10 min;取10 μL上清液进行SDS PAGE电泳。电泳结束后,在1×转膜缓冲液中以200 mA,90 min的电泳将蛋白质转移至PVDF膜上;随即转入10 mL封闭液(TBST缓冲液+5%脱脂奶粉)中,37℃恒温条件下反应1 h,封闭结束后在1×TBST缓冲液中洗涤PVDF膜3次,每次10 min。洗涤结束后将PVDF膜置于含2 μL抗血清的10 mL 1×TBST中,37℃恒温条件下反应1 h;反应结束后用1×TBST缓冲液洗脱3次,每次10 min。随后将PVDF膜置于含2 μL的AP酶标二抗的10 mL 1×TBST中,37℃反应45 min;二抗结束后用1×TBST缓冲液洗脱3次,每次10 min。洗脱结束后将膜放至含有330 μg/mL NBT和165 μg/mL BCIP的碱性磷酸酯酶缓冲液中避光显色至条带清晰。
2 结果与分析
2.1 SPLV-lotus HC-Pro基因RT-PCR扩增及原核表达载体构建
以携带SPLV的莲藕样品反转录的cDNA为模板,利用特异性引物SPLV-lotus-F/SPLV-lotus-R进行RT-PCR扩增,获得大小约为1 375 bp的目的片段(图1)。对构建的原核表达载体pGEX4T-1-HC-ProSPLV-lotus进行双酶切验证(图2),并对重组表达质粒进行测序,结果显示与目的序列一致,表明重组质粒构建成功。

图1 SPLV-lotus HC-Pro基因RT-PCR扩增Fig.1 RT-PCR amplification of SPLV-lotus HC-Pro gene
2.2 SPLV-lotus HC-Pro基因原核表达及蛋白纯化
使用1 mmol/L IPTG诱导重组靶标蛋白的表达,对诱导表达产物进行SDS-PAGE电泳分析,结果显示pGEX4T-1-HC-ProSPLV-lotus在74 kD附近出现与预期大小一致的融合蛋白条带(图3,泳道2),未诱导对照(图3,泳道3)在该位置没有过量表达蛋白,表明pGEX4T-1-HC-ProSPLV-lotus在大肠杆菌中正确表达。
对18℃诱导17 h后的表达菌液进行超声波破碎,破碎后将其与GST蛋白纯化介质融合混合3 h,随后使用谷胱甘肽洗脱液进行洗脱测试(图4a)。最后,使用超滤离心管Ultra-15(30 kD)对洗脱的蛋白进行浓缩。本试验以0.5 mg/mL BSA作为对照,对纯化重组HC-ProSPLV-lotus蛋白进行定量,结果发现HC-ProSPLV-lotus蛋白浓度与0.5 mg/mL BSA相比,都在74 kD大小的位置出现条带,证明蛋白纯化合格(图4b)。结果表明,本试验的蛋白质纯化方法正确,并且HC-ProSPLV-lotus蛋白的浓度满足多克隆抗血清制备条件的要求,可用于免疫新西兰大白兔。

图2 酶切鉴定pGEX4T-1-HC-ProSPLV-lotus重组质粒Fig.2 Identification of pGEX4T-1-HC-ProSPLV-lotus recombinant plasmid by restriction enzyme digestion

图4 HC-ProSPLV-lotus蛋白纯化和定量Fig.4 Purification and quantification of the HC-ProSPLV-lotus protein
2.3 抗血清效价检测及Western blot分析
将纯化的重组蛋白HC-ProSPLV-lotus作为抗原,免疫新西兰大白兔。将制备好的多克隆抗血清(PAb-HC-ProSPLV-lotus)用于ELISA效价测定。当PAb-HC-ProSPLV-lotus稀释比为1∶256 000时,ELISA显色后OD450读数仍高于0.6(图5a),表明所制备的PAb-HC-ProSPLV-lotus效价合格,可用于后续血清学检测。为验证PAb-HC-ProSPLV-lotus的特异性,利用纯化后的HC-ProSPLV-lotus蛋白作为抗原,进行Western blot分析验证,检测结果显示目的蛋白带符合预期大小(图5b),说明制备的PAb-HC-ProSPLV-lotus能用于HC-ProSPLV-lotus的特异性检测。
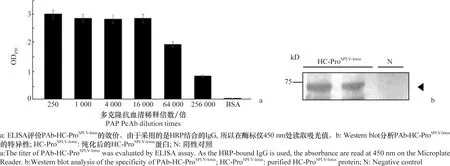
图5 评估制备的PAb-HC-ProSPLV-lotus抗体的效价Fig.5 Evaluation of the titer of prepared PAb-HC-ProSPLV-lotus
2.4 田间莲藕样品的检测
为了测试制备的PAb-HC-ProSPLV-lotus能否用于对田间样品的检测,从江苏省扬州市采集了8个新鲜莲藕样品,提取其总蛋白及RNA,使用Western blot和RT-PCR检测。由于HC-Pro蛋白大小 48 kD 左右,加上GST标签(26 kD)融合表达大概在74 kD左右,所以莲藕样品目的条带蛋白大小比HC-ProSPLV-lotus纯化蛋白要小,Western blot结果显示在特定大小位置出现特异性预期条带,RT-PCR结果与Western blot结果一致(图6~7),这表明制备的抗血清能有效的检测到田间样品中的SPLV-lotus。

图6 田间莲藕样品RT-PCR检测结果Fig.6 RT-PCR detection of the lotus samples from the field
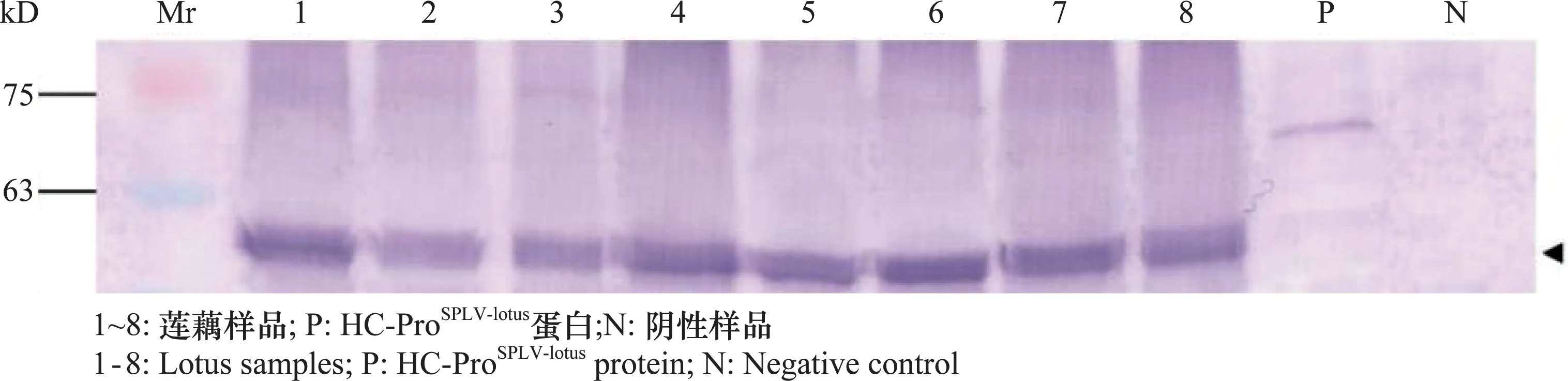
图7 田间莲藕样品Western blot检测结果Fig.7 Western blot detection of the lotus samples from the field
3 结论与讨论
植物病毒检测是研究病毒以及培育脱毒种苗等不可缺少的技术手段,因此建立一种经济、快速、准确的检测方法极其重要。其中,血清学方法具有灵敏度高、快速且适合大量样品检测等优点,在植物病毒检测中不可缺少。自1928年Beale首次将血清学技术应用于植物病毒的研究,该技术已逐步发展成为诊断和鉴定病毒的基础方法,并在植物病毒的检疫及测报、植物病毒的定位、增殖、移动、基因功能以及介体和寄主的互作机理等方面的研究中发挥着重要作用[13]。
Nikolaeva通过克隆柑橘速衰病毒(citrus tristeza virus,CTV)外壳蛋白基因到表达载体,转化大肠杆菌并在该细菌中得到表达,再通过分离病毒外壳蛋白,制备多克隆抗体,最终将其应用于衰退病的检测[14]。生产上一般利用纯化的病毒粒子作为抗原制备抗血清,由于受到提纯条件和纯化技术的限制,该方法制备的抗体容易导致假阳性反应,或者因植株含有大量多糖多酚类物质而很难提纯[15-17]。通过大肠杆菌表达病毒蛋白作为抗原制备抗体,不仅能克服上述缺点,而且大肠杆菌表达系统相较于酵母表达系统、昆虫细胞表达系统等具有产量高、细胞生长速度快及易于操作等优点,是未来大量而快速制备抗血清发展的主要方向[18]。
HC-Pro是一种多功能蛋白,它控制植物的蚜传特性、参与病毒的侵染与复制、病毒编码多聚蛋白的加工剪切、病毒的细胞间和长距离移动以及病毒间的协生作用等,在病毒的生活史中起重要作用[12]。郭明等构建了PVY-C HC-Pro基因的原核表达载体,并制备了HC-Pro的抗血清[19]。郝兴安于2006年首次对甘蔗花叶病毒的HC-Pro进行了原核表达[20]。
近年来,甘薯潜隐病毒莲藕分离物在江苏省莲藕主产区发生越来越普遍,部分地区呈现流行暴发趋势[5]。目前对该病毒的研究较少,急需建立一种高效且特异的检测方法。本研究从感病的莲藕样品中克隆出SPLV-lotusHC-Pro基因,通过原核表达并纯化了SPLV-lotus的HC-Pro蛋白。使用免疫新西兰大白兔制备了效价较高的抗血清,并对抗血清检测效果进行了初步评价,建立了SPLV-lotus抗血清的Western blot检测体系,适用于田间生产上的检测,为病毒的防治与研究提供了基础。
