一株溶杆菌Lysobacter soli RCu6 的转录组水平铜抗性机制研究*
2022-12-18李富玉陈帅民刘梦帅陈苗苗李小方刘彬彬
李富玉 ,陈帅民 ,刘梦帅 ,陈苗苗 ,李小方 ,刘彬彬**
(1. 中国科学院遗传与发育生物学研究所农业资源研究中心 石家庄 050022;2. 中国科学院大学 北京 100049;3. 吉林省农业科学院农业资源与环境研究所 长春 130033;4. 中国农业大学资源与环境学院/植物-土壤相互作用教育部重点实验室/中国农业大学国家农业绿色发展研究院 北京 100193;5. 瓦赫宁根大学植物生态与自然保护组 瓦赫宁根 6700AA 荷兰)
铜是生物系统中必不可少的微量元素,然而,高浓度的铜通常对生物有害[1]。生物体已经进化出复杂的铜稳态系统,以维持正常的细胞铜供应,同时解毒过量的铜[2]。阐明细菌对铜的抗性机制对利用微生物技术治理重金属污染、实现污染耕地安全利用具有重要意义。
目前的研究已经鉴定了多种细菌对铜的抗性机制,如丁香假单胞菌(Pseudomonas syringae)的cop机制,该机制包含copABCDRS基因,copRS为调节基因,copA 和copC 为周质空间蛋白,copD 为内膜蛋白,其功能是负责铜的运输;大肠杆菌(Escherichia coli)的铜抗性机制包括cut 机制、cus 机制和pco 机制。cut 机制包含cutABCDEFRS基因,cutA和cutB参 与铜的吸收,cutF参与铜的运输,cutC和cutD参与铜的排放;pco 机制包含pcoABCDRSE基因,pcoA具有氧化活性,可将Cu+氧化为Cu2+减弱对菌体的毒害,cus系统中的cusF 蛋白首先在大肠杆菌中被鉴定,细胞周质中的Cu+被cusF 蛋白转运到cusABC 通道进行离子外排[3]。铜绿假单胞菌(Pseudomonas aeruginosaPAO1)通过铁载体与重金属配合物结合增强其对铜的抗性[4]。具有重金属抗性细菌也可以通过结合金属硫蛋白(MT)和低分子量半胱氨酸蛋白来抑制有毒重金属的生物利用度[5],如贪铜菌(Cupriavidus gilardiiCR3)通过半胱氨酸和谷胱甘肽的生物合成产生重金属螯合分子,促进其对铜的解毒作用[6]。这些机制在分子水平上是一个复杂的过程,尽管各种铜抗性系统的功能已在许多细菌中被鉴定出来,然而,这些复杂过程的很多分子调控机制仍不清楚。
全基因组测序是研究微生物功能的重要方法,从基因组层面研究细菌对铜的抗性机制能够全面了解细菌体内与重金属抗性及代谢途径相关的基因;转录组学分析可以确定细菌如何对特定的非生物条件作出转录反应,是阐明细菌对重金属抗性分子机制的重要手段;利用基因组学和转录组学结合能够全面地从分子层面揭示细菌对生理毒害和环境的响应机制。溶杆菌Lysobacter soliRCu6 (以下简称RCu6)是我们在土壤中分离到的具有铜抗性的菌株,属于溶杆菌(Lysobacter soli),该菌基因组携带有许多铜抗性基因簇,如copLABMGA、cusABC、czcABC等。然而,目前对溶杆菌属细菌铜抗性机制的研究仍鲜见报道。本研究旨在揭示菌株RCu6 的基因组特性以及RCu6 对铜胁迫的转录反应和可能参与铜抗性的代谢途径,为微生物的重金属抗性机制提供新的认识,为通过微生物技术实现耕地的安全利用提供依据。
1 材料与方法
1.1 菌株RCu6 的分离和最小抑制浓度(MIC)的确定
本研究中使用的RCu6 菌株分离自中国科学院栾城农业生态系统试验站(114°41′E,37°53′N)。将10 g 小麦季土壤和10 mL 无菌超纯水置于50 mL 离心管中,于25 ℃、150 rpm 下振荡培养1 h,然后将细菌培养物接种于选择琼脂培养基上(具体配方见电子版附表S1 或扫描首页OSID 码),取单菌落接种至选择培养基中进行纯化。
本研究利用Wang 等[7]使用的两倍稀释法来确定RCu6 的MIC (MIC 被定义为培养24 h 后无细菌生长的最低浓度)范围,将RCu6 接种到Luria-Bertani (LB)培养基中,于25 ℃、150 rpm 下培养6 h,将CuSO4溶液(使培养基中Cu2+的浓度为0~4 mmol·L-1,每0.2 mmol·L-1为一个梯度)添加到相应的锥形瓶中培养24 h。使用分光光度计(UV-6100S,上海元析)测量OD600值来监测微生物量[8],每个Cu2+浓度梯度均设置3 个重复。
在LB 培养基中添加Cu2+,使其浓度分别为0.4 mmol·L-1、0.8 mmol·L-1、1.2 mmol·L-1和 1.6 mmol·L-1,于25 ℃、150 rpm 的速度振荡培养72 h,每个Cu2+浓度梯度设置3 个重复。使用分光光度计每8 h 记录一次OD600值,构建细菌生长曲线。
1.2 铜去除能力的测定
在含有不同铜浓度(0.4 mmol·L-1、0.8 mmol·L-1、1.2 mmol·L-1和1.6 mmol·L-1)的LB 培养基中培养RCu6 菌48 h 后,以10 000 rpm 离心10 min,去掉上清,收集菌体,用无菌超纯水洗涤3 次,然后加入10 mL 5 mmol·L-1EDTA,于25 ℃、150 rpm 振荡培养30 min;用原子吸收光谱法(Shimadzu AA-6300,日本京都)测量上清液中的铜浓度以得到细胞表面吸附量;将细菌在85 ℃下干燥24 h,使用65%的浓硝酸在150 ℃下消解细菌2 h 后,测量铜的质量以得到RCu6 菌株细胞内铜吸附量。
1.3 菌种鉴定及全基因组测序、组装、注释
使用G-spin DNA 提取试剂盒(iNtRON Bio-technology Inc.,Sungnam,Korea),按照说明提取RCu6 菌的基因组DNA。使用27F (5′-AGAGTTTGATCMTGGCTCAG-3′)和1492R (5′-TACGGYTACCTTGTTACGACTT-3′)引物扩增16S rRNA 基因[9],扩增过程为95 ℃初始变性5 min;然后进行25 个循环(95 °C 变性1 min,55 ℃退火1 min,72 ℃延伸2 min);最后在72 ℃延伸10 min。16S rRNA 基因和细菌基因组测序工作委托苏州金唯智生物科技有限公司完成。使用BLASTN (NCBI)和EzTaxon-e servers[10]对细菌16S rRNA 基因进行比对分析。
使用FastQC (https://www.bioinformatics.babraham.ac.uk/projects/fastqc/)和Cutadapt 软件[11]对基因组测序获得的原始序列进行质量控制和过滤,以去除低质量序列和接头序列;使用HGAP4[12]对过滤后的read 进行基因组组装;使用Prodigal[13]预测蛋白质编码基因;使用默认参数设置的tRNAScan-SE[14]和RNAmmer[15]预测tRNA 基因和rRNA 基因;使用Non-Redundant Protein Sequence Database (NRDB),Kyoto Encyclopedia of Genes and Genomes (KEGG),Gene Ontology (GO)和Protein Orthologous Group (COG)对编码基因的功能进行注释。本部分研究产生的原始序列(raw reads)已提交到NCBI (PRJNA799173)。
1.4 RNA 提取和转录组测序
选择两种浓度的铜胁迫(0.8 mmol·L-1和1.6 mmol·L-1)进行转录组研究,不加铜的处理作为对照,每种处理设置3 个重复。将RCu6 菌株按1%的体积比接种量接种到50 mL LB 培养基中,于25 ℃、150 rpm 下培养至OD600为0.5。随后添加CuSO4溶液(使其Cu2+的浓度分别为0.8 mmol·L-1和1.6 mmol·L-1,0 mmol·L-1为对照),并培养至OD600值为1.2,在4 ℃下以8000×g 离心2 min 收集菌体。使用RNAeasy Mini 试剂盒(Qiagen)提取细菌细胞中的总RNA;使用NEBNext® UltraTMDirectional RNA Library Prep Kit for Illumina 构建RNA-seq 文库,在Illumina HiSeq X Ten (Illumina,San Diego,CA,USA)平台对文库进行2×150 bp 测序(文库的构建和转录组测序工作委托苏州金唯智生物科技有限公司完成)。
1.5 转录组数据分析
使用FastQC (https://www.bioinformatics.babraham.ac.uk/projects/fastqc/)对Raw reads 进行质量控制;使用Cutadapt[11]去除低质量分数(Phred 分数<30)的碱基以及接头序列;使用Bowtie2 (http://bowtie-bio.sourceforge.net/bowtie2/index.shtml)构建参考基因组索引并与RCu6 完整基因组进行比对,使用HTSeq[16]计算基因表达count 值;使用Deseq2[17]分析铜胁迫下基因表达水平(无铜胁迫为对照);根据校正后的P值(P-adj)<0.01 筛选出显著差异表达基因(DEGs);并将DEGs 用于GO 富集分析和KEGG 通路分析。使用Annota-tionDbi (https://bioconductor.org/packages/AnnotationDbi)构建R package 进行GO 富集分析(P-adj<0.05),使用KOBAS (http://kobas.cbi.pku.edu.cn)进行KEGG 通路富集分析。本部分研究产生的原始序列已提交到NCBI (PRJNA799196)。
1.6 实时定量PCR
从1.6 mmol·L-1铜胁迫的转录组数据中随机选择12 个与铜抗性相关的DEGs (copZ,copA,1_585,hisD,copG,hisG,copM,cueR,copB,sufC,copL,copB),使用12 种引物进行qPCR 以验证RNA-seq 数据的可靠性。使用Primer 3 软件(http://bioinfo.ut.ee/primer3-0.4.0/)设计引物序列;在qPCR 之前,使用RNase-free DNase I (Promega,美国)从总RNA 中去除基因组DNA;并利用primeScriptTMRT reagent Kit with gDNA eraser (TaKaRa)进行反转录;qPCR 体系包含10 μL TB Green® Premix Ex TaqTMII(Takara),正、反向引物各0.5 μL(10 μmol·L-1)、1 μL cDNA和 8 μL 无菌蒸馏水,qPCR 程序为95 ℃下变性3 min,然后进行35 个周期的扩增(即95 ℃下5 s,60 ℃下30 s);利用16S rRNA 基因和GAPDH 基因作为内参基因,每个反应重复3 次;使用2-ΔΔCT方法计算相对表达量[18-19]。
2 结果与分析
2.1 RCu6 菌株的铜抗性和富集能力
在本研究中,Cu2+对菌株RCu6 的最小抑制浓度为3.2 mmol·L-1,RCu6 菌在低铜浓度(0.4 mmol·L-1、0.8 mmol·L-1和1.2 mmol·L-1)下的生长速度与对照组(0 mmol·L-1)相似;在1.6 mmol·L-1的Cu 浓度下,与对照组相比,RCu6 的生长被抑制(图1a)。随着Cu 浓度的增 加(从0.4 mmol·L-1到1.6 mmol·L-1),细胞表面吸收量从0.16 mg·g-1增加到1.59 mg·g-1,在细胞内富集量从0.28 mg·g-1增加到0.92 mg·g-1(图1b)。
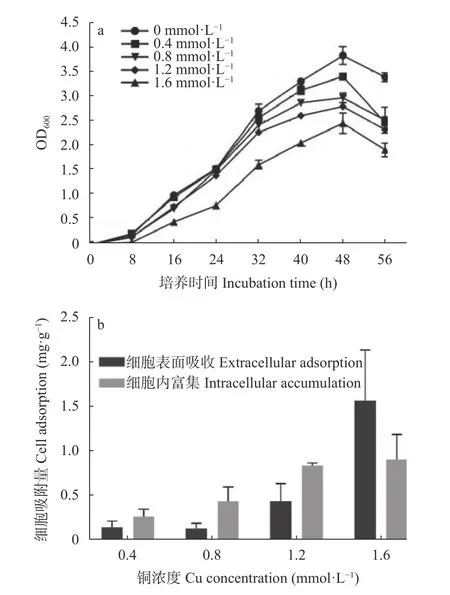
图1 Lysobacter soli RCu6 在不同铜浓度培养基中的生长情况(a)及其细胞膜和细胞内铜吸附累积量(b)Fig.1 Growth curve (a) and copper extracellular adsorption and intracellular accumulation (b) of Lysobacter soli RCu6 in medium with different copper concentrations
2.2 菌株RCu6 的基因组学特性
利用NCBI 数据库对16S rRNA 基因序列进行BLAST 分析,结果显示菌株RCu6 与溶杆菌Lysobacter soliDCY21 的一致性最高(99.72%) (图2)。RCu6菌株的基因组为4.1 Mbp,GC 含量为67.86%,共有3681 个编码序列,21 个rRNA 基因和52 个tRNA 基因。基因组的功能注释显示,蛋白质编码基因的比例为97%,被注释到COG 数据库的基因比例为67%。最丰富的3 个类别是转录(transcription)、氨基酸运输和代谢(amino acid transport and metabolism)以及细胞壁/膜/包膜生物形成(cell wall/membrane/envelope biogenesis) (图3)。

图2 溶杆菌Lysobacter soli RCu6 的系统发育树Fig.2 Phylogenetic position of Lysobacter soli RCu6
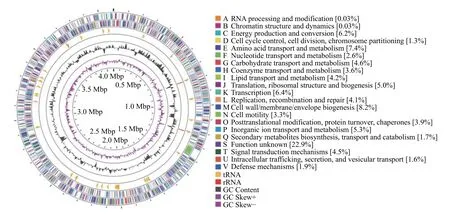
图3 Lysobacter soli RCu6 基因组信息Fig.3 Lysobacter soli RCu6 genome information
RCu6 与该属菌株的基因组比较,在其他菌株基因组上显示了一些缺口(图4),表明该菌株基因组的独特性。RCu6 与L.soliXL170、L.soliKCTC 22011、L.ummosus3.2.11 和L.capsici55 之间的平均核苷酸一致性(ANI)值分别为96.53%、96.73%、78.76%和78.81%。

图4 基于比较基因组圈图的Lysobacter soli RCu6 和密切相关菌株的BLAST 比较基因组分析Fig.4 Genome comparison between Lysobacter soli RCu6 and closely related strains based on BLAST comparative genomic analysis
2.3 转录组数据的分析和验证
转录组测序后,经过质量控制,从9 个测序样本中共产生了3.51 亿条序列,99%以上的RNA 测序序列映射到了RCu6 基因组上(见电子版附表S2,或扫描首页OSID 码)。与对照组相比,0.8 mmol·L-1和1.6 mmol·L-1铜处理组表现出强烈的响应,分别共有315个(占检测基因的8.6%,239 个上调和76 个下调)和839 个(占检测基因的22.8%,449 个上调和390 个下调) DEGs。
在qPCR 中,选定的上调和下调基因的表达量也得到了证实(见电子版附表S3 或扫描首页OSID 码),qPCR 和RNA-seq 数据之间显示出显著的相关性,GAPDH 基因作内参基因时的相关性R2=0.84;16S rRNA 基因作内参基因时R2=0.98 (P<0.001) (图5;引物见电子版附表S4 或扫描首页OSID 码)。这些结果证实了RNA-Seq 数据的可靠性。
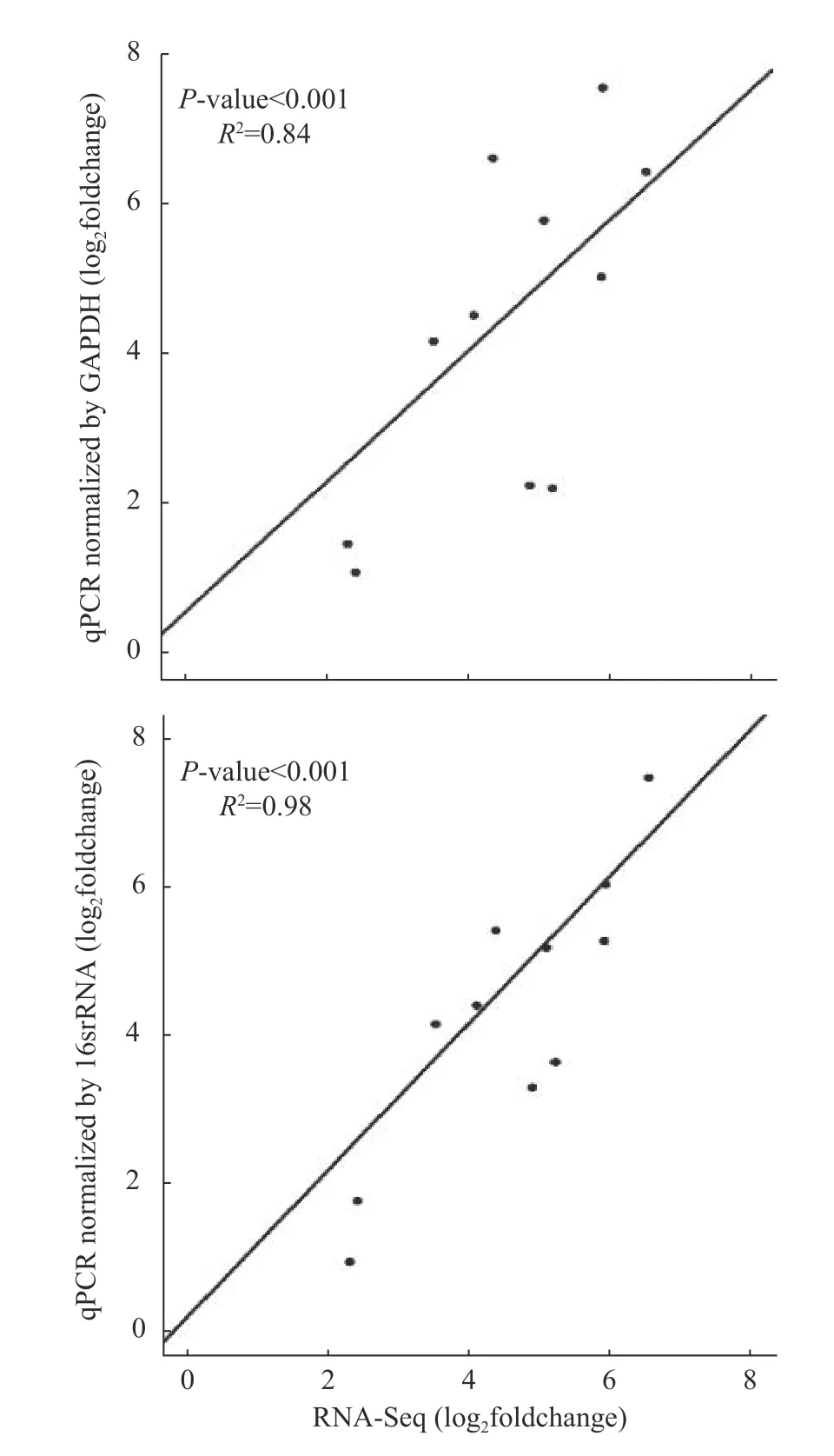
图5 铜浓度为1.6 mmol·L-1 下Lysobacter soli RCu6 基因表达qPCR 和RNA-Seq 间的相关性Fig.5 Correlation of gene expression data between qPCR and RNA-Seq of strain Lysobacter soli RCu6 at a copper concentration of 1.6 mmol·L-1
2.4 响应铜胁迫的基因和代谢途径
为深入了解RCu6 铜胁迫有关的代谢途径,采用超几何检验(Hypergeometric tests)来确定显著富集的GO terms 和KEGG 代谢途径。结果显示在0.8 mmol·L-1铜胁迫组中富集的GO terms 包括: 离子结合(GO:0043169、0005507、0043167 和0046872)、对氧化胁迫的反应(GO: 0006979)和氧化还原酶活性(GO:0016491);在1.6 mmol·L-1铜胁迫组中富集的GO terms 包括: 运输(GO: 0051181 和1901678)、氨基酸代谢过程(GO: 0009072、0006547 和0052803)、金属离子结合(GO: 0005507 和0046872)、氧化还原过程(GO: 0055114)、氧化还原酶活性(GO: 0016491)以及电子传输链(GO: 0022900) (图6)。KEGG 富集分析显示,在0.8 mmol·L-1和1.6 mmol·L-1铜胁迫时,显著富集的途径有(详见电子版附表S5 或扫描首页OSID 码): 柠檬酸循环(TCA cycle)、氨基酸的生物合成(biosynthesis of amino acids)、碳代谢(carbon metabolism)、组氨酸代谢(histidine metabolism)和硫代谢(sulfur metabolism)。这一结果表明,这些过程可能在铜抗性机制中发挥了重要作用。
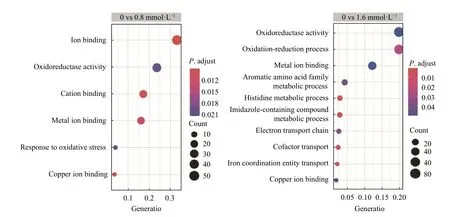
图6 0.8 mmol·L-1 和1.6 mmol·L-1 铜胁迫下Lysobacter soli RCu6 细菌差异表达基因的GO 功能富集图Fig.6 GO function enrichment plots of differentially expressed genes in Lysobacter soli RCu6 bacteria under 0.8-and 1.6-mmol·L-1 Cu stress
表S6 和S7 (见电子版附表或扫描首页OSID 码)分别显示上调和下调程度最高的基因,这些基因功能分类主要包括金属离子运输和代谢、氧化还原酶家族以及部分未知功能基因;在0.8 mmol·L-1铜胁迫下,两个上调最高的基因分别是铜伴侣基因copZ(1_1472)和重金属转运P 型ATP 酶copA(1_2614)(log2foldchange 分别为7.68 和7.46),而下调最大的是编码外膜受体蛋白基因1_143(log2foldchange 为-4.17);在1.6 mmol·L-1铜胁迫时,两个上调最高的基因分别是血红素吸收蛋白基因hmuP(1_1268)和外膜受体基因(1_2539) (log2foldchange 为9.88 和9.07),下调最大的是编码与外膜受体蛋白相互作用的基因(1_143) (log2foldchange 为-6.66)。
与铜抗性相关的基因对两种浓度的铜胁迫表现出较大的响应(见电子版附表S8 或扫描首页OSID 码),大多数基因(0.8 mmol·L-1浓度下有23 个,1.6 mmol·L-1浓度下有21 个)在铜胁迫下显著上调,DEGs 包括3 个铜抗性基因簇:copLABMGA_cusABC_soxR_copZ_merT、copLABA_cueR和czcABCD。转录组结果表明这些基因可能与菌株RCu6 的转录调控(copL)、铜结合(copZ、copG)、铜运输(copA1、copB)、多铜氧化酶(copA2、copG)和铜外排系统(cusAB、czcC)相关。此外,在0.8 mmol·L-1和1.6 mmol·L-1铜胁迫下与氧化应激和氧化还原酶活性有关的基因分别有28 个和74 个显著差异表达。有趣的是除多铜氧化酶外,脱氢酶还原酶(fabg)、铁依赖性加氧酶(piuC)、细胞色素C 氧化酶(copM)、脱氢酶(qor)和催化酶(KatG,AHPC)显著上调,表明这些基因可能在铜胁迫下的氧化应激和维持细胞氧化还原平衡中发挥作用。
3 讨论与结论
本文揭示了菌株RCu6 对铜的耐受性及其对铜胁迫响应的分子机制。我们进行了菌株的全基因组测序,并利用转录组研究了在铜胁迫条件下的转录水平响应机制,揭示了铜抗性基因表达、组氨酸代谢途径、硫代谢和Fe-S 簇组装系统对铜胁迫有明显的响应。
在本研究中,RCu6 携带许多与铜抗性有关的基因,这些基因对铜胁迫表现出强烈的转录响应。RCu6 菌的铜抗性的实现可能与copL基因(转录调控)[20]相关,这与多种细菌(如丁香假单胞菌[21]和贪铜菌)[3]中描述的双组分调控系统(copRS)不同。铜结合蛋白(copZ、copG编码)可以与细胞内的游离Cu+或Cu2+结合以降低铜的毒性[3,22-23],铜转运蛋白(copA1、copB)可以跨细胞膜转运铜离子[24-25],多铜氧化酶(copA2、copG)可以将Cu+氧化为Cu2+以降低铜离子的细胞毒性[26-28],铜离子外排系统(cusAB、czcC)形成的外膜通道可以跨膜转运铜[2-4,29-30]。本研究中,CopA1和copZ是铜抗性基因中上调幅度最大的基因(表S8),这表明铜的转运和结合可能是RCu6抵抗铜胁迫的重要途径。
硫是生物体内必不可少的元素,硫化合物具有重金属解毒的作用[31],多种硫代谢产物参与氧化应激条件下的细胞反应[32-33]。在本研究中,与硫代谢途径有关基因的差异表达(表S2)表明它们可能与铜抗性的发挥有重要关联,高铜胁迫高度诱导了编码亚硫酸盐蛋白合成的基因(cysH、cysI)、编码半胱氨酸合成的基因(cysK)以及编码谷胱甘肽合成酶基因(gshB)的表达。前期研究已经明确了硫参与微生物对重金属的解毒作用[34],例如Huang 等[6]利用转录组学技术确定了铜胁迫下Cupriavidus gilardiiCR3 中硫同化基因的上调;Liu 等[35]利用同化硫代谢菌来增强对重金属的耐受性。此外,硫同化途径还为谷胱甘肽和氨基酸的合成以及S-Fe 合成提供了硫酸盐。重金属胁迫和氧化环境下增加了谷胱甘肽的合成[36-38],谷胱甘肽已被证明在革兰氏细菌中能增强细菌对铜的抗性[39-40];它可以还原Cu2+形成Cu+-GSH 复合物,以稳定体内游离铜离子[41];而谷胱甘肽在螯合过程中可以螯合金属离子[42],从而增加细胞对铜的抵抗力。本研究中,编码谷胱甘肽合成酶基因(gshB)的上调表明菌株RCu6 抵抗铜毒性可能与谷胱甘肽合成相关。
L-组氨酸的生物合成存在于古细菌、细菌、真核生物和植物中。以前的研究已经揭示了L-组氨酸在细菌中的基本调节过程[43],以及L-组氨酸生物合成在真菌金属平衡和毒力中的作用[44]。然而,关于L-组氨酸在结合铜和增强细菌铜抗性方面的机制仍然不清楚。本研究发现,编码组氨酸生物合成途径的基因在铜胁迫条件下明显高表达(图6,表S5)。在RCu6 基因组中,我们发现了8 个组氨酸生物合成酶基因(HisG、HisI、HisA、HisF、HisD、HisC、HisH和HisB),所有8 个组氨酸生物合成基因都位于同一个操纵子上,研究表明这些基因的转录可能受到严格调控[43],过量的铜可能是诱导其转录的原因。无论是作为游离氨基酸还是作为蛋白质中的金属结合残基,组氨酸对结合的金属有很大的亲和力[42,44-47],因此组氨酸代谢可能对铜胁迫条件下的蛋白质生物合成以及细菌金属稳态至关重要。
本研究中发现硫铁簇的组装可能与菌株RCu6铜解毒相关,但在不同的生物体中Fe-S 簇的组装系统有所不同,例如RCu6 可能是由SUF 系统介导,而Cupriavidus gilardiiCR3 是由ISC 系统介导[6]。我 们的转录组数据表明,参与硫铁簇生物生成的基因(sufS、sufC、sufD、sufB)在铜胁迫下上调(表S8,见电子版附表或扫描首页OSID 码),这一结果也与Giner-Lamia 等[48]使用微阵列测序数据结果一致。
SUF 系统被认为可以对氧化应激和重金属应激的调节作出反应[49-50],SufE 和SufS 向SufB 提供硫,SufB蛋白可以形成硫铁原子簇,硫铁团簇在组装过程中可以参与氧化还原过程[51-52],而铜离子通过替换硫铁簇中的铁,减少了细胞中游离的铜离子[6],从而增强对铜的抗性能力。
本研究结果揭示了溶杆菌Lysobacter soliRCu6对铜的抗性能力和抗性机制。RCu6 对铜的抗性MIC 值为3.2 mmol·L-1;该菌基因组中携带有许多铜抗性同源基因(copLABMGA、cusABC、czcABC等);结合转录组学分析表明,RCu6 的铜抗性可能是一个细胞内多系统协同过程,包括铜稳态系统、硫代谢和硫铁簇合成途径以及组氨酸代谢途径。这些结果为揭示溶杆菌的铜抗性分子机制提供了新的见解,为开发农田土壤重金属污染的微生物修复技术提供了依据。
