不同浓度铅离子处理的鸡腿菇菌丝生长表现
2022-12-17张思琪冯馨仪杨财容罗智文祁伟亮刘松青
张思琪 冯馨仪 杨财容 罗智文 祁伟亮 刘松青
(成都师范学院化学与生命科学学院,四川 成都 611130)
鸡腿菇(Coprinus comatus)又名毛头鬼伞,隶属真菌门、层菌纲、伞菌目、鬼伞科、鬼伞属。鸡腿菇营养丰富,且可药用,深受广大消费者喜爱。由于食用菌栽培基质中的玉米芯、秸秆等在生长过程中会对土壤等栽培环境中的重金属产生一定的吸附和转化作用,而食用菌在生长发育过程吸收了这些原料中的重金属,导致食用菌产品会涉及重金属污染问题。此外,培养基质中所添加的石灰、过磷酸钙等辅料中的重金属通过食用菌的生长、转化,也会富集到食用菌体内。在众多重金属污染中,铅、砷、汞、镉和铝是食用菌中最常见的重金属元素[1]。
一般来说,在食用菌生长过程中,其菌丝的生长周期相对较长,子实体的生长周期较短,因而吸收重金属的主要途径是通过菌丝吸收而非子实体。菌丝会通过被动运输、主动运输的方式吸收栽培环境中的重金属,重金属离子通过这些方式穿过细胞膜,进入细胞内部干扰、破坏食用菌的生理活性[2]。王松华等[3]报道灵芝菌丝在不同镉(Cd)浓度处理下,菌丝鲜重及总糖、脯氨酸、还原糖含量与Cd浓度呈负相关,超氧化物歧化酶(SOD)活性与Cd 浓度呈正相关,过氧化物酶(POD)、过氧化氢酶(CAT)和谷胱甘肽还原酶(GR)活性均呈现先上升后下降的变化趋势。杨小红等[4]研究在不同Pb、Cd、Hg、As 浓度处理下的平菇菌丝生长状况和子实体产量,发现在较高浓度条件下,菌丝的生长状况较差,生长速率减慢,子实体产量也显著降低;且子实体富集重金属的情况与环境中的重金属浓度呈正相关关系。张琳[5]通过液体培养黄伞菌丝并且添加不同浓度的Mn2+、Pb2+,测定其各项生理指标及富集情况,结果表明当Pb2+和Mn2+浓度为700 mg/L 时,黄伞菌丝体内所含铅和锰的量达到峰值。卢娇娇[2]发现不同铜(Cu)浓度对平菇菌丝生长的影响不同,低浓度下菌丝生长速度加快,浓度持续增加时,能明显抑制菌丝生长;菌丝体内的抗氧化酶活性也发生变化。Liu 等[6]用重金属处理食用菌,探究其抗氧化机制,发现食用菌体内的一些酶会受到影响,刺激体内分泌抗氧化酶来响应。熊晓斌等[7]研究不同浓度的铅(Pb)、镉(Cd)、汞(Hg)、砷(As)等重金属对杏鲍菇和金针菇菌丝生长发育的影响,发现Pb、Cd、Hg、As 能够不同程度地抑制这两种菇的菌丝生长。
前人已研究重金属胁迫对部分食用菌菌丝及子实体可能产生的影响,包括菌丝或子实体富集重金属的能力及其生理变化等,不同食用菌菌丝在不同的重金属环境中的生长状况有所差别。食品安全国家标准GB7096—2014《食用菌及其制品》和食品安全国家标准GB2762—2012《食品中污染物限量》对食用菌及其制品的重金属铅(以Pb 计)的含量限定值为≤1.0 mg/kg。鸡腿菇作为人们日常喜爱的食用菌之一,具有非常大的经济价值。本文通过探究在不同Pb2+浓度下鸡腿菇菌丝的生长速率及各项生理指标的变化,为人工栽培鸡腿菇中的重金属胁迫响应研究及重金属控制提供参考。
1 材料与方法
1.1 试验材料
(1)菌种。鸡腿菇(特大9201)一级种,购于江苏省高邮市联谊食用菌场。
(2)主要试剂。硝酸铅、三氯乙酸、硫代巴比妥酸、磷酸氢二钠、磷酸二氢钠、甲硫氨酸、氮蓝四唑、EDTA-Na2、核黄素、创愈木酚、过氧化氢、高氯酸、硝酸。
(3)主要仪器和设备。高压蒸汽灭菌锅、恒温摇床、冷冻离心机、分光光度计、火焰原子吸收分光光度计。
1.2 试验方法
(1)鸡腿菇菌丝固体培养。配制PDA 固体培养基,高温灭菌30 min,待稍冷却后加入适量的已灭菌硝酸铅母液,使培养基中Pb2+的浓度分别为0 mg/mL(对照)、5 mg/mL、10 mg/mL、15 mg/mL、20 mg/mL 和25 mg/mL,注入无菌培养皿中制成固体培养基。在超净工作台下,将供试菌种接种于培养基中心位置。将培养皿置于25 ℃恒温培养箱内培养7 天,观察菌丝生长状况。每个处理3 次重复。
(2)鸡腿菇菌丝液体培养。配置PDA 液体培养基,高温灭菌30 min,冷却后分装至锥形瓶中,每瓶约100 mL。用已灭菌的直径5 mm 打孔器在已活化的鸡腿菇菌落中取菌种块,接种至锥形瓶中,置于160 r/min、25 ℃恒温摇床中培养5 天。在锥形瓶中添加标准硝酸铅溶液,使Pb2+浓度分别为0 mg/L(对照)、5 mg/L、10 mg/L、15 mg/L、20 mg/L和25 mg/L,每个处理3 次重复,置于25 ℃恒温摇床中继续培养2 天。培养完成后将其倒入离心管中,于4 ℃、10 000 r/min 下离心10 min,去上清液留取沉淀,然后将沉淀取出,用于制备粗酶液。
(3)菌丝生长速率测定。采用十字交叉法分别在1 天、7 天时测量菌落直径并记录,每个处理测定3 次,计算其平均值及菌丝生长速率。
(4)菌丝体铅离子含量测定。依据食品安全国家标准 GB 5009.12—2010《食品中铅的测定》方法测定。首先进行标准曲线的制作:吸取1.0 mg/L、5.0 mg/L、10.0 mg/L、20.0 mg/L 和40.0 mg/L的铅标准液各10 µL,按照浓度从低到高依次进样,测定其吸光值并制作标准曲线。然后采用湿法消解处理样品,并通过火焰原子分光光度计测定其吸光值,计算结果。
(5)菌丝体丙二醛含量、抗氧化酶活性测定。参照李合生[8]著的《植物生理生化实验原理和技术》测定菌丝中的丙二醛含量。超氧化物歧化酶(SOD)活性测定参照Beauchamp 等[9]的氮蓝四唑法;过氧化物酶(POD)活性测定参照Velikova 等[10]改进的愈创木酚法;过氧化氢酶(CAT)活性测定参照Aebi[11]的方法,测定240 nm 处的吸光值,计算其活性。
(6)数据分析及制图。数据采用 IBM SPSS statistics 20 软件进行分析,使用单因素方差分析法进行显著性分析,用Pearson 法进行指标间相关性分析,所有数值均为3 次平行测定的算术平均值。采用Orgin 8.5 软件制图。
2 结果与分析
2.1 不同Pb2+浓度处理的菌丝生长速率及长势
鸡腿菇菌丝经金属铅处理后,菌丝颜色以对照处理较白(图1),生长速率随培养基中Pb2+浓度增加呈现先上升后下降趋势,当Pb2+浓度为10 mg/L 时,生长速率达到峰值,显著快于其他处理(图2)。说明培养基中低浓度Pb2+对菌丝生长有促进作用,但随Pb2+浓度增加,鸡腿菇菌丝生长逐渐受到抑制,浓度越大,受抑制越明显。

图1 不同Pb2+浓度处理的鸡腿菇菌丝生长速率比较

图2 不同Pb2+浓度处理的鸡腿菇菌丝生长表现
2.2 不同Pb2+浓度胁迫下的菌丝体铅含量
制作的Pb2+标准曲线如图3 所示。

图3 Pb2+标准曲线
从图4 可知,在培养基中加入不同含量的Pb2+标准溶液后,鸡腿菇菌丝生长过程会吸收栽培环境中的Pb2+,导致菌丝体内铅含量逐渐增加,且其铅含量与环境中的Pb2+浓度呈正相关关系,当Pb2+浓度为25 mg/L 时,富集量达到最大值,为1.45 mg/kg,超过国家限量标准。而正是由于富集到的Pb2+越多,菌丝所受到的损伤就越大,遂使菌丝生长受到抑制。
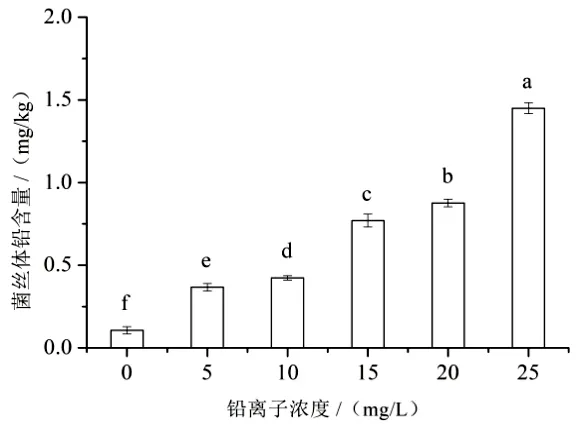
图4 鸡腿菇菌丝对Pb2+的富集程度
2.3 不同Pb2+浓度胁迫下的菌丝体丙二醛含量
丙二醛(MDA)含量能够反映机体内的抗氧化状况,如脂质过氧化速率及强度,也间接说明机体组织内的过氧化损伤程度[12]。由图5 可知,随着Pb2+浓度的增大,菌丝体内的MDA 含量先显著上升,Pb2+浓度为20 mg/L时,达最大值0.73 μmol/L,是对照处理的2.6 倍;而后随着Pb2+浓度的继续增大,则MDA 含量开始下降。
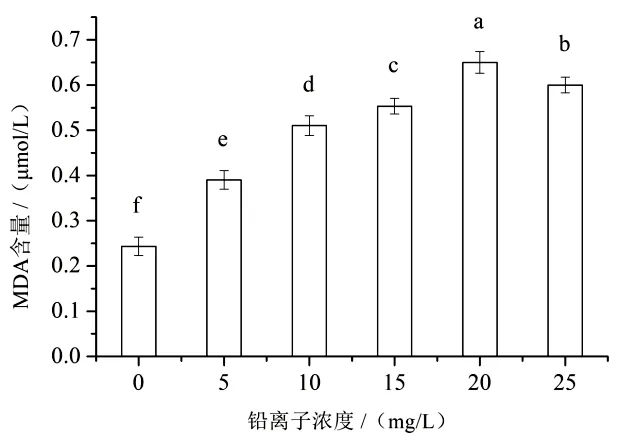
图5 鸡腿菇菌丝在不同Pb2+浓度下的丙二醛含量
2.4 不同Pb2+浓度胁迫下的菌丝体SOD 活性
当机体受到胁迫生成自由基时,其体内产生的超氧化物歧化酶(SOD)能将有害的自由基分解成对机体无害的O2和H2O,消除机体组织细胞的脂质过氧化状况,减小细胞受到的损害,是酶促防御系统不可或缺的组成部分[13]。如图6 所示,鸡腿菇菌丝在遭到Pb2+胁迫时,菌丝受损伤,进而激活菌丝的一系列防御反应。当Pb2+浓度在0~10 mg/L时,SOD 活性增加较缓慢;当Pb2+浓度在15~20 mg/L 时,SOD 活性显著提升,并在20 mg/L 浓度下达到最大值,说明在这一浓度区间,菌丝富集到更多的铅,导致受到的氧化损伤逐渐加大,使得菌丝体内抗氧化酶SOD大量增加以抵御胁迫。当Pb2+浓度在25 mg/L 时,菌丝体SOD 活性降低,这可能是由于胁迫浓度高,导致酶活性降低。

图6 鸡腿菇菌丝在不同Pb2+浓度下的SOD 活性
2.5 不同Pb2+浓度胁迫下的菌丝体POD 活性
生物体内含有多种还原剂,过氧化物酶(POD)能够利用这些还原剂作为电子受体,以H2O2为底物,清除机体因受外界胁迫而产生的过氧化物,进而使生物体受到的损害显著降低[14]。鸡腿菇菌丝体中的POD 活性随Pb2+浓度变化的趋势与SOD 相似,当Pb2+浓度为20 mg/L 时,POD 活性达到最大值(图7)。在菌丝受到逐渐加大的氧化损伤后,POD作为活性氧清除酶,也会增加其酶活来清除活性氧,减轻菌丝损伤;当Pb2+浓度过高时,POD 活性也会受到抑制。

图7 鸡腿菇菌丝在不同Pb2+浓度下的POD 活性
2.6 不同Pb2+浓度胁迫下的菌丝体CAT 活性
过氧化氢酶(CAT)和其他抗氧化酶类似,能够清除机体内因环境胁迫所产生的过氧化氢(H2O2),使机体内H2O2大大减少,恢复较为良好的状态[14]。鸡腿菇菌丝体中的CAT活性随着Pb2+浓度的增加呈先增加后降低趋势,各处理差异显著,当Pb2+浓度为10 mg/L时,CAT活性达到最大值(图8)。与SOD、POD 的变化情况不同,CAT 活性的峰值在Pb2+浓度为10 mg/L 时即出现,随后开始下降。其原因或许是因为CAT 是一种含有Fe3+的金属酶,Pb2+处理后可能会取代Fe3+,或因自由基的积累间接引起CAT 空间构型的改变,导致CAT 活性下降[15]。

图8 鸡腿菇菌丝在不同Pb2+浓度下的CAT 活性
2.7 不同Pb2+浓度胁迫下菌丝体不同指标的相关性分析
当受到外界Pb2+胁迫时,鸡腿菇菌丝体会产生形态、生理生化方面的变化,而这些变化之间具有一定的相关性。对受Pb2+胁迫后的鸡腿菇菌丝体生长、Pb2+富集程度,以及与氧化相关的指标进行相关性分析的结果(表1),菌丝生长速率与Pb2+富集量及SOD 活性呈显著负相关,这是由于Pb2+胁迫抑制了菌丝的生长,从而使得菌丝的防御性增强。菌丝体内的铅含量与丙二醛含量及SOD、POD 活性呈极显著正相关,这是因为菌丝富集到的Pb2+越多,受到的氧化损伤就越严重,从而会激活菌丝体内的抗氧化酶活性来进行防御。此外,丙二醛含量与SOD、POD、CAT 活性均呈现正相关关系,原因在于SOD、POD、CAT 是菌丝体内重要的活性氧清除酶,而丙二醛含量代表菌丝受到的氧化损伤程度,因此菌丝体在受氧化损伤大时需要激活这些防御酶来进行修复。

表1 Pb2+胁迫对鸡腿菇菌丝的不同指标相关性分析
3 小结与讨论
本研究结果显示,在5~10 mg/L 低浓度Pb2+胁迫下,鸡腿菇菌丝生长速率比对照快,当Pb2+浓度逐渐升高后,菌丝生长速率变慢,生长表现变差。菌丝体铅含量与培养基中Pb2+浓度呈正相关,25 mg/L 时达到最大值为1.45 mg/kg,超过国家限量标准。经不同浓度Pb2+胁迫处理,菌丝体MDA含量及SOD、POD、CAT 的活性随Pb2+浓度的增大呈先增后减趋势。
本研究测定了鸡腿菇在不同Pb2+浓度处理后菌丝生长速率以及生理指标的变化趋势,结果发现菌丝生长速率在低Pb2+浓度下得到促进,这一结果与胡清秀等[16]报道的低铜条件能促进杏鲍菇菌丝生长,表现菌丝粗壮、颜色洁白的结论相似。可能的原因是菌丝受到外界环境轻微刺激时,会提高自身的生活力来抵御逆境,表现出生长旺盛的现象;而刺激浓度继续提高则会抑制菌丝的生长。
在前人的研究中,随着Pb2+、Mn2+浓度的升高,均会增加黄伞菌丝体SOD、CAT、POD 的活性,在金属离子达到一定浓度时,这些抗氧化酶活性则会下降[5]。不同浓度重金属镉处理的灵芝菌丝[3]、不同浓度镉和铅处理的长根菇菌丝[17],其试验结果均表现菌丝体内的抗氧化酶活性随着金属离子浓度增加而先增加、达到最大值后开始下降,与本研究结果一致。
另有学者研究了真姬菇、双孢蘑菇、黑木耳、平菇、白灵菇5 种食用菌菌丝对环境中的铅、镉、汞、砷等重金属的富集情况,结果显示这5 种食用菌菌丝所含重金属的量均随着环境重金属浓度的增加呈现先增加,而后增速减慢,最终达到相对稳定的趋势[18]。本试验中随着外界Pb2+浓度的增加,鸡腿菇菌丝体内富集的金属铅含量也逐渐增加,但并未达到最大值,出现这种差异的可能原因是本试验所设Pb2+浓度最大只到25 mg/L,可能尚未达到菌丝所能承受的最大限度,未来可做进一步研究。
随着生活品位的不断提升,人们对食用菌的品质要求越来越高。目前关于包括鸡腿菇在内的食用菌栽培技术、开发应用等的研究已有很多,但有关食用菌对重金属的吸附机制方面的研究还较少。本研究对不同浓度铅离子处理的鸡腿菇菌丝体丙二醇含量、抗氧化酶系统和铅富集量等指标进行测定的结果,可为鸡腿菇重金属胁迫研究提供一些基础数据。研究中发现,当栽培环境中Pb2+浓度达到25 mg/L 时,鸡腿菇菌丝体的含铅量超出了国家限定标准,不符合食品安全要求。这一结果可为控制环境中重金属含量,保障食品安全提供重要参考。但本试验只选取了一个鸡腿菇品种为对象,而未对其他鸡腿菇品种开展相关试验,并且未涉及对子实体的影响相关研究,具有一定的局限性,尚需进一步深入研究。
