NRG2通过调控PI3K-AKT 通路促进创面修复相关巨噬细胞的M2 极化
2022-12-16彭友华李婧林张予晋周蓉高贵云
彭友华,李婧林,张予晋,周蓉,潘 意,高贵云
(1.湖南中医药大学第二附属医院皮肤科,湖南长沙,410005;2 .湖南航天医院皮肤科,湖南长沙,410221)
皮肤是人体表面积最大的器官,也是保护机体内部组织免受机械损伤、微生物感染和紫外线辐射等外部伤害的屏障。皮肤损伤后,过度的炎症反应、机体状况差、并发糖尿病等原因往往阻止创面的修复过程,导致创面愈合延迟甚至创面不愈[1],给患者心理和生理带来沉重的负担。神经调节因子(neuregulins,NRGs )是一个由4种基因编码的家族,是一种生长因子,具有协调细胞分化、轴突生长、髓鞘形成和突触形成等重要功能,还可通过直接调节神经元兴奋性、神经传递和突触可塑性,促进神经系统发育,对成人大脑的功能起着至关重要的作用[2],在多种心血管疾病中也扮演保护性和修复性生长因子的角色,在创面修复过程同样存在有利作用[3]。
已有研究证实,巨噬细胞是创面修复过程中调控炎症反应的关键细胞。循环单核细胞可迁移至创面损伤部位分化为巨噬细胞,促进血管生成、胶原沉积及细胞增殖,进而促进创面修复进展[4]。巨噬细胞的表型及功能还可通过创面微环境的变化发生改变,与中性粒细胞为主的其他细胞共同作用,完成创面修复过程[5]。本研究通过生物信息学分析获得巨噬细胞相关的创面修复关键因子,验证NRG2在创伤修复相关基因芯片的表达情况,进而通过细胞实验,探讨其在创面修复过程中发挥作用的具体机制,为创伤修复提供新的科学依据。
1.材料与方法
1.1 生物信息分析
在GEO 数据库中下载创伤修复相关基因芯片GSE157291,比较皮肤创面愈合早期和晚期伤口巨噬细胞转录组。检测平台为GPL18480。将normalized counts 标准化后的矩阵进行limma 差异分析,筛选出差异表达基因(log2FC >0.4,FDR<0.05)。
1.2 实验动物与细胞
6只SPF清洁级8~12周龄雄鼠,体重25~30g,购于湖南斯莱克景达公司。严格按照国家动物饲养规则饲养一周后进行实验。本研究经医院动物伦理委员会批准。
人THP-1细胞购于武汉普诺赛生命科技有限公司。
1.3 试剂
RPMI-1640培养基购自Gibco公司;CD80、CD86、CD163、CD206抗体购
自联科生物技术股份有限公司;cDNA反转录试剂盒、RT-qPCR 检测试剂盒购自赛默飞世尔科技有限公司;引物由上海生工生物工程有限公司设计并合成;BCA 试剂盒购于上海碧云天生物技术有限公司;ECL 发光液购于杭州弗德生物科技有限公司。
1.4 构建小鼠皮肤创面模型
在腹腔中注射10%的水合氯醛对小鼠进行麻醉,剃去小鼠背部的毛发,面积约为3cm×3cm 。使用无菌手术剪将去直径约为5mm 的圆形皮肤,伤口深至筋膜,观察造模后、造模后第3d、造模后第6d及造模后第13d 的创面情况,并将观察造模后、造模后第3d 定义为创面修复早期组,造模后第6d及造模后第13 d定义为创面修复晚期组。
1.5 细胞培养
5% CO2,37℃条件下,使用RPMI-1640(10%FBS0.05mM β‐mercaptoethanol1% P/S )培养基培养THP-1细胞。
1.7 数据分析
本实验数据由GraphPad 处理,最终数据由三次独立实验结果的平均值±标准差表示。统计显著性采用LSD-t 检验,P<0.05为具有统计学意义。
2 结果
2.1 创面修复相关GEO芯片筛选DEGs
基于数据集GSE157291,分析比较皮肤创面修复早期和晚期巨噬细胞的转录组,获得663个在创面修复晚期上调的DEGs及444个在创面修复晚期下调的DEGs,NRG2在创面修复晚期显著上调。见图1。

图1 创面修复相关GEO 芯片筛选DEGs A: DEGs 热图 B:基因芯片中NRG2 的表达水平
2.2 NRG2在创面修复过程中的表达水平
构建小鼠皮肤创面模型,观察小鼠皮肤外观形态。qPCR及western blot 检测NRG2在小鼠不同创面修复阶段中的表达水平。结果显示,创面修复早期,小鼠创面存在脓性分泌物,表皮修复不明显;创面修复晚期,小鼠创面无脓性分泌物,创面面积明显缩小,出现明显的愈合趋势。与创面修复早期比较,创面修复晚期小鼠NRG2 mRNA 及蛋白水平显著上调。见图2。
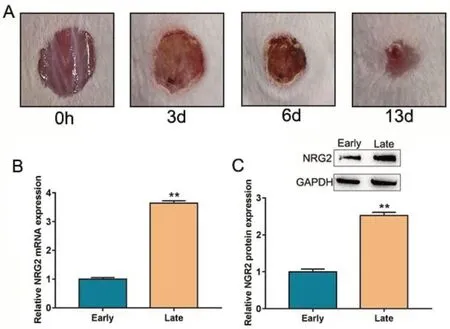
图2 NRG2 在创面修复过程中的表达水平 A:小鼠创面外观形态;B:qPCR 检测 NRG2 在小鼠中的表达水平;C:western blot 检测 NRG2 在小鼠中的表达水平
2.3 NRG2促进巨噬细胞M2极化
构建NRG2过表达质粒,将NRG2过表达质粒(NRG2组)及对照质粒(vector-NC 组转染至巨噬细胞,通过qPCR及western blot 检测转染效率。并通过流式细胞术实验检测NRG2对巨噬细胞极化的影响。结果显示,NRG2过表达质粒可在细胞中成功实现NRG2的过表达。见图3。与vector-NC 组相比,NRG2组的CD80、86标记的M1巨噬细胞百分率显著降低,CD163、CD206标记的M2巨噬细胞百分率显著升高,即NRG2促进巨噬细胞M2极化。见图4。
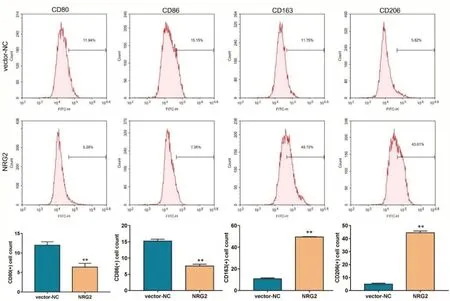
图4 NRG2 过表达对巨噬细胞 CD80(M1 型)、CD86(M1 型)、CD1636(M2 型)、CD206(M2 型)的影响
2.4 NRG2通过介导PI3K-AKT 通路促进巨噬细胞M2极化
将NRG2过表达质粒(NRG2组)及对照质粒(vector-NC 组)转染至巨噬细胞,并使用PI3KAKT 抑制剂LY294002进行干预。使用Western blot 法检测p-PI3K、PI3K、p-AKT、AKT 蛋白表达水平;并通过流式细胞术实验检测巨噬细胞表型。结果显示,与vector-NChibitor-NC 组相比,NRG2组细胞p-PI3K、p-AKT 表达水平及,CD163、CD206标记的M2巨噬细胞百分率均显著上调,CD80、86标记的M1巨噬细胞百分率显著降低。PI3K-AKT 抑制剂LY294002抵消了NRG2的促进作用,即NRG2通过介导PI3K-AKT 通路促进巨噬细胞M2极化。见图5、6。
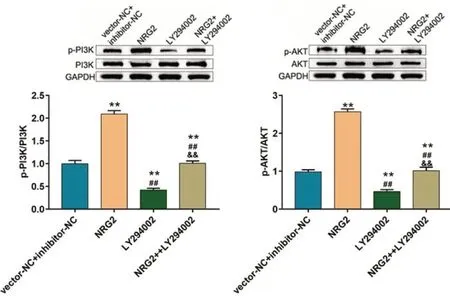
图5 NRG2 调控 PI3K/PI3K-AKT 通路
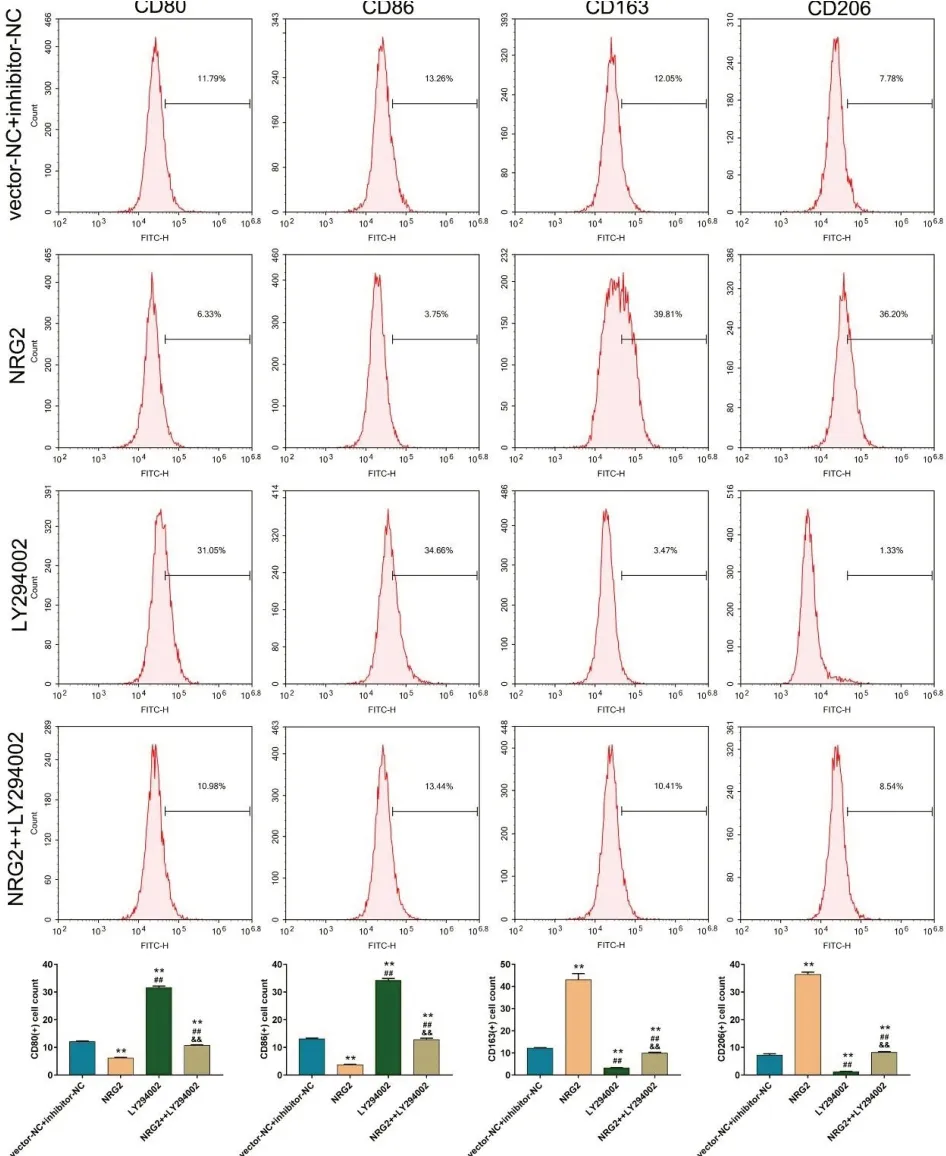
图6 NRG2 通过介导PI3K-AKT 通路促进巨噬细胞M2 极化
3 结论
NRGs是由四个亚型组成的表皮生长因子(epidremai growth factor,EGF )家族,在人体各组织中广泛表达。研究发现,NRGs 可通过旁分泌、近分泌等方式激活下游通路,参与脊髓、心肌等组织受损的修复过程[3,6],在皮肤创面修复过程中,也发挥重要作用[7]。创面修复是一个涉及细胞、细胞因子及细胞外基质相互作用的复杂动态过程,在影响创面修复的免疫细胞中,巨噬细胞被认为是促进炎症增殖阶段的关键因素,通过调控炎症反应、细胞增殖和迁移以及血管的生成过程对伤口修复至关重要[8]。因此,本研究通过生物信息分析与创面修复相关的巨噬细胞中的差异表达基因,发现NRGs家族中的NRG2表达存在显著差异,因此,选择NRG2进行后续研究,以期探究其在创面修复中发挥作用的具体机制。
创面修复相关的巨噬细胞可分为M1型巨噬细胞和M2型巨噬细胞,M1型巨噬细胞可通过分泌炎症因子促进过度的炎症反应,阻碍创面修复进展,而M2型巨噬细胞通过分泌抑炎因子以抑制创面修复过程中的炎症反应,且其还可以分泌生长因子,利于创面修复进程[9]。本研究通过构建NRG2过表达质粒并转染至THP-1细胞,流式细胞术检测巨噬细胞极化情况,发现NRG2能够显著促进巨噬细胞的M2型极化,证实NRG2通过调控巨噬细胞M2极化在创伤修复中发挥作用。研究发现,PⅠ3K/Akt 通路可调节巨噬细胞的存活、迁移和增殖,还可协调巨噬细胞对不同代谢和炎症信号的反应[10],此外,PI3K/AKT 通路在调节巨噬细胞M2极化方面也发挥重要作用[11]。而NRG激活后可进一步激活PI3K,进而介导PⅠ3K/Akt 通路[12]。本实验将转染NRG2过表达质粒的THP-1细胞与PI3K-AKT抑制剂LY294002共同干预,实验结果与上述研究一致。证实了NRG2通过介导PI3K-AKT 通路调控巨噬细胞M2极化,在创伤修复过程中发挥作用。
综上所述,NRG2可通过介导PI3K-AKT 通路调控巨噬细胞M2极化,进而促进创面修复过程。
