基于流式细胞术对27种石斛的倍性鉴定和基因组大小分析
2022-12-16熊文艳刘云礼陈军文张敬丽
熊文艳,普 冉,刘云礼,陈军文,张敬丽*
基于流式细胞术对27种石斛的倍性鉴定和基因组大小分析
熊文艳1,2,普 冉1,2,刘云礼1,2,陈军文2,3,张敬丽1,2*
1. 云南农业大学园林园艺学院,云南昆明 650201;2. 西南中药材种质创新与利用国家地方联合工程研究中心,云南昆明 650201;3. 云南农业大学农学与生物技术学院,云南昆明 650201
石斛属()是兰科(Orchidaceae)一个大属,我国植物志记载有76种,主要分布于我国海南省、西南和两广地区,石斛属植物种类繁多,花朵鲜艳,颜色丰富,花期长,具有极高观赏价值。目前,石斛属植物野外资源濒临灭绝,面临自交异交不亲和、观赏种数量少、缺乏优良育种亲本的困境,为保护现有良种、培育新物种及为建立基因分子库奠定基础,以石斛属植物幼嫩叶片为材料,采用MGb解离液制备细胞核悬浮液,利用玉米(, ‘B73’)和番茄()作为内标,建立了基于流式细胞术测定石斛倍性和基因组大小的方法,用流式细胞仪对兰科(Orchidaceae)石斛属()27种石斛属植物的倍性和基因组大小进行测定。研究表明:以玉米为内标区分度较好,且没有重叠峰,峰型清晰集中,对27种石斛属植物的倍性和基因组大小能准确估测;27种石斛中二倍体19种,三倍体5种,四倍体3种;27种石斛分属于8组,分别是禾叶组1种,顶叶组2种,石斛组16种,瘦轴组1种,叉唇组1种,距囊组1种,草叶组4种,基肿组1种,各个组间基因组大小不同,各组内基因组大小也存在差异;27种石斛预估基因组大小在0.98~2.41 pg之间,预估的平均基因组大小为1.44 pg,27种石斛的基因组大小均大于0.7 pg,主要集中在0.7~1.4 pg之间,其中草石斛的预估基因组最大,梳唇石斛最小,二者的预估基因组大小相差近2.5倍;27种石斛的基因组可归为极小基因组或小基因组。该研究为石斛属植物的人工杂交授粉配置、杂交育种、多倍体诱导提供便利,同时,为石斛属植物基因分子库的建立以及石斛属植物基因组学、遗传变异、进化生物学与全基因组测序等研究奠定基础。
流式细胞术;石斛;倍性;基因组大小
兰科(Orchidaceae)石斛属()植物,全属有15 000多个原生种,分布横跨亚洲至大洋洲的热带及亚热带地区,我国植物志记载有原生种76种,主要分布在我国海南省和西南、两广地区[1]。石斛属植物种类繁多,花朵鲜艳,颜色丰富,花期长,具有极高观赏价值[2]。近年来,由于石斛属植物对生境要求及其严格,自然条件下种子萌发率极低,加之繁殖速度过慢,且野生资源采挖现象严重,石斛野外资源濒临灭绝,被列为《国家重点保护野生植物名录》中的国家二级保护野生植物,并被列入《濒危野生动植物种国际贸易公约》(CITES)附录Ⅱ中,大部分种也被列入世界自然保护联盟(IUCN)物种红色名录中[3],因此保护现有物种及繁育新物种迫在眉睫。
龚建英等[4]研究发现石斛属植物中有些种自交、异交都不亲和,且不同种植物之间杂交,坐果率、膨大率和萌发率以及单果质量会出现不同变异情况,推测出石斛种间杂交亲和性可能与亲本材料亲缘关系的远近、植物染色体数量等相关。植物细胞核的重要组成成分染色体是基因的主要载体,染色体数目的变化常导致植物形态、生理、生化代谢等诸多遗传特性的变异。其中在杂交育种中,育种亲本植物的染色体信息研究是进行杂交的基础,对杂交育种有着非常重要的指导作用,廖道龙等[2]利用流式细胞术结合形态学鉴定出21种石斛属植物为二倍体,但是也发现染色体比较复杂,倍性同样具有多样性;黄少玲[5]利用流式细胞术鉴定了20多种国产原生种的染色体倍性,同时用染色体压片的方法进行了结果验证,表明2种方法处理得到的结果差异不大,为开展石斛属植物的倍性鉴定提供科学依据。
生物体的单倍体基因组所含的DNA含量被称为基因组大小或C值(chromatin-value)[6]。一般以重量为度量计算基因组大小,单位是pg,也可以以核苷酸碱基对的数量表示,1 pg DNA的量约等于978 Mb碱基对的量[7]。通过比较参照植物荧光强度,利用公式计算出待测样品DNA含量的方法就是流式细胞术(flow cytometry, FCM)测定基因组大小方法。测定植物的基因组大小,既可以为其基因组学研究和遗传进化生物学研究提供理论基础,也为生态学和细胞生物学的研究提供参考[8]。张桂芳等[9]用流式细胞术进行了铁皮石斛核DNA检测,筛选出了较为快速、准确的利用流式细胞仪检测铁皮石斛倍性的方法以及最佳解离液,为后续石斛属植物的流式细胞检测奠定了基础。流式细胞仪检测不受取材时间限制,已广泛应用于细胞学、遗传学、细胞周期分析及植物基因组大小估算等研究中,迄今在莲瓣兰()和墨兰()[10]、蝴蝶兰()[11]、蕙兰()[12]等兰科植物和火龙果()[13]、野草莓(L.)[14]、橡胶()[15]等植物以及茉莉花()[16]、鸢尾属()植物[17]、桂花()[18]等观赏花木中运用流式细胞术鉴定倍性并均证实了染色体倍性的可靠性。
综上所述,目前有关石斛倍性研究、染色体核型分析、DNA含量的测定等细胞遗传学方面的研究资料还较少,相关研究也只有零星报道。细胞遗传学方面的研究,包括染色体的数目、倍性、形态、大小等,对于植物遗传改良和杂交育种工作具有重要意义,亟需进一步研究探索。本研究采用流式细胞术对27种石斛属植物的倍性和基因组大小进行研究,一方面为石斛属植物的人工杂交授粉配置、杂交育种、倍性育种等提供便利,另一方面为石斛属植物基因分子库的建立,及石斛属植物基因组学、遗传变异、进化生物学与全基因组测序等研究奠定基础。
1 材料与方法
1.1 材料
所用石斛材料为刚萌发的新生嫩叶或嫩芽,采集地点见表1,其中凭证标本存放于云南农业大学园林园艺学院标本室。以二倍体的玉米()‘B73’和番茄()为内参,基因组大小分别为2.3 Gb和900 Mb,内参采集于中国科学院昆明植物研究所。
1.2 方法
1.2.1 细胞悬浮液制备 参考李春牛等[16]的方法,将样品置于解离液中,将组织用锋利的刀片迅速垂直切碎,连同解离液在冰上静置10 min,然后用滤网过滤,即得到细胞核悬浮液。将得到的细胞核悬浮液置于冰上避光染色1 h。

表1 本研究材料来源
注:–表示未评估;VU表示易危;NT表示近危;EN表示濒危;CR表示极危;LC表示无危。
Note: – means not assessment; VU means vulnerable; NT means nearly unstoppable; EN means endangered; CR means critically endangered; LC means no danger.
1.2.2 流式细胞仪检测 参考李春牛等[16]的方法将待测样品的悬液和内参样品的悬液按适当比例混合进行上机检测。使用Modifit 3.0分析软件作图分析。
1.2.3 基因组大小计算 根据计算公式:待测样品DNA含量或倍性水平=参照样本核DNA含量或倍性水平×参照样本G0或G1峰荧光值/待测样本G0或G0峰荧光值[19]。
2 结果与分析
2.1 27种石斛属植物的倍性分析
以玉米为内参,采用内参法对27种石斛属植物DNA含量进行测定,以二倍体铁皮石斛为对照,流式细胞仪测得二倍体铁皮石斛染色体的荧光强度值为30.5。27个石斛属植物中,18种荧光强度值在24.05~36.23之间,呈0.78~1.18倍二倍体的荧光强度,与对照相比为二倍体(图1A);有5种荧光强度值在43.60~56.06之间,呈现为1.43~1.83倍二倍体的荧光强度,与对照相比为三倍体(图1B);3种荧光强度在56.32~60.23之间,呈现为1.83~1.97倍二倍体的荧光强度,与对照相比为四倍体(图1C)。综上所述,27种石斛属植物中,除二倍体铁皮石斛外,共有18种为二倍体,5种为三倍体,3种为四倍体(表2)。
2.2 27种石斛属植物的预估基因组大小分析
27种石斛预估基因组大小在0.98~2.41 pg(表2),预估的平均基因组大小为1.44 pg。其中预估基因组大小在0~0.7 pg的石斛为0,0.7~ 1.4 pg有17种,1.4~3.5 pg有10种。27种石斛的基因组大小均大于0.7 pg,主要集中在0.7~1.4 pg,其次在1.4~3.5 pg,其中草石斛的预估基因组最大,梳唇石斛最小,二者的预估基因组大小相差近2.5倍。根据植物基因组IC值大小分类,IC< 0.7 pg的为超小基因组,IC≥0.7 pg和IC≤1.4 pg的基因组划分为极小基因组,IC>1.4 pg和IC≤3.5 pg的基因组划分为小基因组的分类标准[20],这27种石斛的基因组可归为极小基因组或小基因组。
27种石斛分属于8组,分别是禾叶组1种,顶叶组2种,石斛组16种,瘦轴组1种,叉唇组1种,距囊组1种,草叶组4种,基肿组1种,组间预估基因组大小不同。石斛组的16种预估基因组大小为1.18~2.13 pg,大小为0.7~1.4 pg的有9种,1.4~3.5 pg的有7种,预估的平均基因组大小为1.49 pg。草叶组的4种预估基因组大小为0.98~2.41 pg,其中大小为0.7~1.4 pg有2种,1.4~3.5 pg有2种,预估的平均基因组大小为1.67 pg。瘦轴组的重唇石斛和基肿组的针叶石斛基因组大小较为接近,禾叶组的竹枝石斛与顶叶组的2种石斛基因组大小也比较接近。
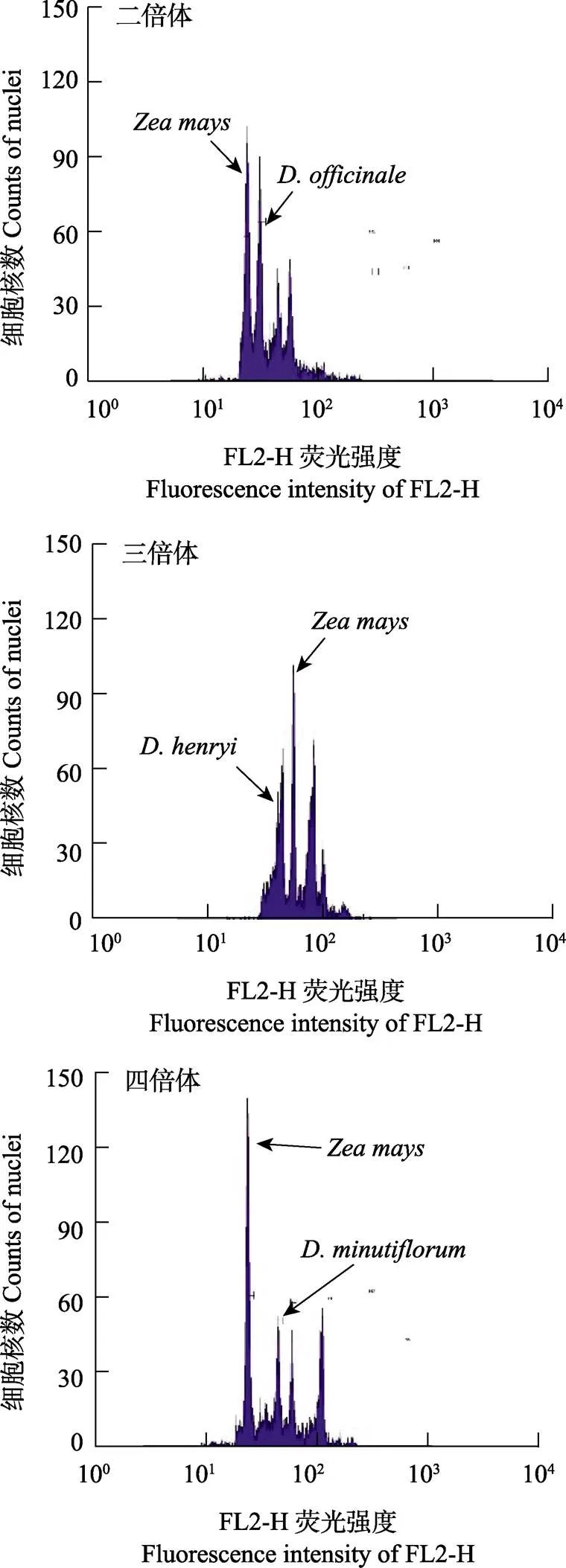
图1 部分石斛的倍性检测结果

表2 27种石斛倍性及基因组大小
组间预估平均基因组大小不同,8组内石斛预估基因组大小也存在差异。草叶组内的4种石斛基因组大小(0.98~2.41 pg)差异最大,约为2.5倍;石斛组内的16种石斛基因组大小(1.18~ 2.13 pg)差异较大,约为1.8倍,而顶叶组的2种石斛基因组大小较为接近(1.01~1.06 pg),差异最小。
3 讨论
流式细胞术测定植物倍性和基因组大小的要求是有一个已知的基因组作为参考标准,内标可以防止因仪器漂移或染色不均匀而导致的误差[17]。在选择内标时,本研究全部样品选择了与待测样品不同属性的、细胞核大小相近的、符合作为内参条件的玉米作为内标,排除了种之间因为内标不一样造成的误差,使变异系数控制在5%以内,更精确地分析鉴定了石斛倍性。
倍性分析是研究遗传进化、系统分类以及开展杂交育种工作的基础[21]。植物倍性鉴定一是通过染色体计数的方法鉴定倍性,该方法对于细胞核较小或染色体多的植物很难得到准确的结果,并且试验操作技术要求较高,费时费工;二是从外形特征、气孔大小、保卫细胞数目等方面间接鉴定,该方法受材料所处的生理状态影响较大,准确性不高,很难区分非整倍体和嵌合体[22]。流式细胞术不受植物取材部位和细胞所处时期的限制,制样简单,灵敏度、分辨率及准确性较高,数据的可重复性较好,测试速度快,适于样品较多的倍性检测分析[21],目前流式细胞术已成为鉴定植物倍性和基因组大小的首选方法,但是对于同一种植物而言,采用不同的参照标品、使用不同解离液、不同的取材部位、染色时间和方法、流式细胞仪和画图软件的不同型号,基因组大小测定值都会有所不同[23]。本研究中经流式细胞术鉴定玫瑰石斛、重唇石斛、聚石斛、细茎石斛、金钗石斛均为二倍体,细叶石斛为四倍体,该结果与前人的研究结果一致;流苏石斛本研究中鉴定为三倍体,与黄少玲[5]的流式细胞术鉴定结果一致,但传统染色体计数法鉴定流苏石斛为二倍体,出现倍性鉴定结果不一致,原因可能是流苏石斛相比较其他石斛具有较多的染色体数目,在染色体计数法中用根尖制片的过程中部分根尖细胞破碎,导致部分染色体丢失,出现了倍性不一致的现象,所以相比传统方法,流式细胞检测结果更加准确。
张文驹等[24]研究表明,山茶属植物从起源点向北扩张的过程中为了适应寒冷气候逐渐从二倍体向六倍体进化,与典型的多倍化增强植物的耐寒机制相符。本研究中27种石斛属植物大部分为二倍体,少数出现三倍体和四倍体,是否与多倍化现象增强了植物的耐寒性机制相符,或者是为了适应环境变化产生的协调进化等,这些在石斛属植物中有待进一步研究。
染色体片段的扩增和缺失可能导致基因组大小的变化[25]。本研究中铁皮石斛预估基因组大小为1.15 GB,而已经公布的铁皮石斛基因组大小为1.35 GB[26],存在差异首先可能是所取的材料来源于不同的植物群体且自身发生了变异,其次也有可能是实验操作过程中的操作技术和操作条件等存在差异,KNIGHT等[27]研究也表明植物DNA含量与物种所处的海拔、纬度、温度、降水等环境有关,所以在检测过程中应该充分考虑试验材料、试验条件等问题,尽量把误差降到最低,同时应该注意考虑不同居群间的变异和差异,加强居群物种水平上的基因组大小的评估。
本研究中聚石斛(1.01 pg)和勐海石斛(1.01 pg)基因组大小相同,2种石斛虽然植株矮小,但是在花、叶、茎等方面差异极其明显,聚石斛花为黄色,勐海石斛花朵玲珑小巧,为白绿色;针叶石斛(1.20 pg)、铁皮石斛(1.21 pg)、细茎石斛(1.22 pg)、玫瑰石斛(1.22 pg)基因组大小相近或相同,但是在株高、茎的类型、叶型、大小、花色等方面有较明显的差异;束花石斛(1.30 pg)、西畴石斛(1.31 pg)基因组大小较为相近,但是束花石斛花期在9—10月,花为黄色,西畴石斛花期7月,花为白色,花色差异较大。这与THOMAS[28]和杜文文等[29]的研究结果一致,表明27种石斛属植物中,基因组大小与植物形态没有相关性。
石斛属植物除了部分具有药用价值的铁皮石斛[30]、霍山石斛()[31]等在药理作用方面研究较多外,在倍性育种等方面的研究较少。叶天文等[32]在海南油茶中研究表明天然多倍体经过自然界的长期驯化,染色体组较为稳定,特别是在偶数倍多倍体中育性正常;梁森林等[33]在四倍体枇杷中采用离体萌发法和人工杂交分析其育性表明与二倍体没有差异。本研究中叠鞘石斛、流苏石斛鉴定为三倍体,在黄捷[34]的研究中表明,这2种石斛自交亲和,存在一定的自交可育性,而三倍体叉唇石斛、四倍体细叶石斛和单葶草石斛自交不亲和,没有自交可育性。本研究仅对27种石斛进行了倍性鉴定及基因组大小分析,基于细胞学方面的核型分析、可育性等方面有待进一步研究。
目前,兰科植物的细胞组学、分子生物学、杂交育种、新品种选育等的研究多集中在蝴蝶兰属()等传统洋兰品种和部分国兰种中,石斛属植物的研究较少[35]。自小兰屿蝴蝶兰()[36]全基因组公布后,相继又公布了铁皮石斛[26]、深圳拟兰()[37]、天麻()[38]、鼓槌石斛()[39]的全基因组。石斛属作为兰科植物的一个大属,原生种类较多,花色丰富多样,石斛属植物全基因组的破译及基因组学的研究为揭示石斛属植物的起源、进化及培育新物种并为其分子机理提供研究基础。本研究采用流式细胞术对27种石斛属植物的倍性和基因组大小进行研究,不仅为原生石斛的全基因组测序工作的预算评估提供基础,也为该属的细胞遗传学、分子生物学、基因组学等提供理论指导,对有效开展人工授粉杂交、染色体工程和转基因等育种方法,培育观赏性状优良、抗寒性较强的优良石斛属植物新品种具有十分重要的意义。
[1] 马 良, 陈松泉, 庄莉彬. 35种石斛兰观赏价值评价[J]. 亚热带植物科学, 2019, 48(3): 269-273.
MA L, CHEN S Q, ZHUANG L B. Evaluation on ornamental characters of 35 species of[J]. Subtropical Plant Science, 2019, 48(3): 269-273. (in Chinese)
[2] 廖道龙, 谢 利, 曾瑞珍, 黎扬辉, 易懋升, 张志胜. 石斛属植物倍性与形态学性状的相关性研究[J]. 西北植物学报, 2012, 32(10): 2023-2029.
LIAO D L, XIE L, ZENG R Z, LI Y H, YI M S, ZHANG Z S. Relationship between chromosome ploidy and morphology characters in[J]. Acta Botanica Boreali- Occidentalia Sinica, 2012, 32(10): 2023-2029. (in Chinese)
[3] 刘江枫. 喇叭唇石斛的花部特征与繁育系统[J]. 亚热带农业研究, 2021, 17(4): 264-268.
LIU J F. Floral features and breeding system of[J]. Subtropical Agriculture Research, 2021, 17(4): 264-268. (in Chinese)
[4] 龚建英, 龙定建, 孙利娜, 杜 铃, 廖美兰, 黄 兴. 4种石斛种间杂交、自交亲和性及蒴果生长动态[J]. 江苏农业科学, 2014, 42(7): 190-192.
GONG J Y, LONG D J, SUN L N, DU L, LIAO M L, HUANG X. Interspecific hybridization, self compatibility and capsule growth dynamics of 4species[J], Jiangsu Agricultural Sciences, 2014, 42(7): 190-192. (in Chinese)
[5] 黄少玲. 春石斛兰品种的倍性鉴定及RAPD分子遗传图谱的构建[D]. 武汉: 华中农业大学, 2007.
HUANG S L. Identitification ploidy ofand construction of RAPD molecular genetic maps[D]. Wuhan: Huazhong Agricultural University, 2007. (in Chinese)
[6] BENNETT M D, BHANDOL P, LEITCH L J. Nuclear DNA amounts in angiosperms and their modern uses-807 new estimates[J]. Annals Botany, 2000, 86(4): 859-909.
[7] DOLEZEL J, BARTO J S, VOGLMAYR H, GREILHUBER J. Nuclear DNA content and genome size of trout and human[J]. Cytometry, Part A, 2003, 51(2): 127-128.
[8] LOUREIRO J, TRAVNICEK P, RAUCHOVA J, URFUS T, VIT P, STECH M, CASTRO S, SUDA J. The use of flow cytometry in the biosystematics, ecology and population biology of homoploid plants[J]. Preslia, 2010, 82: 3-21.
[9] 张桂芳, 王 艳, 闫小巧, 李一凡, 邵晓茹, 赖小平. 流式细胞仪检测铁皮石斛核DNA初探[J]. 现代中药研究与实践, 2017, 31(1): 16-19.
ZHANG G F, WANG Y, YAN X Q, LI Y F, SHAO X R, LAI X P. Study on flow cytometer for detecting nuclear DNA contents in[J]. Research and Practice on Chinese Medicines, 2017, 31(1): 16-19. (in Chinese)
[10] 林 瀚, 韩晓文, 兰思仁, 马晓开. 基于流式细胞技术两种兰属植物基因组大小的测定[J]. 森林与环境学报, 2019, 39(6): 616-620.
LIN H, HAN X W, LAN S R, MA X K. Estimation of genome size of twoby flow cytometry[J]. Journal of Forest and Environment, 2019, 39(6): 616-620. (in Chinese)
[11] LEE Y I, TSENG Y, LEE Y C, CHUNG M C. Chromosome constitution and nuclear DNA content ofhybrids[J]. Scientia Horticulturae, 2020, 262: 89-109.
[12] 汪琛颖, 张 坤, 梁 芳, 崔 波, 马润林. 蕙兰(Rolfe)基因组大小测定[J]. 北方园艺, 2015(11): 86-90.
WANG C Y, ZHANG K, LIANG F, CUI B, MA R L. Estimation of genome size ofRolfe[J]. Northern Horticulture, 2015(11): 86-90. (in Chinese)
[13] 黄黎芳, 武志江, 梁桂东, 陆贵锋, 黄凤珠, 刘朝安, 邓海燕. 利用流式细胞术对29份火龙果种质染色体的倍性鉴定[J]. 热带作物学报, 2021, 42(4): 966-970.
HUANG L F, WU Z J, LIANG G D, LU G F, HUANG F Z, LIU C A, DENG H Y. Ploidy determination of 29germplasms using flow cytometry[J].Chinese Journal of Tropical Crops, 2021, 42(4): 966-970. (in Chinese)
[14] 陈丙义, 李金凤, 霍恒志, 万春雁, 章 镇, 乔玉山, 糜 林. 6种野生草莓基因组大小估算[J]. 果树学报, 2015, 32(1): 51-56.
CHEN B Y, LI J F, HUO H Z, WAN C Y, ZHANG Z, QIAO Y S, MI L. Estimation of genome size in six wild strawberry species[J]. Journal of Fruit Science, 2015, 32(1): 51-56. (in Chinese)
[15] 张源源, 濮寿琴, 胡彦师, 方家林, 黄 肖, 李维国, 黄华孙. 橡胶树种质资源的倍性鉴定[J]. 热带作物学报, 2020, 41(3): 457-463.
ZHANG Y Y, PU S Q, HU Y S, FANG J L, HUANG X, LI W G, HUANG H S. Ploidy identification of germplasm resources in(Willd. ex A. Juss.) Müll. Arg.[J]. Chinese Journal of Tropical Crops, 2020, 41(3): 457-463. (in Chinese)
[16] 李春牛, 李先民, 黄展文, 卢家仕, 李 琴, 黄昌艳, 卜朝阳. 利用流式细胞术鉴定茉莉花基因组大小和染色体倍性[J]. 热带作物学报, 2021, 42(5): 1231-1236.
LI C N, LI X M, HUANG Z W, LU J S, LI Q, HUANG C Y, BU Z Y. Genome size estimation and ploidy identification ofby flow cytometry[J]. Chinese Journal of Tropical Crops, 2021, 42(5): 1231-1236. (in Chinese)
[17] 林 峰, 肖月娥, 周翔宇, 唐 颖, 高步红. 25份鸢尾属植物基因组DNA C值的流式测定[J]. 草地学报, 2018, 4(26): 985-990.
LING F, XIAO Y E, ZHOU X Y, TANG Y, GAO B H. Estimation of genomic C value of 25 samples ofplants by flow cytometry[J]. Acta Agrestia Sinica, 2018, 4(26): 985-990. (in Chinese)
[18] 段一凡, 李 岚, 杨欣欣, 王贤荣, 张 敏, 张 成, 柴子涵. 桂花及其近缘种倍性和基因组大小分析[J]. 南京林业大学学报(自然科学版), 2021, 45(5): 47-52.
DUAN Y F, LI L, YANG X X, WANG X R, ZHANG M, ZHANG C, CHAI Z H. Study on ploidy and genome sizes ofand its related species[J]. Journal of Nanjing Forestry University (Natural Science Edition), 2021, 45(5): 47-52. (in Chinese)
[19] DOLEZELJ. Flow cytometry analysis of nuclear DNA content in higher plants[J]. Phytochemical Analysis, 1991, 2(4): 143-154.
[20] SOLTIS D E, SOLTIS P S, BENNETT M D. Evolution of genome size in the angiosperms[J]. American Journal of Botany, 2003, 90(11): 1596-1603.
[21] 吕 顺, 任 毅, 王 芳, 胡桂兵, 黄秉智, 刘文清, 何建齐, 刘建平, 曾莉莎, 周建坤, 麦景郁, 张珂恒. 利用流式细胞术快速鉴定169份香蕉种质资源的染色体倍性[J]. 果树学报, 2018, 35(6): 668-684.
LU S, REN Y, WANG F, HU G B, HUANG B Z, LIU W Q, HE J Q, LIU J P, ZENG L S, ZHOU J K, MAI J Y, ZHANG K H. Ploidy identification of 169germplasms by flow cytometry[J]. Journal of Fruit Science, 2018, 35(6): 668-684. (in Chinese)
[22] 弓 娜, 田新民, 周香艳, 刘建全. 流式细胞术在植物学研究中的应用——检测植物核DNA含量和倍性水平[J]. 中国农学通报, 2011, 27(9): 21-27.
GONG N, TIAN X M, ZHOU X Y, LIU J Q. Applications of flow cytometry in plant research——analysis of nuclear DNA content and ploidy level in plant cells[J]. Chinese Agricultural Science Bulletin, 2011, 27(9): 21-27. (in Chinese)
[23] 吴丽萍, 唐 岩, 李颖岳, 尹丹妮, 庞晓明. 枣和酸枣基因组大小测定[J]. 北京林业大学学报, 2013, 35(3): 77-83.
WU L P, TANG Y, LI Y Y, YIN D N, PANG X M. Estimation of genome size ofand[J]. Journal of Beijing Forestry University, 2013, 35(3): 77-83. (in Chinese)
[24] 张文驹, 闵天禄. 山茶属的细胞地理学研究[J]. 云南植物研究, 1999, 21(2): 56-68.
ZHANG W J, MIN T L. A cytogeological study of genus[J]. Acta Botanica Yunnanica, 1999, 21(2): 56-68. (in Chinese)
[25] ARUMUGANATHAN K, EARLE D. Nuclear DNA content of some important plant species[J]. Plant Molecular Biology Reporter, 1991, 9(3): 208-218.
[26] LIANG Y, XIAO W, HUI, L, YANG T, LIAN J, YANG R, HAO S. The genome ofilluminates the biology of the important traditional chinese orchid herb[J]. Molecular Plant, 2015, 8(6): 922-934.
[27] KNIGHT C A, MOLINARI N A, PETROY D A. The large genome constraint hypothesis: evolution, ecology and phenotype[J]. Annal of Botany, 2005, 95(1): 177-190.
[28] THOMAS C A. The genetic organization of chromosomes[J]. Annual Review of Geneics, 1971, 5(1): 237-256.
[29] 杜文文, 王祥宁, 段 青, 贾文杰, 马璐琳, 崔光芬, 王继华. 34种秋海棠基因组大小比较与分析[J]. 植物遗传资源学报, 2018, 19(2): 370-376.
DU W W, WANG X N, DUAN Q, JIA W J, MA L L, CUI G F, WANG J H. Genome size comparison in 34species[J]. Journal of Plant Genetic Resources, 2018, 19(2): 370-376. (in Chinese)
[30] YANG J, CHEN H, NIE Q, HUANG X, NIE S.polysaccharide ameliorates the liver metabolism disorders of type II diabetic rats[J]. International Journal of Biological Macromolecules, 2020, 164: 1939-1948.
[31] 侯 燕, 王林元, 乐 娜, 王玉杰, 李 伟, 刘金莲, 杨 涛, 张建军. 霍山石斛不同提取物对肾阴虚证、肾阳虚证小鼠抗疲劳作用及物质基础研究[J]. 中华中医药杂志, 2021, 36(2): 1039-1044.
HOU Y, WANG L Y, YUE N, WANG Y J, LI W, LIU J L, YANG T, ZHANG J J. Study on the anti-fatigue effect and material basis of different extracts ofon mice with kidney-yin deficiency syndrome and kidney-yang deficiency syndrome[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2021, 36(2): 1039-1044. (in Chinese)
[32] 叶天文, 袁德义, 李艳民, 肖诗鑫, 龚守富, 张 健, 李素芳, 罗 健. 海南油茶的倍性鉴定[J]. 林业科学, 2021, 57(7): 61-69.
YE T W, YUAN D Y, LI Y M, XIAO S X, GONG S F, ZHANG J, LI S F, LUO J. Ploidy identification of[J]. Scientia Silvae Sinicae, 2021, 57(7): 61-69. (in Chinese)
[33] 梁森林, 党江波, 梁国鲁, 郭启高. 天然四倍体枇杷‘B431’减数分裂观察及育性分析[J]. 园艺学报, 2018, 45(10): 1895-1904.
LIANG S L, DANG J B, LIANG G L, GUO Q G. Meiosis observation and fertility analysis in natural tetraploid loquat of ‘B431’[J]. Acta Horticulturae Sinica, 2018, 45(10): 1895-1904. (in Chinese)
[34] 黄 捷. 石斛属植物交配亲和性研究[D]. 广州: 华南农业大学, 2016.
HUANG J. Study on cross-compatibility of the genus[D]. Guangzhou: South China Agricultural University, 2016. (in Chinese)
[35] 陈和明, 吕复兵, 肖文芳, 李 佐, 蒋明殿. 蝴蝶兰与火焰兰远缘杂交育种初探[J]. 中国农业大学学报, 2019, 24(8): 60-71.
CHEN H M, LYU F B, XIAO W F, LI Z, JIANG M D. Preliminary study on the intergeneric hybridization breeding betweenand[J]. Journal of China Agricultural University, 2019, 24(8): 60-71. (in Chinese)
[36] CAI J, LIU X, VANNESTE K, PROOST S, TSAI W C, LIU K W, CHEN L J, HE Y, XU Q, BIAN C. Erratum: corrigendum: the genome sequence of the orchid[J]. Nature Genetics, 2015, 47(2): 186-186.
[37] ZHANG G Q, LIU K W, LI Z, LOHAUS R, HSIAO Y Y, NIU S C, WANG J Y, LIN Y C, XU Q, CHEN L J. Thegenome and the evolution of orchids (Supplementary information)[J]. Nature, 2017, 549(7672): 379-383.
[38] YUAN Y, JIN X, LIU J, ZHAO X, ZHOU J, WANG X, WANG D, LAI C, XU W, HUANG J. Thegenome provides insights into plant adaptation to heterotrophy[J]. Nature communications, 2018, 9(1): 1615.
[39] ZHANG Y X, ZHANG G Q, ZHANG D Y, LIU X D, XU X Y, SUN W H, YU X, ZI X, WANG Z W , ZHAO X, ZHONG W Y, CHEN H F, YIN W L, HUANG T B, NIU S C, LIU Z J. Chromosome-scale assembly of thegenome enhances the understanding of orchid evolution[J]. Horticulture Research, 2021, 8(1): 183-183.
Estimation Ploidy and Genome Size of 27Species by Flow Cytometry
XIONG Wenyan1,2, PU Ran1,2, LIU Yunli1,2, CHEN Junwen2,3, ZHANG Jingli1,2*
1. College of Landscape and Horticulture, Yunnan Agricultural University, Kunming, Yunnan 650201, China; 2. National-Local Joint Engineering Research Center on Gemplasm Innovation & Utilization of Chinese Medicinal Materials in Southwest China, Kunming, Yunnan 650201, China; 3. College of Agronomy and Biotechnology, Yunnan Agricultural University, Kunming, Yunnan 650201, China
is a large genus within Orchidaceae, and there are 76 species recorded in China, mainly distributed in Hainan, southwest China, and Guangdong, Guangxi.species are highly ornamental because of the wide variety, bright, colorful flowers and long flowering period. At present,plant resources in the field are facing the dilemma of extinction, self-incompatibility, rare ornamental species and lack of good breeding parents.In order to protect the existing varieties, cultivate new species and establish a gene molecular library, the nuclear suspension was prepared by MGb dissociation solution from the young leaves ofspeceis, and maize (‘B73’) and tomato () were used as internal standard. At the same time, to establish a method for determining the ploidy and genome size ofspecies based on flow cytometry, the ploidy and genome size of 27species in Orchidaceae were determined by flow cytometry.The results show that it is better differentiation by using maize as internal standard, clear and concentrated which can accurately estimate the ploidy and genome size ofspecies. Among 27species, 19 species were diploid, 5 species were triploid and 3 species were tetraploid. The 27species belong to 8 sections, including 1 species of sect., 2 species of sect., 16 species of sect., 1 species of sect., 1 species of sect., 1 species of sect., 4 species of sect.and 1 species of sect.. The estimated genome size of 27species ranged from 0.98 pg to 2.41 pg, and the estimated average genome size was 1.44 pg. The estimated genome size of 27species were all greater than 0.7 pg, mainly between 0.7–1.4 pg. The estimated genome size ofwas the largest, and that ofwas the smallest, and the difference between them was nearly 2.5 times; the genomes of 27species can be classified as minimal genome or small genome.This study provides convenience for artificial cross pollination configuration, cross breeding and polyploid induction ofspecies, lays a foundation for the establishment of gene molecular library, genetic variation, evolutionary biology and whole genome sequencing forspecies.
flow cytometry;species; ploidy; genome size
S567.239
A
10.3969/j.issn.1000-2561.2022.11.009
2022-04-01;
2022-05-08
云南省重大科技专项计划项目(No. 202102AE090042,No. 202102AA310033,No. 2017ZF003)。
熊文艳(1996—),女,硕士研究生,研究方向:园林植物资源利用与创新。*通信作者(Corresponding author):张敬丽(ZHANG Jingli),E-mail:jl200812@yeah.net。
