湿法烟气脱硝FeⅡEDTA-NO液的NO真空解吸
2022-12-15钟丽蓉何飞强董贝贝刘紫薇丁健桦
钟丽蓉,何飞强,董贝贝,刘紫薇,丁健桦
(东华理工大学化学生物与材料科学学院,江西 南昌 310013)
发展中国家严重的大气污染事件主要归因于光催化氮氧化物(NOx)产生的化学烟雾[1-3]。选择性催化还原(SCR)被认为是目前最有效的氮氧化物控制技术,它的主要原理是贵金属催化剂在高温和氨气的作用下将NO 催化还原为无毒的氮气。但SCR的运行和维护成本高昂,尤其在中小型工业锅炉和冶炼厂中很难采用该技术[4]。因此开发一种高效且低成本的一氧化氮(NO)脱除方法是大气污染控制领域的热门课题之一。
络合湿法脱硝是一氧化氮脱除的有效技术之一[5]。其中,FeⅡEDTA 络合物由于对一氧化氮的快速络合能力,自20世纪70 年代以来一直是一种被广泛研究的络合吸收剂。如式(1)所示,FeⅡEDTA可以快速捕获一氧化氮生成亚铁亚硝基络合物FeⅡEDTA-NO,平衡常数高达107L/mol[6]。然而,如式(2)所示,FeⅡEDTA 的致命缺点就是,它容易被氧气氧化成无活性的FeⅢEDTA[7]。
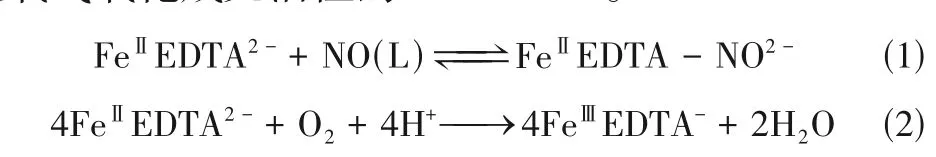
因此,目前FeⅡEDTA 吸收一氧化氮的研究主要集中在抑制FeⅡEDTA 氧化或通过合适的添加剂再生FeⅡEDTA。例如,将亚硫酸盐、亚硫酸氢盐、活性炭、微生物等添加剂联合FeⅡEDTA溶液脱硝,利用这些添加剂对FeⅡEDTA 脱硝后的吸收液进行还原再生来提高NO吸收[8-10]。近年来,本文作者课题组通过添加铁粉[11]、锌粉[12]、二氧化硫脲[13]、连二亚硫酸钠[14]、尿素[15]、抗坏血酸[16]等添加剂以实现FeⅡEDTA的稳定性,获得了高效的NO脱除率。
综上所述,针对FeⅡEDTA 易氧化的缺点,通过添加适当的还原剂,可以显著改善FeⅡEDTA 易氧化的不足,从而保持高效的一氧化氮脱除。然而,在FeⅡEDTA 脱硝过程中,脱硝溶液的解吸问题似乎一直没有得到解决,很少有文献讨论FeⅡEDTA脱硝富集溶液(主要成分为FeⅡEDTA-NO)的NO 解吸问题。因此,迫切需要对FeⅡEDTA-NO液的NO解吸进行系统研究。
本文作者课题组之前的研究已经证明,与其他FeⅡEDTA 络合方法相比,从经济性和脱除率方面综合来看,VC 联合FeⅡEDTA 体系在NO 脱除方面具有很大的优势[16-17],因此本文选择该体系作为解吸的研究对象。就解吸方法而言,主要的酸性气体解吸方法有传统加热再生法、真空解吸法、微波辐射法和超声波法[18-19]。虽然传统的直接加热可以解吸FeⅡEDTA-NO 溶液,但它存在一些固有的缺点,如解吸性能差和能耗高。随着技术的进步,微波辐射和超声波等技术在烟气处理中回收尾气方面引起了人们的关注。例如,Xu 等[20]研究了超声波对钠碱脱硫富溶液中SO2解吸的影响。结果表明,超声波只能促进亚硫酸的分解,而不能促进硫酸氢钠的分解。Xue 等[21]还使用超声波加热解吸富含柠檬酸盐的SO2溶液,表明超声波可以在不改变反应机理的情况下加强SO2解吸。同时,一些研究人员提出了微波法再生脱硫活性炭[22]。尽管上述方法可以加强酸性气体的解吸,但考虑到一些显著的缺点,如昂贵的设备投资、不稳定性和不成熟的技术等,到目前为止,它们很难在工业运行条件下进行商业应用。迄今为止,真空技术已被广泛用于分离和纯化液体中的气体。例如,Vadillo等[23]和Chen等[24]已经研究了真空条件下解吸液中二氧化碳的再生过程,结果表明真空解吸能极大改善二氧化碳的解吸速率,并且能降低能耗。因此,在工艺投资和效率方面,真空技术有可能以较低的能耗和工艺成本实现较高FeⅡEDTA-NO 液的NO解吸效率。此外,真空解吸可进一步解决FeⅡEDTA易氧化这一难点。
鉴于上述考虑,基于FeⅡEDTA 的特性和真空解吸的优点,本文首次将真空解吸用于FeⅡEDTANO 液的NO 解吸,研究真空度和温度对解吸过程的可行性、影响和动力学,并获得合适的操作参数,旨在实现FeⅡEDTA溶液的高效可逆回收。
1 材料和方法
1.1 材料
抗坏血酸(98.0%,质量分数)、Na2EDTA(99.0%,质量分数)和FeSO4(99.0%,质量分数),中国天津科密欧化学试剂有限公司;氮气(99.999%,体积分数)和一氧化氮(99.99%,体积分数),中国南昌华特气体有限公司;空气由空气压缩机提供;所有试剂均为分析试剂。
1.2 FeⅡEDTA脱硝富液的制备
根据式(1),FeⅡEDTA 脱硝富溶液的主要成分为FeⅡEDTA-NO,其制备方法是将已知的NO 和N2混合物(NO 1mL/L)通过FeⅡEDTA 溶液鼓泡,直到出口处的NO 浓度(使用NO 分析仪测定)等于进口处的NO浓度。同时,在FeⅡEDTA-NO 溶液中加入2% VC,以阻止Fe(Ⅱ)的氧化。因此,NO 解吸过程中的Fe(Ⅱ)氧化可以忽略不计。
1.3 NO解吸实验
解吸装置如图1所示,在实验开始前,检查装置的气密性。通过真空泵(最低绝对压力10kPa,抽气速率60L/min)抽气,当系统达到最大真空度时,停止抽气,如果真空表(-0.1~0MPa,±1kPa)的读数能数分钟内保持不变,则气密性良好。调节真空度控制槽的针阀,设定某些特定真空度值。在进行泄漏检查和真空度调节后,将250mL 含2%VC 的FeⅡEDTA-NO 溶液倒入容量为250mL 的烧瓶中,将其置于恒温水浴中,并以固定搅拌速度进行磁搅拌。一旦溶液达到温度计测量的所需温度,将通过在密闭条件下打开针阀6进行真空解吸,获得实验所需的真空度,反应开始并记录时间。烧瓶中产生的蒸汽通过一根直冷凝管完全冷凝,冷凝水被收集在收集瓶8中。随后,不凝性气体进入装有大量过氧化氢的平底烧瓶中,保证所含NO被充分除去,每隔10min,停止真空泵,从三口烧瓶中取1mL 样品,测定FeⅡEDTA-NO 浓度;同时,收集瓶中的冷凝水通过电子天平称量,以上操作需迅速完成,然后重新开启真空解吸系统,保持系统真空度维持原值。重复上述程序,以研究各种操作参数(温度、真空度)对NO解吸的影响。
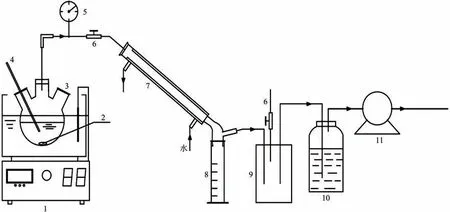
图1 FeⅡEDTA-NO液的NO解吸实验装置
NO解吸效率ηDE(%)用来评估解吸性能。此外,还计算了NO 平均解吸率R(NO)(mol/s)和水蒸气的平均蒸发率R(H2O)(mol/s),如式(3)~式(5)所示。
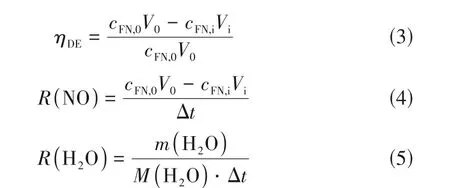
式中,cFN,O和cFN,i分别为解吸前后吸收溶液中的FeⅡEDTA-NO 浓度[使用紫外分光分光光度计(UV-2450,日本岛津)在434nm 的吸光度下检测],mol/L;V0和Vi分别为初始体积和解吸后的体积[Vi=V0-m(H2O),mL;m(H2O)为捕集器收集的水的质量,g];M(H2O)为H2O的摩尔质量,g/mol;∆t为解吸时间,min。
1.4 NO吸收-循环实验
采用FeⅡEDTA和VC混合吸收液在实验室自制的装置上(图2)进行了NO吸收解吸循环实验。
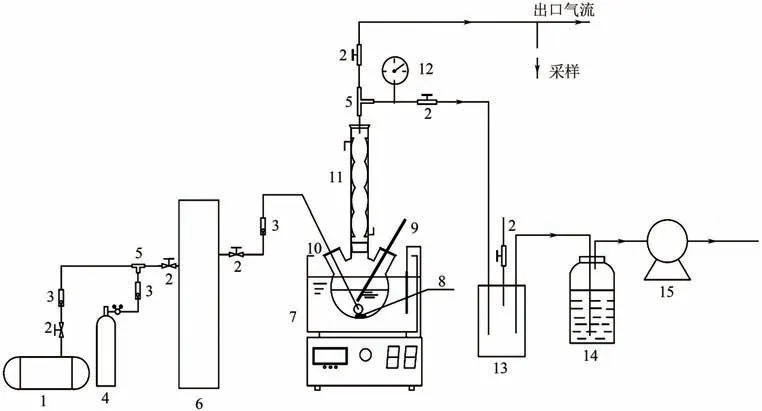
图2 NO吸收-解吸循环实验
NO 吸收-循环实验主要由两部分组成:NO 吸收过程和NO解吸过程。首先,将一定浓度的NO混合气体以一定的流速充入容量为500mL FeⅡEDTANO的三口烧瓶中,置于恒温水浴中进行磁力搅拌。入口和出口气流的NO 浓度由KM950 测定。NO 吸收实验持续40min后,停止通入烟气,并立即开始富液真空解吸实验。在所需温度和真空度条件下按照上述方法立即开始真空解吸,解吸实验持续60min。值得注意的是,在真空解吸过程中,蒸汽流中的冷凝液通过球形冷凝管返回到三口烧瓶中。吸收和解吸参数见表1。依此循环,NO 浓度通过烟气分析仪(KM950)测定。NO 脱除率如式(6)、式(7)所示。

表1 NO吸收-解吸循环实验条件

式中,ηAE为NO脱除效率;cin为一氧化氮进口浓度,mL/m3;cout为一氧化氮出口浓度,mL/m3。
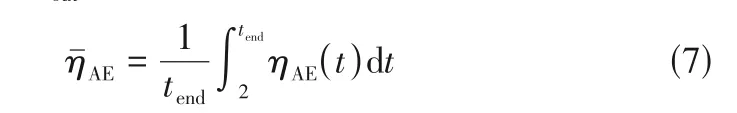
式中,ηˉAE为NO 平均脱除效率;tend为吸收结束时间,min;ηAE(t)为NO随时间变化的脱除率。
2 结果与讨论
2.1 FeⅡEDTA-NO液NO解吸的可行性
本文作者课题组先前的研究表明,VC 只能还原FeⅡEDTA 并 抑 制FeⅡEDTA 氧 化,但 不 会 与FeⅡEDTA-NO 发生反应[17]。FeⅡEDTA-NO 不稳定,在加热或减压条件下可分解,通过式(1)的逆反应生成FeⅡEDTA 和NO,这为FeⅡEDTA-NO 液的NO解吸提供了理论上的可行性。本文通过实验来验证其可行性。在常压、0.002mol/L FeⅡEDTA-NO、pH 8.0 的条件下,通过调节温度从25~100℃对FeⅡEDTA-NO 溶液进行解吸实验。另外,在溶液中加入2%VC作为FeⅡEDTA-NO的氧化抑制剂。从图3可以看出,温度低于45℃时FeⅡEDTA-NO浓度略有下降,当温度高于45℃时,FeⅡEDTA-NO浓度下降速度有所加快。在80min内,当温度分别为65℃、85℃和100℃时,FeⅡEDTA-NO 浓度从0.002mol/L分 别 下 降 到0.000951mol/L、 0.000552mol/L 和0.000215mol/L。结果表明,FeⅡEDTA-NO 在合适的温度下可以解吸,且温度越高解吸速度越快。
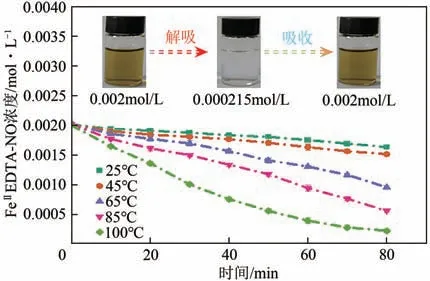
图3 25~100℃常压解吸下FeⅡEDTA-NO浓度的变化
除此之外,Zhang 等[25]研究了FeⅡEDTA-NO 还原过程中的颜色变化,发现FeⅡEDTA-NO 还原后,溶液的颜色从黑棕色的FeⅡEDTA-NO 变为无色的FeⅡEDTA。因此解吸过程中颜色变化也具有重要的指示作用,当FeⅡEDTA-NO 溶液加热解吸后,FeⅡEDTA-NO 浓度下降,且颜色变浅,而将NO 和N2混合气充入到解吸后的溶液时,FeⅡEDTA-NO浓度和黑棕色得到恢复(图3)。浓度和颜色的变化进一步证明了FeⅡEDTA-NO 在加热条件下可以解吸成FeⅡEDTA。然而,高温解吸需要大量的能量。因此,本实验将真空技术首次应用于FeⅡEDTANO液的NO解吸过程。
2.2 真空度的影响
真空度是NO 真空解吸过程中关键的操作参数之一。因此,有必要研究真空度对解吸过程的影响。在70℃、0.002mol/L FeⅡEDTA-NO、pH 8.0 的条件下,通过调整真空度从86~55kPa 进行解吸实验。此外,在溶液中添加2%VC作为FeⅡEDTA-NO的氧化抑制剂。从图4(a)中可以看出,NO 平均解吸速率R(NO)随着真空度的增加而增加。具体而言,当真空度从55kPa增至77kPa时,R(NO)略有增加。而当真空度从77kPa 增至86kPa,R(NO)从0.99×10-7mol/s明显增加到2.8×10-7mol/s。
为了全面分析不同真空度下解吸率与解吸时间的关系,选取了3 个不同真空度(84kPa、81kPa、77kPa)作为研究对象。从图4(b)可以看出,在第10 分钟时,它们的解吸率ηDE分别为71.51%、50.21%和38.14%。在第30分钟时,相应的解吸率ηDE分别为98.72%、87.65%和69.52%。且随着真空度的上升,解吸时间明显缩短,在77kPa、81kPa和84kPa的真空度下,达到90%的解吸时间分别需要60min、40min和20min。
一方面,较高的真空度会降低气相中NO 的分压,从而增加气液传质的驱动力,加快吸收液的解吸速度。另一方面,溶液中水的蒸发量对NO解吸具有积极影响。例如,水蒸气作为流动蒸汽可降低气相中的NO分压,导致从液相到气相的更强传质驱动力[26]。此外,大量的水蒸气会经过气体-液体界面,增加气体-液体接触面积。从图4(a)可以看出,随着真空度从86kPa 下降到55kPa,水的R(H2O)的平均蒸发率从4.22×10-4mol/s 降低到1.35×10-4mol/s,这也解释了R(NO)值随着真空度的增加而增加的原因。结果表明,较高的真空度和较多的水蒸气有利于吸收液中NO的解吸。
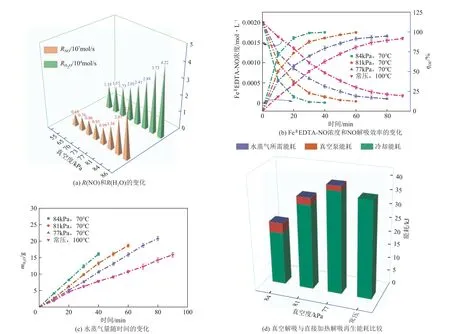
图4 真空度对解吸的影响
最后,为了突出真空解吸的优点,将其与直接加热解吸进行了比较。如图4(b)所示,100℃下传统加热解吸速率最慢。从能耗方面,根据实验结果,对真空再生和直接加热再生的能耗进行了简单的计算和比较(计算解吸率大于90%时的总能耗),总能耗主要由真空泵、冷却泵和水蒸气3 部分组成,而FeⅡEDTA-NO 分解反应热忽略不计。上述3部分的能耗可通过式(8)~式(12)进行估算[19,27-28]。
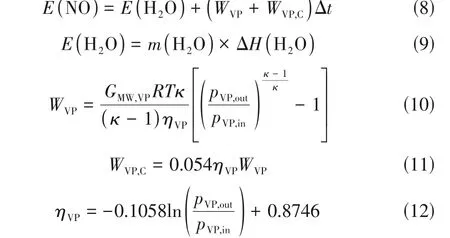
式中,E(NO)为解吸效率达到90%时解吸系统的总能耗,kJ;E(H2O)为蒸汽的能量消耗,kJ;WVP和WVP,C分别为真空泵和冷却泵的功,W;ΔH(H2O)为水的蒸发焓,kJ/kg;m(H2O)为水的蒸发量,g;GMW,VP为湿汽提气的摩尔流量,mol/s;R为气体常数,J/(mol·K);T为温度,K;κ为气体混合物的绝热常数;pVP,in和pVP,out分别为真空泵的进口和出口压力,kPa;ηVP为真空泵的效率,%。
以真空度84kPa、81kPa、77kPa 和常压为例,解吸效率达到90% 所需的时间分别为20min、40min、60min 和90min,相应的水汽生成量分别为8.24g、13.25g、15.92g和15.87g[图4(c)]。根据式(8)~式(12),分别计算了真空解吸和直接加热解吸的能耗。从图4(d)可以看出,对于真空解吸过程,水蒸气的能耗占总能耗的83%以上,而冷凝泵的能耗很小。当真空度下降时,总能耗显著增加,而冷凝能耗始终保持较低且变化不大。这主要是因为降低真空度会降低NO的解吸速率,需要更长的解吸时间才能满足解吸要求,因此需要更多的水蒸气,导致总能耗增加。
此外,与直接加热解吸相比,真空度为77kPa时,真空解吸的能耗更高。因此,较高的真空度虽然有利于NO解吸,但是在实际工业应用中,考虑到真空度过高会增加昂贵的设备投资和能源消耗,将真空度保持在81kPa左右较为合适。
2.3 真空度下的动力学
FeⅡEDTA-NO 液NO 解吸的实质是式(1)的可逆反应,反应速率可表示为式(13)。
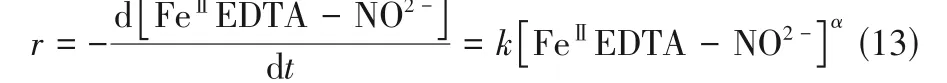
式中,α、r和k分别为FeⅡEDTA-NO解吸反应级数、解吸速率和解吸速率常数;[FeⅡEDTA-NO2-]表示溶液中FeⅡEDTA-NO浓度。
首先假设反应级数为1,然后进行验证。如图5 所示,可以观察到ln[FeⅡEDTA-NO]基本上与时间成线性关系。真空度为84kPa、81kPa、77kPa和常压时,它们的相关系数(R2)分别为0.991、0.997、0.995 和0.992。这可以证明FeⅡEDTA-NO的反应级数为1。同时,根据拟合直线的斜率得到了它们的总速率常数k,分别为0.1374min-1、0.06429min-1、0.03738min-1和0.02903min-1。速 率常数随着真空度的增加而增加,进一步说明较高的真空度有利于FeⅡEDTA-NO液的NO解吸。
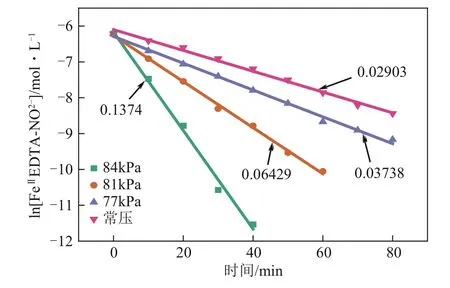
图5 ln[FeⅡEDTA-NO2-]随时间变化线性拟合图
2.4 温度对解吸的影响
温度是NO 真空解吸过程中最关键的操作参数之一,它决定了整个过程的能耗经济性。通过在真空度80kPa、0.002mol/L FeⅡEDTA-NO、pH 8.0 条件下将温度从50℃改变到75℃进行解吸实验。此外,还向溶液中添加2%VC作为FeⅡEDTA-NO的氧化抑制剂。从图6(a)可以看出,解吸速率R(NO)值随温度的升高而增加。具体而言,R(NO)随温度从50℃升高到60℃略有增加,当温度从60℃升高到75℃,R(NO)从6.8×10-8mol/s显著增加到1.95×10-7mol/s。
此外还研究了不同温度下解吸效率随时间的变化规律。从图6(b)可以看出,当温度为63℃、66℃、69℃和72℃时,10min内的解吸率ηDE分别为20.12%、36.13%、48.21%和71.51%。获得80%解吸率所需的解吸时间分别为70min、50min、30min和20min。因此解吸时间随温度的升高而显著缩短。
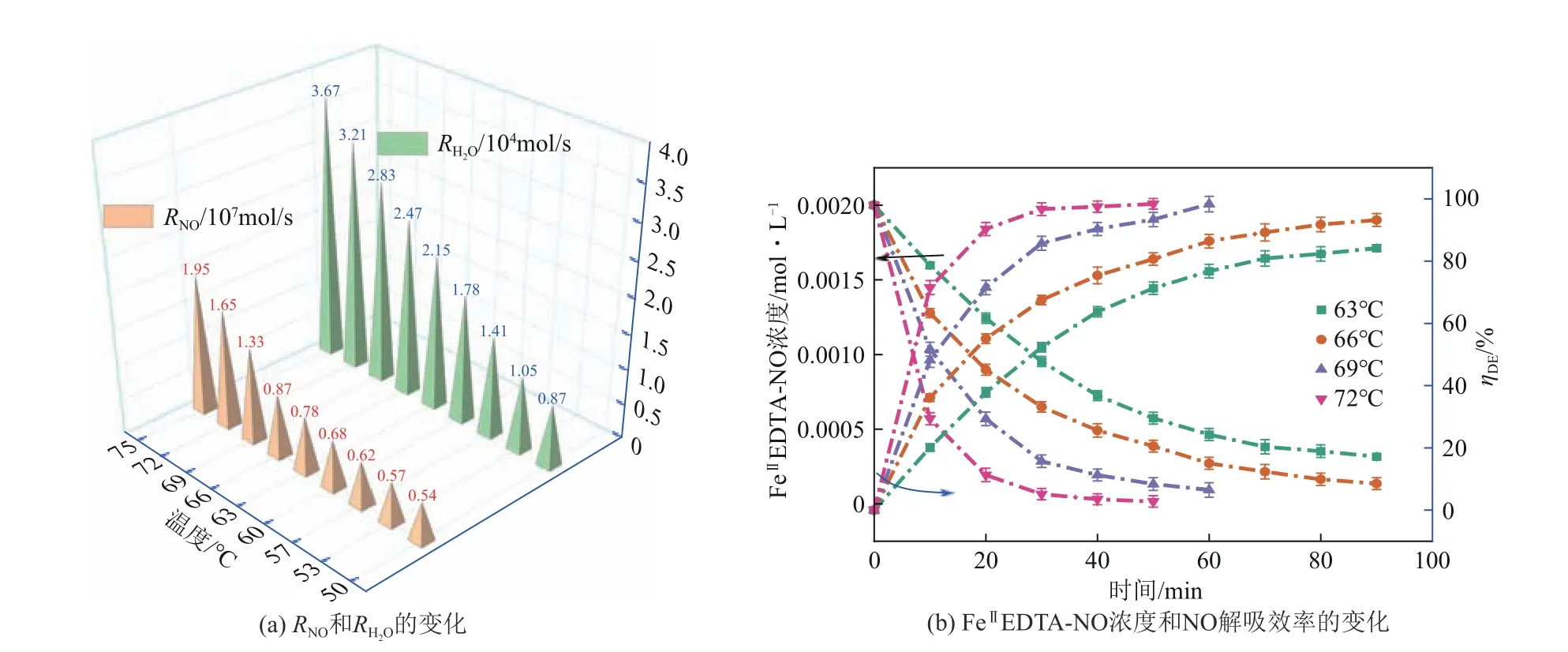
图6 温度对解吸的影响
这些结果表明,解吸过程可以随着温度的升高而增强。从热力学角度来看,由于式(1)的逆反应是吸热反应[12],加热有利于FeⅡEDTA-NO 的分解。此外,温度的升高也会加速FeⅡEDTA-NO 溶液的分子运动,同时增加水的蒸发速率[图6(a)],导致气相中NO分压降低,从而加快解吸速率。当温度高于对应于80kPa 的泡点温度(约60℃)时[29],会迅速产生大量的水蒸气,导致更大的解吸速率。考虑到能源消耗和设备成本,脱附温度应保持在70℃。
2.5 不同温度下的动力学
此外还可以发现,在不同温度下(63℃、66℃、69℃和72℃),FeⅡEDTA-NO上也呈现伪一级反应,其中所对应的相关系数(R2) 分别为0.9788、0.9909、0.9784和0.9814[图7(a)]。此外,从拟合直线斜率中获得的相应速率常数分别为0.02148min-1、0.02945min-1、0.05146min-1和0.09655min-1,随 温度升高而增加。
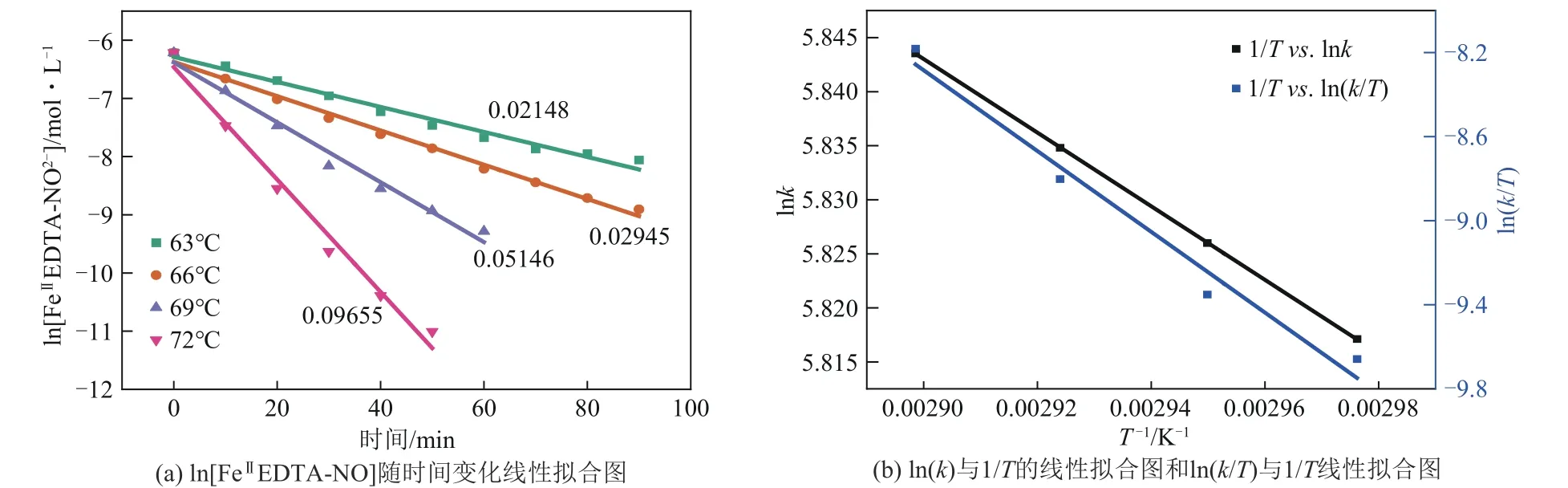
图7 不同温度下的动力学
活化能(Ea)用于定义在发生化学反应时要克服的能垒,主要揭示了反应速率常数和温度之间的关系[30],如式(14)所示。
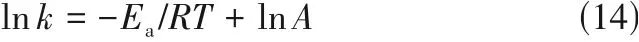
式中,k为速率常数;A为指数前因子;R为通用气体常数,R=8.314J/(K·mol);T为绝对温度,K;Ea为反应活化能,kJ/mol。
Eyring-Polanyi 公式[式(15)]揭示化学动力学中化学反应速率与温度的关系[31]。
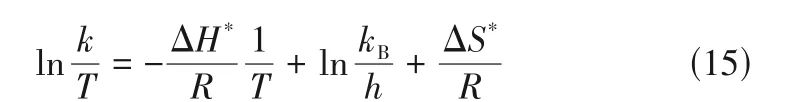
式中,kB为玻尔兹曼常数,kB=1.38×10-23J/K;h为普朗克常数,h=6.63×10-34J·s;∆H*为活化焓;∆S*为活化熵。
根据lnk与1/T的线性拟合直线的斜率计算得到Ea为2.83kJ/mol(图7)。根据ln(k/T)与1/T的线性拟合直线的斜率和截距分别计算∆H*为159.76kJ/mol和∆S*为196.90J/(k·mol)。较大的正∆H*表明解吸过程是吸热的[32]。
2.6 NO的吸收-解吸循环实验
为了研究FeⅡEDTA与VC脱硝及真空解吸工艺可行性,在间歇式实验装置上进行了NO吸收和解吸的循环实验。在NO脱除过程中,所有操作条件保持不变,吸收循环中未添加新的吸收剂和抑制剂;此外,FeⅡEDTA 溶液含有2%VC 作为氧化抑制剂。从图8中可以看出,NO平均脱除率ηˉAE随循环次数的增加缓慢下降,但在11 个循环中均保持在90%以上。ηˉAE随循环次数减少的主要原因是2%VC 在较长时间内不能完全避免Fe(Ⅱ)的氧化。因此,开发更高效的氧化抑制剂是提高FeⅡEDTA溶液循环次数的关键,这是后续工作的主要研究方向。
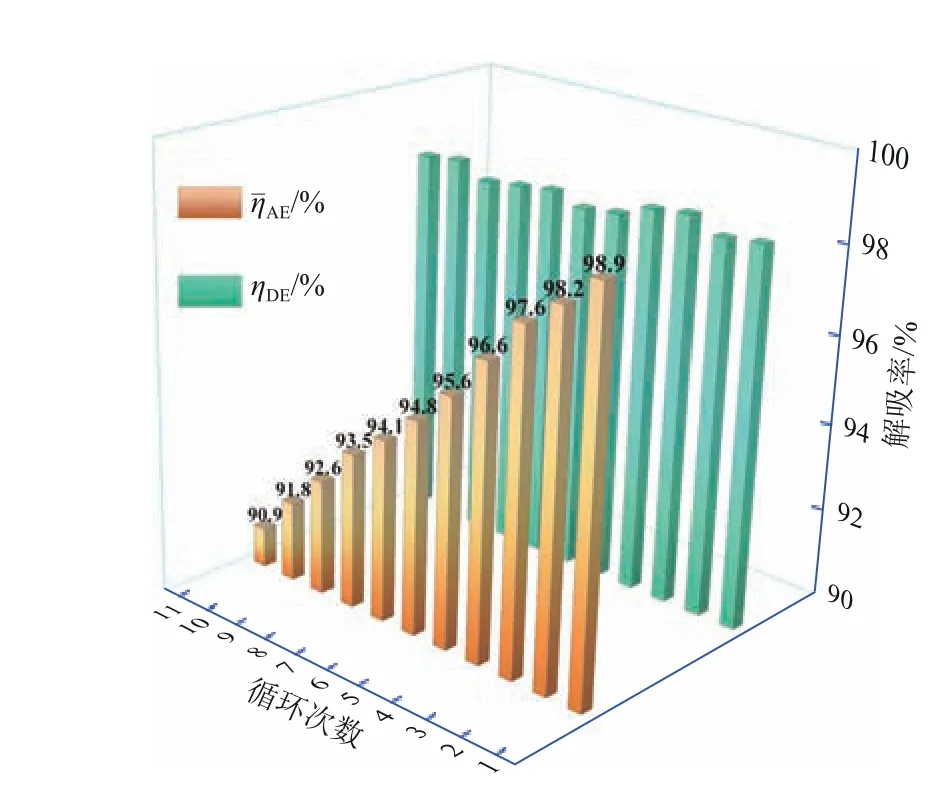
图8 NO吸收-解吸循环实验
3 结论
根据FeⅡEDTA 的性质和真空解吸的优点,首次将真空技术应用于FeⅡEDTA 脱硝体系。实验结果表明,在70℃条件下,当真空度控制在80kPa以上时,40min 内,NO 的解吸效率可达92%以上,且随着真空度的增加或温度的升高,NO 的解吸速率和水蒸气的传质速率都会显著增加,其中,水的蒸发量对NO解吸有积极影响。与传统加热解吸相比,真空解吸不仅具有更好的解吸效率,而且在经济上降低总能耗,可实现工业废气、热能等低品位热源的高效利用。动力学计算表明,FeⅡEDTA-NO液的NO 解吸的活化能、活化熵、活化焓分别为2.83kJ/mol、196.90J/(K·mol)和159.760kJ/mol。最后,NO 吸收解吸循环实验表明,脱硝富液FeⅡEDTA-NO在NO真空解吸后能有效吸收NO,在11个循环后,NO平均去除率才降低到90%以下。
