粉煤灰碱熔—脱硅制备A型沸石和白炭黑
2022-12-15罗洁,廖蓉
罗 洁,廖 蓉
(1. 四川省工业环境监测研究院,四川 成都 610041;2. 邛崃市天府新区新能源新材料产业功能区发展服务局,四川 邛崃 611534)
粉煤灰是来自燃煤电厂的固体废物,全球每年产生量在亿吨以上,利用率约为70%[1]。累积堆存的粉煤灰占用大量土地并造成环境污染,影响人体健康。如何提高粉煤灰资源化利用率已成为亟待解决的问题。
因粉煤灰与天然沸石前体组成相似,用粉煤灰合成沸石的研究受到广泛关注[2-5],自HOLLER在1985年采用水热法以粉煤灰为原料合成沸石以来,学者们通过对实验条件和方法的不断改进和创新,已获得A、X、Y型等至少15种以上合成沸石。其中A型沸石是一种无机微孔材料,广泛应用于洗涤、石油化工、医药及环保等行业[6-7]。徐如人等[8]研究发现,硅铝比是影响A型沸石合成的重要因素,理想的硅铝摩尔比约为1∶1,通过添加铝源可达到理想的硅铝配比[9-10],但增加了沸石的生产成本。
白炭黑是白色粉末状无定形硅酸和硅酸盐产品的总称,主要成分为SiO2,具有粒径小、比表面积大、化学稳定性好、耐高温和绝缘性好等优点[11],广泛应用于橡胶、塑料、涂料、油墨、造纸、农医药及日用化工等领域。制备白炭黑的主要原料为硅酸钠,主要方法有沉淀法、气相法、溶胶凝胶法等[12-14],其中沉淀法工艺简单、成本较低,是目前工业生产中普遍采用的方法。
本研究在传统碱熔水热合成法的基础上,通过引入脱硅工艺,将粉煤灰中的硅铝比调节为合成A型沸石的理想配比,从碱熔产物中获得脱硅产物和脱硅滤液。以脱硅产物为原料,水热合成A型沸石;以脱硅滤液为原料,制备白炭黑。
1 实验部分
1.1 材料、试剂和仪器
粉煤灰取自绵阳某电厂,其化学组成(w)为SiO2(44.696%)、A12O3(18.358%)、Fe2O3(15.358%)、CaO(11.004%)、K2O(3.239%)、TiO2(2.050%)、MgO(1.115%)、Na2O(0.354%)、Cl(0.250%)。
碳酸钠、硫酸、NaOH均为分析纯。
CXGΦ50 型磁选机(武汉洛克公司);PF-1 000 mL型聚四氟内衬水热反应釜(滨海县正信仪器厂);STARTER 300型pH计(德国赛多利斯公司);EVO-18-分析型钨灯丝扫描电子显微镜(德国蔡司公司);8D-ADVANCE型X射线衍射仪(荷兰帕纳科公司);BSD型比表面积及孔径分析仪(美国康塔仪器公司);Tensor27型傅里叶变换红外光谱仪(德国布鲁克公司);ICP 6300型电感耦合等离子体原子发射光谱仪(美国飞世尔公司)等。
1.2 A型沸石和白炭黑的制备
本实验所用粉煤灰铁含量较高,需对粉煤灰进行磁选除铁。将粉煤灰过筛后经磁选机3次磁选(磁场强度为700 kA/m)。
为提高粉煤灰的反应活性,需对粉煤灰进行碱熔处理。称取一定量的粉煤灰(过200目筛)与碳酸钠(助熔剂)按质量比1∶0.5混合,置于马弗炉中800 ℃焙烧2 h,冷却后研磨过筛。将碱熔粉煤灰与水按质量比1∶10混合,在转速400 r/min条件下搅拌2 h(脱硅),过滤,滤渣烘干后得到脱硅产物,然后将脱硅产物加入NaOH溶液中,陈化1 h后置于水热反应釜中水热晶化,洗涤、干燥得到A型沸石。脱硅滤液为含有硅酸钠的水溶液,将脱硅滤液置于恒温水浴锅(80 ℃)中,添加适量碳酸钠作为缓冲剂,之后逐滴加入4 mol/L的硫酸至pH为8,制得白色凝胶,继续水热搅拌2 h,冷却后,抽滤、洗涤、干燥得到白炭黑产品。
1.3 产物表征
采用X射线衍射仪分析产物的物相成分,Cu靶Kα辐射,扫描范围为 3°~80°;采用红外光谱仪表征产物的化学组成,KBr压片,范围400~4 000 cm-1;采用X射线荧光光谱仪测定产物的主要元素含量;采用扫描电子显微镜观察产物形貌及晶粒大小、分布等。
2 结果与讨论
2.1 碱熔—脱硅产物的表征
粉煤灰碱熔产物的XRD谱图见图1。由图1可见,粉煤灰碱熔产物主要成分为硅酸钠和硅铝酸钠,其中硅酸钠可溶于水,而硅铝酸钠溶于强碱不溶于水[15],引入脱硅流程后,可通过碱熔产物中的硅酸钠和硅铝酸钠在水中的溶解性差异而将两者分离。经过水洗脱硅后,脱硅产物仅剩硅铝酸钠(见图2),其硅铝摩尔比为1∶1。

图1 碱熔产物的XRD谱图
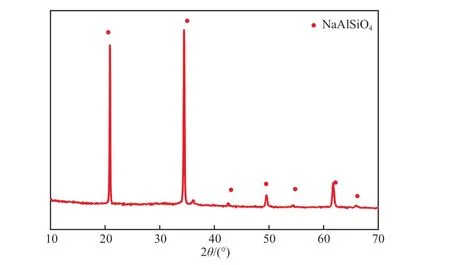
图2 碱熔—脱硅产物的XRD谱图
采用等离子体原子发射光谱仪测定脱硅滤液中的硅铝含量,硅的质量浓度为16.840 g/L,铝的质量浓度仅为0.084 g/L,说明硅酸钠和硅铝酸钠不仅得到了有效的分离,而且铝源得到了保留。碱熔—脱硅产物的主要成分为硅铝酸钠,没有石英、莫来石等,表明碱熔—脱硅产物的理化性质完全改变,产物硅铝酸钠为合成A型沸石的前体。
2.2 合成沸石工艺条件的优化
2.2.1 NaOH浓度
在晶化时间为12 h、晶化温度为90 ℃的条件下,不同NaOH浓度合成沸石的XRD谱图见图3。由图3可见:当NaOH浓度为1 mol/L时,已能够合成出峰型较好的A型沸石,且与A型沸石标准卡片能够很好地吻合;当NaOH浓度提高到2 mol/L时,A型沸石的特征峰强度明显增大,峰宽变窄,表明沸石结晶度增大,说明提高NaOH浓度有利于合成A型沸石;随着NaOH浓度的进一步增大,A型沸石的特征峰强度减弱,且出现方钠石的特征峰;当NaOH浓度达到5 mol/L时,A型沸石的特征峰已基本消失,合成产物为结晶度较低的方钠石。

图3 不同NaOH浓度合成沸石的XRD谱图
由于NaOH浓度增大会增加硅与铝的溶解度,改变原料物种在合成体系中的聚合态及其分布[16],总的结果是缩短诱导期和成核时间,加快了晶化速度;但是NaOH浓度过大时,容易使介稳态的A型沸石发生转晶,生成更稳定的方钠石,导致体系中的晶体出现共晶生长,最终A型沸石转化为方钠石。综合考虑,本实验选择NaOH浓度为2 mol/L较适宜。
2.2.2 晶化时间
在NaOH浓度为2 mol/L、晶化温度为90 ℃条件下,不同晶化时间合成沸石的XRD谱图见图4。由图4可见:晶化时间主要影响着合成沸石的种类和沸石的结晶度,晶化时间为6 h时即出现较明显的A型沸石特征峰;当晶化时间延长至12 h,A型沸石特征峰更加尖锐,峰强增大,结晶度很高,且在此条件下无其他杂峰出现,晶相纯度高;但随着晶化时间继续延长,A型沸石特征峰减弱,且出现了X型沸石的杂峰,导致晶相纯度降低。故本实验选择晶化时间12 h为宜。
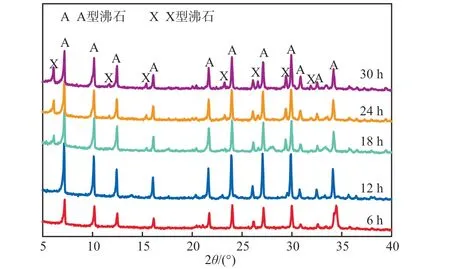
图4 不同晶化时间合成沸石的XRD谱图
2.2.3 晶化温度
研究表明[17],水热晶化温度过高容易结块,温度过低不易结晶,且会使结晶时间变长。在NaOH浓度为2 mol/L、晶化时间为12 h的条件下,不同晶化温度合成沸石的XRD谱图见图5。由图5可见:晶化温度为70 ℃时,XRD谱图中仅出现了脱硅产物硅铝酸盐的衍射峰,未出现A型沸石的衍射峰,说明低温下脱硅产物无法进行合成反应;当晶化温度为80 ℃时,XRD谱图中出现了A型沸石的特征峰,且仍然存在硅铝酸钠的特征峰,表明此温度下已经发生合成反应,部分脱硅产物已经转化为A型沸石;当晶化温度升至90 ℃时,A型沸石的特征峰强度增大,结晶度很高,且无其他杂峰;当晶化温度继续升至100 ℃时,A型沸石特征峰强度减弱且出现了X型沸石衍射峰。可见晶化温度影响着脱硅产物向沸石的转化,且随着温度的上升会出现不同的沸石种类。晶化温度过低时,晶化反应速率太慢,难以形成结晶;晶化温度升高会增大硅铝酸盐胶体的溶解度,使体系的介质更加均匀,晶核数量也随之增加,晶化速率加快;当晶化温度超过一定限值时则会出现杂晶。在本实验条件下,当晶化温度为90 ℃时,沸石为A型沸石,产品纯度最高。
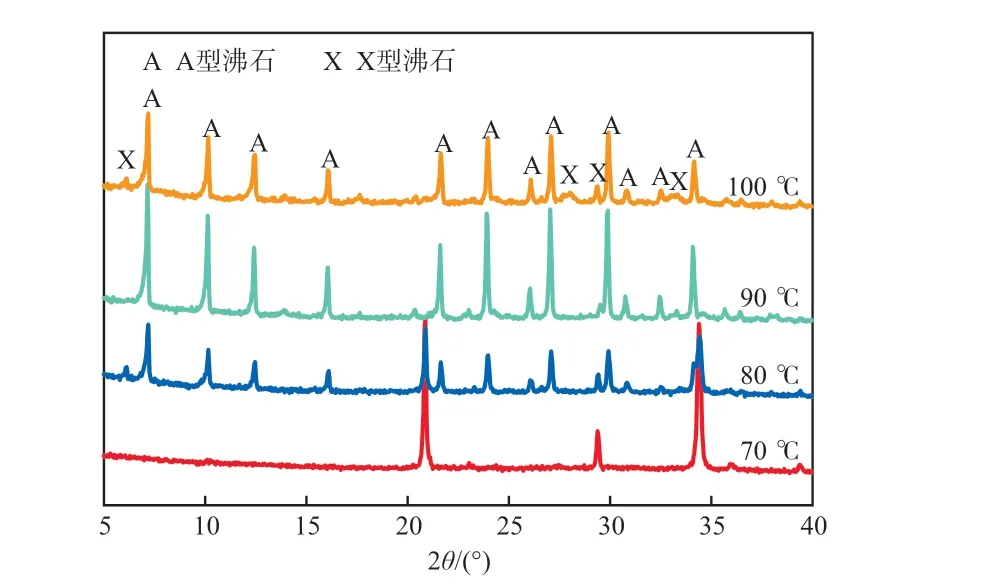
图5 不同晶化温度合成沸石的XRD谱图
2.3 沸石的分析表征
2.3.1 沸石的微观形貌
原状粉煤灰、脱硅产物及合成沸石的SEM照片见图6。由图6可见:原状粉煤灰样品中含有大量大小不一的球型玻璃珠,球型完整,且附着有其他杂质;通过碱熔—脱硅处理后,原状粉煤灰的球型玻璃珠遭到破坏,脱硅产物的结构变得更加疏松,为后续合成沸石创造了条件;脱硅产物水热合成后的合成产物为明显的立方体结构,这是A型沸石典型的结构形貌,证明了A型沸石的生成。

图6 原状粉煤灰(a)、脱硅产物(b)及合成沸石(c)的SEM照片
2.3.2 沸石的FTIR谱图
3种合成条件下沸石的FTIR谱图见图7。
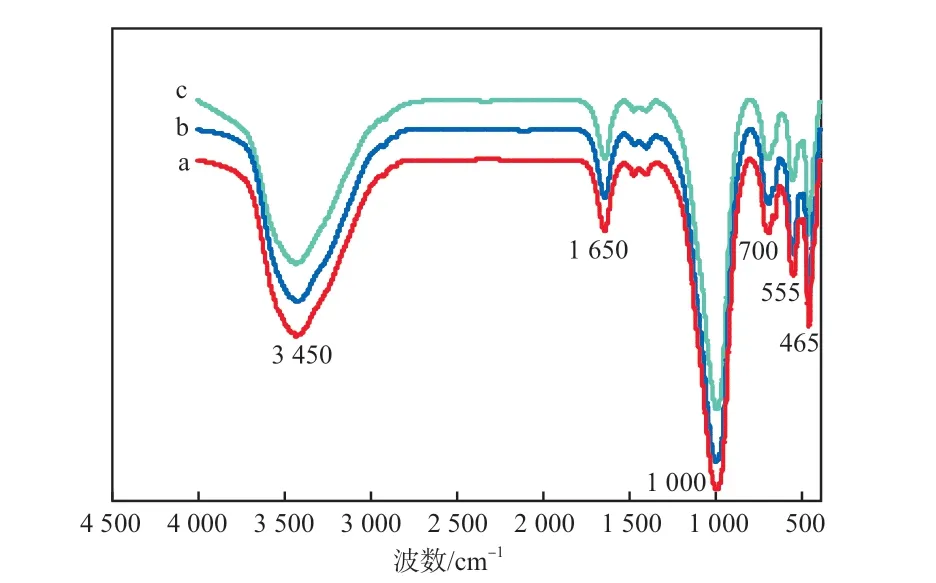
图7 3种合成条件下沸石的FTIR谱图
合成条件:a)NaOH浓度1 mol/L,晶化时间12 h,晶化温度90 ℃;b)NaOH浓度2 mol/L,晶化时间12 h,晶化温度90 ℃;c)NaOH浓度3 mol/L,晶化时间12 h,晶化温度90 ℃。
由图7可见:在3 400~3 500 cm-1处出现了强宽峰,归属于结晶水或结构水中—OH的伸缩振动;在1 650 cm-1处出现的特征峰归属于—OH的弯曲振动;1 500 cm-1以下的特征峰归属于Si—O或Al—O的伸缩振动或弯曲振动;1 000 cm-1和700 cm-1处的特征峰归属于沸石内部四面体的反对称伸缩振动和对称伸缩振动;465 cm-1处的特征峰归属于Si—O或Al—O的弯曲振动;555 cm-1处的特征峰为硅铝外部四面体中一些双四元环的特征谱带。3种不同合成条件下的FTIR谱图无明显不同,可能是由于沸石的主要组成元素为Si、Al、O等,根据其外层电子排布及轨道杂化方式[18],只能形成Si—O或Al—O类官能团。
2.3.3 沸石的钙离子交换容量
钙离子交换容量可以作为衡量沸石吸附阳离子总量能力的重要参数。采用氯化铵-乙醇法[19]对a、b和c 3种合成条件下所得沸石的钙离子交换容量进行测定,分别为305.25,318.21,310.34 mg/g (以CaCO3计)。
当NaOH浓度从1 mol/L提高至2 mol/L时,钙离子交换容量随之增大,A型沸石的结晶度有所提高;当NaOH浓度继续提高至3 mol/L时,钙离子交换容量反而下降,这是由于部分A型沸石转化为孔径更小的方钠石所致。3种合成条件下合成的沸石均满足QB1768—2003[20]标准中钙离子交换容量的要求,具有一定的应用前景。
2.4 白炭黑的分析表征
本研究采用传统沉淀法[21],通过硅酸钠与酸反应制备白炭黑(SiO2),反应式见式(1)。

2.4.1 白炭黑的物相及显微结构
本实验所制备白炭黑的XRD谱图见图8。由图8可见,仅在22°附近有一个弥散状的衍射峰,且峰的强度较小、宽度较大,说明该样品为非晶态结构,谱图中无其他杂峰,说明样品的纯度较高。

图8 所制备白炭黑的XRD谱图
所制备白炭黑的SEM照片见图9。由图9可见,所制备的白炭黑为球形颗粒,粒径为纳米级,未出现规则晶体,表明SiO2以无定型形式存在。

图9 所制备白炭黑的SEM照片
2.4.2 白炭黑的FTIR谱图
本研究所制备的白炭黑的FTIR谱图见图10。由图10可见:在 3 450 cm-1处产生了宽吸收带,推断该吸收带应由—OH产生,且—OH处于与骨架相连状态,由于Si的推电子作用,使—OH氢氧之间的共用电子对的位置发生偏移,造成—OH伸缩振动峰变宽。谱图中1 632 cm-1处是物理吸附水的弯曲振动吸收峰;1 097 cm-1和801 cm-1处的吸收峰分别是Si—O反对称和对称伸缩振动峰;470 cm-1处的吸收峰归属于Si—O的弯曲振动。

图10 所制备白炭黑的FTIR谱图
2.4.3 白炭黑的品质
本实验所制备白炭黑的组成见表1。

表1 白炭黑的组成
本实验所制备白炭黑各项指标与国家标准的对比见表2。

表2 所制备白炭黑各项指标与国家标准的对比
由表2可见,所制备的白炭黑的各项指标均符合HG/T 3065—1999[22]标准。
3 结论
a)在传统碱熔水热合成方法的基础上引入脱硅工艺,从碱熔产物中获得脱硅产物和脱硅滤液,脱硅产物的硅铝摩尔比接近1∶1,脱硅滤液中硅的质量浓度为16.840 g/L,铝的质量浓度仅为0.084 g/L,硅酸钠和硅铝酸钠得到了有效的分离。
b)以脱硅产物为原料,采用水热法合成沸石,在NaOH浓度2 mol/L、晶化时间12 h、晶化温度90 ℃的条件下制备的A型沸石结晶度好,晶相纯度高。所合成的A型沸石的钙离子交换容量满足QB1768—2003标准要求。
c)以脱硅滤液为原料,采用沉淀法制备的白炭黑的SiO2质量分数高达93.72%,其各项指标均符合HG/T 3065—1999标准。
