罗尔斯通氏菌电合成还原CO2产聚羟基丁酸
2022-12-14宋天顺谢婧婧
丛 畅,张 康,宋天顺,谢婧婧
(南京工业大学 生物与制药工程学院,江苏 南京 211800)
工业革命以来,社会和经济快速发展,消耗了化石能源同时严重破坏了生态环境[1-3]。在此过程中,大量的CO2排到了大气中,导致全球变暖,造成了严重的环境问题[4-5]。因此人们开发了CO2捕捉储存技术和CO2转化技术。 CO2捕捉储存技术是利用物理或化学的方法将CO2收集并储存起来[6],但没有将CO2有效利用。CO2转化技术则是通过某种手段将CO2资源化,例如化学还原[7]、光催化[8]和生物还原[9]等。通过这些手段将CO2转化为可以直接利用的化学品,实现CO2的可循环利用。其中,微生物电合成系统 (MES) 是近些年来新兴的一种CO2资源化技术,它具有反应条件较为温和、易于操作、产物可控等优势[10]。
目前,自然界中已知的电自养微生物利用电子的方式分为直接电子传递和间接电子传递[11]。一些自养型微生物可以从电极上获得电子,将CO2转化为二碳化合物或者具有更高附加值的有机化合物[12]。例如,产乙酸菌Sporomusaovata[13]和Clostridiumljungdahlii[14]可通过Wood-Ljungdahl路径,在MES中将CO2转化为乙酸,但合成产物的附加值较低,此外运行过程中需要用质子膜将反应器隔开,增加了反应器的内阻,对反应器的设计有较多限制。因此,寻找高附加值产物是MES未来发展方向。罗尔斯通氏菌(Ralstoniaeutropha)是一种兼性自养革兰氏阴性细菌,可以通过间接电子传递的方式电化学驱动利用CO2,从而在细胞内生产和储存大量的聚合物聚羟基丁酸(PHB)[15-19]。PHB的物理化学性质与传统塑料十分相近,PHB可以被微生物完全降解,对环境无害,可以代替传统的石油基塑料,是一种很有前景的新型环保材料[20-25]。但是传统的发酵方式利用R.eutropha产PHB多以果糖等有机碳源作为原料,生产成本高,能耗大。因此,利用R.eutropha在MES中将CO2转化为PHB, 一方面提高了产物的附加值,并且可在无膜的单室反应器中运行,简化了反应器的设计[26];另一方面使用无机碳源CO2作为原料,实现了CO2资源化,降低了反应成本。但是,目前对于此体系,缺少关于培养基成分和电压大小的系统研究。因此,本文研究电压对R.eutropha利用MES 固定CO2产PHB的影响,并进一步考察氮源和电解质的浓度对反应的影响,以期推动MES在固定CO2产高附加值产物中的应用。
1 材料与方法
1.1 主要材料及仪器
R.eutrophaH16由中国科学院天津工业生物技术研究所毕昌昊研究员惠赠。
LB培养基:蛋白胨10.0 g/L,NaCl 10.0 g/L,酵母膏5.0 g/L。
MM培养基:磷酸缓冲盐36 mmol/L(KH2PO41.5 g/L,Na2HPO4·12H2O 9.0 g/L),(NH4)2SO41.0 g/L,MgSO4·7H2O 0.08 g/L,CaSO4·2H2O 0.001 g/L,NiSO4·7H2O 0.56 mg/L,柠檬酸铁1 mg/L,NaHCO30.2 g/L,pH 6.8。
数据采集器(Keithley Instruments 2700),美国吉时利电子有限公司;电源(WYK-302),扬州华泰电子有限公司;电化学工作站(CHI 660E),上海辰华仪器有限公司;气相色谱仪(GC-2010 Plus),日本岛津有限公司;紫外分光光度计(UV-1100),上海美谱达有限公司;电导率仪(DDS-307A),上海雷磁有限公司。
1.2 MES反应器构建
本文使用单室电解池,结构如图1所示。反应器体积为270 mL,阳极材料为钛铱钌(12.5 cm2),阴极材料为预处理碳毡(10 cm2),其中钛丝作为导线,连接阴极和阳极,并施加一定的电压,Ag/AgCl作为参比电极放入反应器中。利用数据采集器测定阴极的电位和反应电流。实验过程中连续通入体积分数为99.99%的CO2。碳毡在使用前需分别于1 mol/L HCl中浸泡24 h,以去除金属杂质;再用1 mol/L NaOH浸泡24 h,以去除表面吸附有机物;最后用去离子水洗净,接入装置。
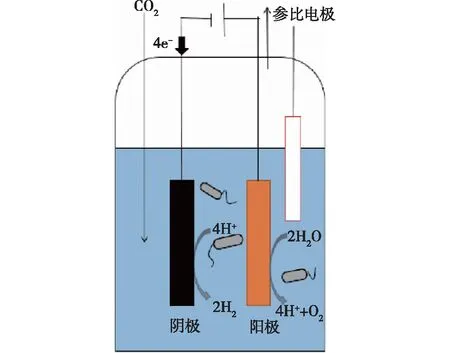
图1 微生物电合成工作原理图
1.3 实验方法
1.3.1 菌株的培养
从-80 ℃取出菌种,在加入硫酸庆大霉素(10 μg/L)的固体LB培养基平板上进行涂布,在30 ℃下培养48 h。然后将其接到包含10 g/L果糖的MM培养基中,在30 ℃、160 r/min 的摇床上活化24 h。培养好的菌液在5 000 r/min的转速下离心5 min,随后倒掉上清液,用MM培养基洗涤2次并重悬浮后备用。
1.3.2 MES反应器的接种和运行
反应器灭菌后,在超净工作台中加入200 mL的MM培养基。接种前,在反应器的两端施加电压,密封后通入CO2运行24 h。将培养好的菌液接入反应器中,加入MM培养基将菌液稀释至生物量(OD600)为0.1~0.2的溶液, CO2通气速率为10 mL/min,定期取样,测定PHB浓度。
1.4 分析方法
1.4.1 PHB的测定
样品经8 000 r/min离心10 min后倒掉上清液,置于60 ℃烘干并称质量,其质量为细胞的干质量(DCW)。加入2 mL氯仿和2 mL甲醇(含3% H2SO4)到干燥的样品中,105 ℃加热6 h。冷却至室温后,加入1 mL蒸馏水振荡1 min,静置溶液至分层后取下层有机相进行分析[27]。PHB浓度通过配备有氢离子火焰检测器(FID)的气相色谱仪检测。气相色谱条件:色谱柱为Agilent HP-INNOWax 毛细管柱(30 m×0.25 mm×0.25 μm);进样口温度为220 ℃;检测器温度为250 ℃。色谱柱升温程序:50 ℃保持2 min,然后以10 ℃/min升至220 ℃,平衡时间为2 min,共 21 min。载气为超纯N2,流速为1.32 mL/min。
1.4.2 H2含量的测定
采用配有热导检测器(TCD)的气相色谱仪,在正常工作的MES反应器上空取样进行H2含量的测定。色谱柱为 Porapak Q 填充柱;进样口温度为120 ℃;TCD检测器温度为100 ℃;色谱柱温度为60 ℃,保留5 min,无升温程序;载气为超纯N2;CO2作为吹扫气。测量前使用超纯N2连续吹扫30 min使系统脱氧。
1.4.3 DCW的计算
DCW与OD600线性相关,通过监测OD600来计算DCW[28-29],计算方法见式(1)。
DCW=0.469 5×OD600
(1)
2 结果与讨论
2.1 电压对MES系统的影响
3.0、3.5、4.0和4.5 V时,考察MES的性能,结果见图2。由图2可知:所有MES的OD600初始值约为0.13;除4.5 V电压外的其余电压下,OD600随着时间的延长皆不断变大,在实验结束时,4.0 V的OD600最高(0.84);而4.5 V电压下的OD600只在第1天略有增大,随后不断减小。整体来说,4.5 V时的电流和阴极电势最高(电位绝对值),约为78 mA和-1.35 V(7 d),4.5 V下的H2含量明显高于其他实验组,H2体积分数达到1.60%。由结果可看出,在不超过4.0 V的情况下,细菌的生长状况与电压呈正相关关系,但在4.5 V时细菌基本不能生长。这是由于在4.5 V电压下,反应电位增大,提高了产氢速率的同时,阳极产氧速率也会增加,并且O2会在阴极发生还原反应产生H2O2,从而严重抑制细菌生长[30]。因此,在反应结束后,测定了溶液中H2O2的含量,4.5 V下溶液中的H2O2浓度(37.24 μmol/L)远高于4.0 V电压的(4.91 μmol/L)。反应结束后,将菌液进行稀释并涂布培养24 h,观察微生物生长情况,结果见图3。由图3可见:4.5 V电压下的细菌数量要低于4.0 V的,从而证明了4.5 V下,过量的O2在阴极还原产生了H2O2,从而抑制细菌的生长。
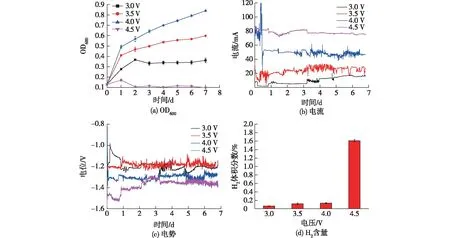
图2 不同电压下MES中的OD600、电流、电势和H2含量

图3 反应结束后菌液在LB平板上稀释涂布
为了进一步分析电压对MES的影响,测定体系中PHB产量。菌液中PHB质量浓度(ρ)和细胞内PHB含量(质量分数(w),以细胞干质量计算)随时间变化结果见图4。由图4可知:不同电压下,PHB质量浓度都在第1天达到最大值,此时3.5 V(62.2 mg/L)和4.0 V(58.2 mg/L)下PHB质量浓度较高,随后为3.0 V(51.1 mg/L),都远高于4.5 V的(8.7 mg/L)。细胞内PHB含量随时间延长的变化趋势也是一样,都在第1天达到最大值随后逐渐下降。4.5 V时因细胞生长受到抑制,PHB含量一直保持在较低的水平;3.0、3.5、4.0 V时则是由于细胞在快速生长的同时消耗胞内积累的PHB,导致随后PHB含量的快速下降,使得PHB在细胞中不能持续累积[31]。因此,综合考虑细胞生长情况,选择4.0 V电压进行后续实验研究。
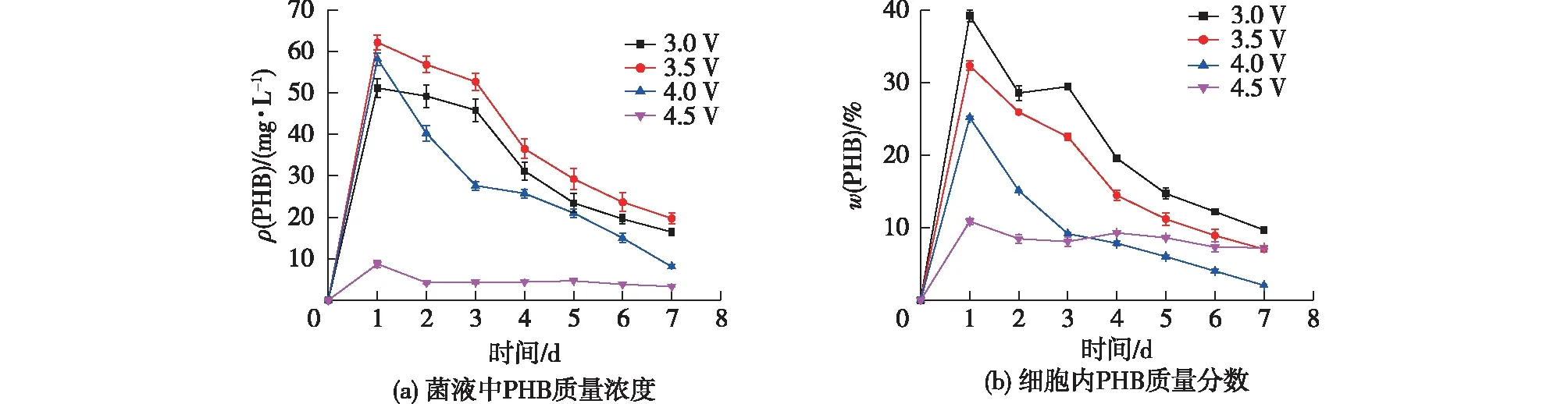
图4 不同电压下PHB质量浓度和PHB含量
2.2 氮源浓度对MES的影响
在气体发酵体系中,可以通过改变发酵条件来调控R.eutropha选择性合成PHB,比如改变碳源或氮源的浓度[32-33]。因此,本文分别使用质量浓度为0.1、0.2、0.5和1.0 g/L的(NH4)2SO4,研究氮源浓度对MES性能的影响,结果见表1和图5。由表1和图5可知:当(NH4)2SO4质量浓度从1.0 g/L降到0.2 g/L时,体系中的电导率和盐度都会随着(NH4)2SO4质量浓度减小而减小,同时,整体的OD600也呈现下降趋势。当初始(NH4)2SO4质量浓度继续降至0.1 g/L时,OD600急骤下降,这可能是因为过少的氮源不足以支撑细菌的大量增殖[34]。随(NH4)2SO4质量浓度减小,电流也不断下降,这可能和溶液电导率下降有关。(NH4)2SO4质量浓度为0.1 g/L时的H2体积分数(0.52%)要显著高于其他浓度的,这可能是因为0.1 g/L时的菌体数量最低,导致对H2的消耗要少于其他实验组。
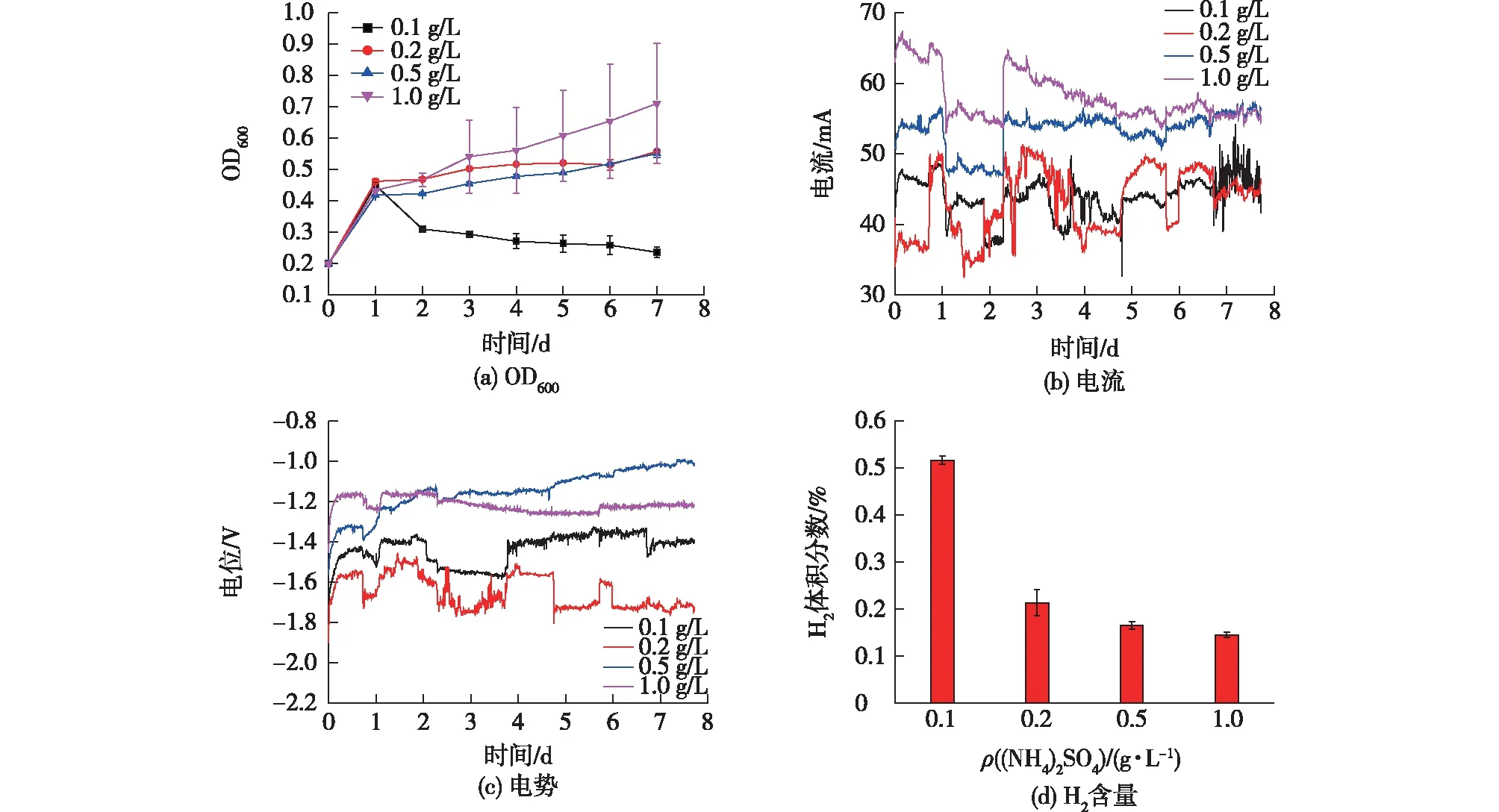
图5 不同氮源浓度下的OD600、电流、电势和H2含量

表1 不同(NH4)2SO4质量浓度下的电导率和盐度
研究(NH4)2SO4质量浓度对菌液中PHB质量浓度和细胞内PHB含量的影响,结果见图6。由图6可知:当(NH4)2SO4质量浓度从1.0 g/L降到0.1 g/L时,菌液中PHB不断累积,PHB产量呈增大趋势。(NH4)2SO4质量浓度为0.2 g/L时,PHB质量浓度获得了显著的提升,最大值达到了191.2 mg/L,同时细胞中PHB的质量分数也有了显著的增大,最大值达到78.2%。这说明通过改变氮源的浓度可以实现PHB在细胞内的持续累积。
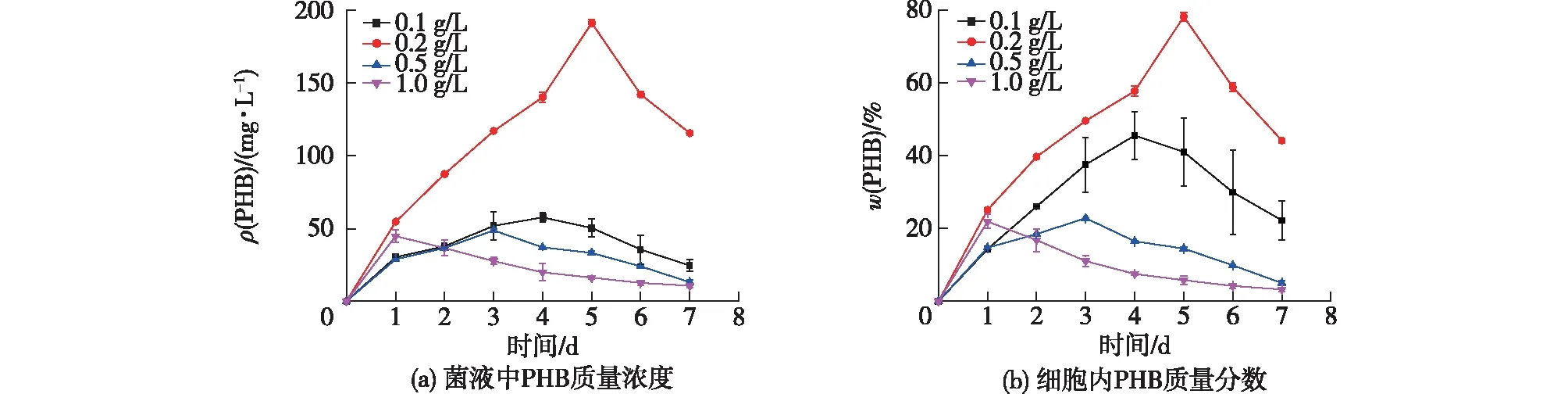
图6 不同氮源浓度下的PHB质量浓度和PHB含量
当氮源充足时,细胞内的代谢碳通量主要流向TCA循环[35],为细菌的生长和繁殖提供能量。而当氮源不足时,细菌的生长和增殖减慢至停止,并刺激细菌内部某些相关基因的表达,促使代谢碳通量开始转向PHB的合成,从而强化了胞内PHB合成路径,进而提高了PHB的产量[36]。所以合适的氮源浓度在此体系内极为关键,故选择0.2 g/L为最优的(NH4)2SO4氮源质量浓度。
2.3 电解质浓度对MES的影响
通过调节磷酸缓冲盐浓度(36、54、108 mmol/L),研究不同电解质浓度对MES体系的影响,结果见表2和图7。由表2和图7可得:随电解质浓度增大,电导率和盐度也相应增大。电解质浓度为36和54 mmol/L时,OD600随时间延长不断地增大,而电解质浓度为108 mmol/L时,前3天OD600有所增大但增大率略低于36和54 mmol/L的,从第4天开始OD600不断减小,这可能是因为高盐度对细菌有抑制作用。体系中的电流随电解质浓度的增大而增大,这是因为电解质浓度的增大有效提高了溶液的电导率。阴极电位和H2含量也是随着电解质浓度的增大而增大。电解质浓度为108 mmol/L时的H2体积分数最高(2.7%),其次为54 mmol/L时的(0.8%),最低为36 mmol/L时的(0.3%)。

表2 不同电解质浓度下的电导率和盐度

图7 不同电解质浓度下的OD600、电流、电势和H2含量
研究电解质浓度对菌液中PHB质量浓度和细胞内PHB含量的影响,结果见图8。由图8可知:在电解质浓度为36和54 mmol/L时,电解质浓度的变化对菌液中PHB质量浓度影响不大,都在第5天达到了最高值,最高值分别为167.7和148.6 g/L,同时细胞内PHB的质量分数也有相似的规律,第5天达到了73.7%和70.8%。但在电解质浓度为108 mmol/L时,细胞内PHB的质量分数最高只能达到58.53%。这可能是因为电解质浓度增大使得体系盐度增大,从而抑制了细菌的生成。综合考虑实验效果,电解质浓度选择36 mmol/L。

图8 不同电解质浓度下的PHB质量浓度和PHB含量
3 结论
1)电压对体系中细菌的生长速率具有重要的影响,电压的提高会促进细菌的生长,提高体系的电流,4.0 V下细菌的生长速率最快,但是当电压增大到4.5 V时,会使体系中H2O2大量积累,从而抑制细菌的生长。
2)氮源浓度对体系中细菌累积PHB起决定性作用,过高的氮源浓度会抑制PHB的合成,氮源过低又会抑制细菌的生长进而影响PHB的合成,在本体系中,氮源质量浓度为0.2 g/L时,可以有效地促进细菌生长,并使得PHB在体系内持续累积,体系内PHB的产量最大。
3)电解质浓度会影响体系的电导率和盐度,从而影响到微生物的生长和体系中的反应,适宜的电解质浓度为36 mmol/L。
