穴位电刺激对卒中后抑郁大鼠行为学及神经递质水平影响
2022-12-14马伊笛孙晓伟
马伊笛,孙晓伟,运 锋△
(1.黑龙江中医药大学,黑龙江 哈尔滨 150040;2.黑龙江中医药大学附属第一医院,黑龙江 哈尔滨 150040)
卒中后抑郁(Post-Stroke Depression,PSD)是卒中患者患病后常见并发症之一,其临床表现除卒中症状外,还伴有乏力、嗜睡、焦虑、情绪低落和兴趣缺失等情感障碍及躯体症状。有研究表明,卒中患者中约有33.3%的幸存者患有PSD[1]。在我国,卒中后14 d PSD发病率约28.4%,卒中后1年,发病率可高达41.8%[2]。
PSD不仅不利于卒中患者机体功能恢复,其发病也与卒中幸存者死亡率升高密切相关[3]。关于PSD的发病机制,目前有下丘脑-垂体-肾上腺 (HPA) 轴功能障碍、炎症反应、单胺类神经递质水平降低、谷氨酸水平升高引发兴奋性毒性和神经可塑性降低等多种假说。目前,针对PSD的治疗主要有3种方式,即药物治疗、心理治疗和社会干预。所有治疗方法中又以药物治疗为主,常用药物包括三环类药物(TCA)、选择性5-HT再摄取抑制剂(SSRIs)、5-HT和NE再摄取抑制剂(SNRIs)以及MAO抑制剂等。但有研究表明,常用的抗抑郁药有导致包括出血性并发症、跌扑和药物依赖等不良后果的风险[4]。针灸是中医传统非药物治疗手段之一,在卒中后遗症治疗领域应用广泛,且具有良好临床疗效。多项临床研究均表明针刺可有效治疗PSD,但其起效机制尚需系统研究。本研究通过建立大鼠PSD模型,观察电刺激百会、内关、大椎与太冲对模型大鼠抑郁样行为及神经递质水平的影响,并探究其作用机制与CREB/BDNF/TrkB信号通路的关系,以期以实验室病理生理数据结果为电刺激法针灸治疗PSD的临床应用提供理论依据。
1 实验材料
1.1 实验动物
36只健康SPF级Wistar大鼠,雄性,体质量180~220 g,来源为黑龙江中医药大学动物实验中心,许可证编号:SCXK(黑)2018-001。大鼠于恒温(22~25℃)、恒湿(65%~70%)、自然采光和充足自由饮水条件下饲养,饲养环境及方法参考《动物实验管理条例》,严格遵循要求。
1.2 实验试剂及仪器
1.2.1 仪器 敞箱(100 cm×100 cm×50cm,友诚嘉业生物科技有限公司);荧光定量PCR仪(ABI7000,Applied Biosystems,赛默飞世尔科技有限公司);酶标仪(VersaMax,美谷分子仪器有限公司);台式冷冻离心机(Biofugestratos,Heraeus科技有限公司);涡旋混匀仪(Vortex-QL-901,其林贝尔仪器制造有限公司);大脑中动脉阻塞模型线栓(MSRC43B260PK50,瑞沃德生命科技有限公司);无菌针灸针(环球牌,苏州针灸用品有限公司,规格:0.30 mm×25 mm);华佗电子针疗仪(SDZ-Ⅱ型,苏州医疗用品有限公司);非吸收性外科缝线(3-0,华翔医疗器械厂有限公司);一次性窄刀片(LEICA819,德国LEICA公司)。
1.2.2 试剂 总RNA提取试剂、RT-PCR技术盒(宝日医生物技术有限公司);PCR Mix(升博生物科技有限公司);BDNF ELISA试剂盒(SP12323,赛培生物科技有限公司);5-HT ELISA试剂盒(SP12579,赛培生物科技有限公司);蔗糖(S8271,索莱宝科技有限公司);注射用青霉素钠(批号F7032124,国药准字 H13020657,华北制药股份有限公司)。
2 实验方法
2.1 模型建立
模型组、治疗组大鼠采用改良Zea Longa线栓法联合慢性不可预知温和刺激法建立PSD模型。假手术组大鼠区别于模型组及治疗组,仅对动脉进行分离但不结扎,消毒后直接进行常规缝合。
2.1.1 卒中模型构建 参考已有实验案例,采用改良Zea Longa线栓法对模型组及治疗组大鼠进行造模[5]。大鼠采用腹腔注射法进行麻醉,麻醉后于左侧颈部剪开,对颈部肌群进行钝性分离,同时分离颈总动脉及颈内、外动脉。将颈总动脉近心端和颈外动脉结扎,于远端夹闭颈内动脉后,在颈总动脉附近约1 cm处剪开,沿切口插入尼龙线至颈内动脉,插入深度约2 cm。完成线栓插入后扎紧动脉残端,消毒后进行常规缝合。术后对大鼠给予青霉素腹腔注射以预防感染。注射剂量4万U/d,连续3 d。
2.1.2 卒中后抑郁模型构建 抑郁模型构建采用慢性不可预知温和刺激法(Chronic unpredictable mild stress,CUMS)[6]。模型组及治疗组大鼠于清醒后第7天开始,每天选择一种应激方法进行刺激。应激方法共选用7种,包括水平振荡(时长30 min,频率160次/min)、夹尾(时长1 min)、昼夜颠倒(周期24 h)、4 ℃冰水游泳(时长5 min)、禁水(时长24 h)、禁食(时长24 h)和足底电击(时长30 min,电流强度1 mA,每次电击1 s,频率1次/min)。造模过程中同一种方法不连续出现,连续刺激3周。
PSD造模结束后第2天对模型构建情况进行评价,模型构建成功标准为Zea Longa神经行为学评分1~3分,敞箱实验评分及糖水消耗百分比低于假手术组且差异具有统计学意义(P<0.05)。
2.2 干预方法
造模1 d后开始干预。治疗组采用百会、内关、大椎和太冲电针刺激进行干预,腧穴定位参考《实验针灸学》和《实验动物常用穴位名称与定位》中百会穴、内关穴、大椎穴与太冲穴位置[7-8]。通过自制大鼠固定器将大鼠进行固定,大鼠清醒状态下,选用直径0.3 mm无菌针灸针分别针刺百会、内关、大椎与太冲。其中大椎直刺,百会、太冲与内关向后平刺入皮肤,针刺深度约2 mm。进针后连接电针仪,设置疏密波,电压峰值6 V,频率1/20 Hz,以针体轻抖且动物耐受为得气,持续治疗15 min。治疗频率1次/d,连续治疗21 d。假手术组、模型组大鼠正常饲养,每天与治疗组大鼠同时捆绑固定15 min,但不进行电针干预。
2.3 行为学指标检测方法
各组大鼠于PSD造模结束后第2天和干预4周后分别进行行为学指标检测。
2.3.1 Zea Longa神经行为学评分 评分标准:活动自如,无明显神经功能缺失表现,视为无缺损,计0分;活动基本自如,但提尾时左侧前肢屈曲且不能伸展,视为轻度缺损,计1分;爬行时出现活动障碍,具体表现为追尾或向左侧划圈情况,视为中度缺损,计2分;爬行困难,出现严重障碍,身体向左侧倾倒,视为重度缺损,计3分;意识丧失,完全不能爬行,视为无神经功能,计4分[9]。
2.3.2 糖水消耗实验 于各组鼠笼两侧分别放置1个水瓶,1瓶为纯净水,另一瓶为1%蔗糖水。大鼠自由饮水48 h,每12 h对换1次水瓶位置。实验测定前,大鼠禁食禁水24 h,再次于鼠笼两侧放置纯净水和糖水,3 h后记录各组纯净水和糖水消耗量,依据公式计算糖水消耗百分比并记录。(计算方法:糖水消耗百分比=[糖水消耗量/(糖水消耗量+纯净水消耗量)]×100%)[10]。
2.3.3 敞箱实验 选用100 cm×100 cm×50 cm的敞箱,将各组大鼠依次放入敞箱对边中线交点,大鼠自由活动,5 min内分别记录各组大鼠水平及垂直活动情况。水平活动计分以大鼠三足跨入邻格为标准,1次计1分;垂直活动以大鼠双前肢离开地面为身体直立标准,1次计1分[11]。
2.4 取材及生化指标检测方法
2.4.1 取材方法 行为学测试结束后,对大鼠进行腹腔注射麻醉。大鼠进入麻醉状态后,采用腹主动脉取血法,每只大鼠取血5 mL。将采血管静置2 h后经冷冻离心机以离心温度4 ℃,功率3 000 r/min,离心半径10 cm为条件离心15 min。离心后取上层血清放入冻存管,于-80 ℃冰箱保存备用。取血后立即断头取脑,在冰盘上迅速剥离海马组织,冲洗后液氮保存备用。
2.4.2 ELISA法检测大鼠血清5-HT、BDNF含量 依据大鼠5-HT、BDNF ELISA试剂盒说明书,取-80 ℃保存的血清于恒温水浴锅中复温。复温后,分别根据试剂盒要求依次添加已配置好的试剂操作,反应终止后采用多功能酶标仪于450 nm波长处对OD值进行检测。
2.4.3 实时荧光定量PCR法检测大鼠海马BDNF、TrkB及CREB mRNA表达水平 取液氮中保存的大鼠海马组织,采用Trizol法提取总RNA后进行反转录,测定BDNF、TrkB及CREB mRNA的相对表达量。反应条件依次为:95 ℃ 10 min,95 ℃ 30 s、55 ℃ 45 s和72 ℃ 30 s循环40次,54 ℃ 5 min。内参选用GAPDH,按照2-△△Ct法分析BDNF、TrkB及CREB mRNA相对表达水平。引物序列见表1。
2.5 统计学处理


表1 BDNF、TrkB及CREB mRNA引物序列
3 结果
模型制备过程中有4只大鼠因操作不当死亡,1只大鼠模型构建失败,予以剔除。最终假手术组10只、模型组9只和治疗组12只大鼠纳入观察。
3.1 各组大鼠行为学指标比较
造模后,模型组、治疗组大鼠与假手术组大鼠比较,Zea Longa神经行为学评分升高、蔗糖消耗百分比降低、敞箱实验水平及垂直评分均降低,且差异均具有统计学意义(P<0.05),提示大鼠PSD模型构建成功。见表2。
干预后,与假手术组比较,模型组大鼠Zea Longa神经行为学评分升高、蔗糖消耗百分比降低、敞箱实验水平及垂直评分均降低(P<0.05);与模型组比较,治疗组大鼠Zea Longa神经行为学评分降低、蔗糖消耗百分比升高、敞箱实验评分升高(P<0.05)。见表2。
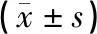
表2 各组大鼠行为学指标比较
3.2 各组大鼠血清5-HT、BDNF含量比较
干预后,与假手术组比较,模型组大鼠血清5-HT及BDNF含量均明显降低(P<0.05);与模型组比较,治疗组大鼠血清5-HT及BDNF含量均明显增高(P<0.05)。见表3。
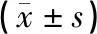
表3 各组大鼠血清5-HT、BDNF含量比较
3.3 各组大鼠海马BDNF、TrkB、CREB mRNA表达水平比较
干预后,与假手术组比较,模型组大鼠海马组织中BDNF、TrkB及CREBmRNA相对表达水平显著降低(P<0.05);与模型组比较,治疗组大鼠海马组织中BDNF、TrkB及CREB mRNA相对表达水平显著增高(P<0.05)。见表4、图1。
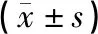
表4 各组大鼠脑组织BDNF、TrkB、CREB mRNA相对表达水平
4 讨论
目前,我国卒中发病率持续增高,其治疗及后期康复给人民家庭及社会带来沉重负担[12]。作为卒中常见并发症之一,PSD会导致疲劳、情绪低落甚至自杀倾向等多种不良状态,严重影响了卒中患者的机体功能恢复及心理健康情况,同时也为患者家庭及社会带来了沉重负担。关于PSD的风险因素及发病机制,目前尚无统一定论。目前针对PSD风险因素研究主要涉及年龄、抑郁病史、卒中严重程度与发病部位等,但其中尚有一些因素存在争议,需进一步探索求证[13-16]。关于PSD的发病机制,目前主要有下丘脑-垂体-肾上腺 (HPA) 轴功能障碍、单胺类神经递质水平降低、炎症反应和神经可塑性降低等假说。HPA轴作为机

注:图中曲线从右到左依次为假手术组、模型组和治疗组。图1 qPCR扩增曲线
体主要神经内分泌应激反应系统之一,与情绪调节、免疫反应和新陈代谢等多个生理功能密切相关。HPA轴的过度活跃被认为是重度抑郁症最突出的表现之一[17]。糖皮质激素及其受体是 HPA 轴的重要组成部分,有相关研究表明,糖皮质激素受体表达情况与抑郁样行为密切相关[18]。作为机体重要生理病理反应之一,炎症反应与多种疾病的发生发展密切相关,在疾病治疗机制研究中占有重要地位。基于既往研究结果可以看出,白细胞介素-1α (IL-1α)、白细胞介素-1β (IL-1β)、白细胞介素-6 (IL-6)以及肿瘤坏死因子-α (TNF-α)等促炎细胞因子均与抑郁症存在紧密联系[19]。卒中作为一种大脑创伤,可以在受伤的大脑区域引发强烈的炎症反应,导致受损的神经元释放促炎细胞因子,激活小胶质细胞,最终引起PSD[20]。多巴胺(DA)、去甲肾上腺素(NE)和5-羟色胺(5-HT)等单胺类神经递质对大脑的生理功能有着至关重要的影响。抑郁症相关研究显示,抑郁症患者大脑中的 5-HT 水平普遍低于健康人群,这一现象在 PSD 患者中同样存在[21]。目前,血浆5-HT浓度变化已成为用于预测中风后精神疾病的重要临床指标。神经营养因子是一种大型多肽类化合物,在中枢和外周神经系统结构的发育和维持中均占有重要地位。作为中枢神经系统 (CNS) 中含量最为丰富、分布最为广泛的神经营养因子,脑源性神经营养因子 (BDNF) 具有调节神经元存活、迁移、表型分化、轴突和树突生长以及影响突触形成等多种生理功能。所以,BDNF水平的变化对突触可塑性、突触生理行为等神经生理活动均具有关键作用。有研究发现,PSD患者血清中的BDNF浓度明显低于正常人,而缺乏BDNF可导致抑郁状态发展。因此。血清BDNF现也被视为是PSD的生物标志物之一[22-23]。本实验通过检测大鼠血清5-HT、BDNF含量发现,经百会、内关、大椎和太冲穴位电刺激治疗后,PSD大鼠血清5-HT、BDNF含量明显高于模型组大鼠,提示百会、内关、大椎与太冲穴位电刺激治疗可调节机体单胺类神经递质及神经营养因子含量,对PSD具有治疗作用。
现代中医理论将PSD归于“中风”“郁证”等范畴,临床表现为情绪低落、神情呆滞等,认为其治疗应从脑、肝和肾等脏腑入手。《黄帝内经》中提出,肝主情志、肾主藏精纳气。肝失疏泄会导致肝气郁结、情志不舒与痰瘀互结阻塞于脑窍。而肾气不足则无法充养脑髓,导致神机失用。所以PSD的发病,虽主要病位在脑,但与肝肾关系同样密切。针灸是传统中医疗法之一,具有疏通经络、调和阴阳、气血同治和标本兼顾的功效特点,在临床被广泛应用于多种疾病的治疗及恢复。近年有研究发现,针刺疗法具有干预中枢及外周迷走神经、调节神经递质传递和提高神经功能的疗效,可用于治疗PSD,改善抑郁状态,促进机体功能恢复,且治疗效果良好[24-25]。与常规针刺相比,电针具有刺激量强、方便灵活和针感持久等优势,已成为临床针灸治疗的常用辅助手段,其疗效已得到广泛认可。目前临床针刺治疗PSD主要以“调神”为核心治则,常选用“百会”“内关”“太冲”“神庭”“大椎”等穴。百会穴属督脉,《针灸甲乙经》中称其为“三阳五会”,为手足三阳经与督脉交会穴,具有醒脑调神、宣阳开郁的功效。内关穴为心包经络穴,同时也是八脉交会穴之一,与阴维脉相通,具有调节情志、安养元神的功效。太冲穴为肝经原穴,具有行气通络、疏肝解郁的功效。大椎穴为督脉与诸阳经交会穴位,具有通督行气、调神醒脑的功效。因此,本研究选取百会、内关、太冲和大椎4穴进行电刺激干预治疗。本实验通过对比各组大鼠行为学实验结果发现,与模型组大鼠相比较,治疗组大鼠的神经功能明显改善,缺损情况减轻,评分降低。蔗糖偏好率及敞箱实验评分有所提高,提示电针百会、内关、太冲与大椎4穴可有效改善PSD模型大鼠神经功能缺损及抑郁症状,对PSD有明显治疗作用。
BDNF作为CNS中广泛分布的神经营养因子之一,在PSD发病和治疗方面具有重要意义。BDNF与机体内5-HT水平调节具有密切联系。有多项研究表明,BDNF可提高5-HT及其代谢物水平,增加5-HT神经元轴突数量,提高5-HT合成相关基因表达[26-28]。作为BDNF受体之一,TrkB蛋白也与神经功能调节密切相关。在与BDNF结合后,TrkB可通过启动细胞内信号转导促进神经元发育表达,进而修复神经损伤,以此发挥抗抑郁作用[29]。有研究证实,机体TrkB的缺乏可导致焦虑行为增多[30]。CREB是一种细胞转录因子,有研究显示,其与BDNF表达水平及包括抑郁症在内的多种情绪障碍关系密切[31]。CREB可与BDNF-TrkB信号传导途径共同组成一个正反馈通路,TrkB与BDNF结合后可将CREB磷酸化,而磷酸化的CREB可随后激活BDNF,增强 TrkB 信号[32]。基于CREB/BDNF/TrkB与5-HT及PSD的密切关系,本实验对各组大鼠海马组织中CREB、BDNF及TrkB mRNA水平进行了比较,结果发现,对比模型组大鼠,治疗组大鼠3种蛋白mRNA表达情况均显著提升,提示电针百会、内关、太冲和大椎共4穴可上调大鼠CREB/BDNF/TrkB信号通路表达,结合酶联免疫结果推测,其可能是电针百会、内关、太冲和大椎治疗PSD机制之一。
综上所述,电刺激百会、内关、太冲与大椎穴可改善PSD大鼠神经功能,调节PSD大鼠抑郁状态,提高大鼠单胺类神经递质及神经营养因子水平,其作用机制可能与上调CREB/BDNF/TrkB信号通路有关。未来研究中,可对电刺激治疗PSD的具体下游机制及神经修复情况进行进一步探索研究,为临床治疗PSD提供更可靠、更明确和更具实践意义的临床诊疗依据及研究基础。