基于网络药理学和ApoE-/-小鼠动脉粥样硬化模型探究血府逐瘀汤治疗冠心病的核心作用靶点及机制研究
2022-12-13马淑慧董静王少兰李敏杰王海芳赵学飞
马淑慧,董静,王少兰,李敏杰,王海芳,赵学飞
目前,心血管疾病是我国城乡居民的首位死亡原因。《中国心血管健康与疾病报告2020》估测,我国冠心病现患人数约1 139万例,其发病率及死亡率均呈逐年上升趋势[1]。冠心病的危险因素包括高脂血症、高血压、糖尿病和吸烟等,其中血脂代谢异常是动脉粥样硬化斑块形成的重要原因,斑块破裂是引起冠心病患者死亡的主要原因,且常规抗血小板治疗、降脂治疗及支架置入并未使冠心病患者心血管不良事件发生率和死亡率明显降低。
动脉粥样硬化的中医病机不外虚实两端,以实证居多,气滞、血瘀、痰饮、寒凝等阻痹胸中,致经脉闭阻、气血运行不畅而发病,故在治疗过程中多以行气、活血、化瘀、通络为法。血府逐瘀汤是由王清任在《医林改错》中提出,主治胸中血瘀证,其活血祛瘀、理气止痛之功效能有效缓解气滞血瘀所致的胸痹症状[2]。临床研究表明,血府逐瘀汤化裁治疗在改善患者局部微循环、增加心肌供血、减轻心绞痛症状及降低血脂等方面具有良好效果[3-5]。但血府逐瘀汤具有复杂的药物活性成分,可多层次、多途径、多靶点发挥作用,而网络药理学可以从系统层次解释复杂药物治疗疾病的机制,但这种方法仅具有理论价值,尚缺乏实证研究。本研究基于网络药理学探索血府逐瘀汤治疗冠心病的潜在核心作用靶点,然后制备ApoE-/-小鼠动脉粥样硬化模型进行验证,以期为血府逐瘀汤治疗冠心病的机制研究提供科学依据。
1 资料与方法
1.1 血府逐瘀汤药物活性成分及作用靶点筛选 血府逐瘀汤由桃仁、红花、川芎、赤芍、当归、牛膝、柴胡、桔梗、枳壳、地黄、甘草11味中药组成。在TCMSP数据库筛选血府逐瘀汤的药物活性成分,筛选条件:口服生物利用度(oral bioavailability,OB)>30%,类药性(drug-likeness,DL)>0.18;并在2015版《中国药典》中查询血府逐瘀汤11味中药必须含有的药物活性成分进行补充。结合上述药物活性成分并通过FAFDrugs4数据库筛选血府逐瘀汤的药物活性成分,之后通过化合物靶标数据库Swiss TargetPrediction、SEA和Drugbank分别查询各药物活性成分的靶点,合并药物活性成分靶点并去重,之后使用UniProt数据库的official gene symbol统一命名。
1.2 冠心病致病靶点筛选 以“coronary heart disease”和“coronary atherosclerotic heart disease”为检索词,在Drugbank、GeneCards、OMIM、PharmGKB、TTD等疾病数据库中查找冠心病致病靶点,选取可能性>0.1的致病靶点,合并致病靶点并去重,之后使用UniProt数据库的official gene symbol统一命名。
1.3 交集靶点筛选及成分-靶点网络构建 使用在线网站Jvenn(http://www.bioinformatics.com.cn/static/others/jvenn/example.html),输入血府逐瘀汤药物活性成分靶点和冠心病致病靶点,获得药物-疾病交集靶点。使用Cytoscape(Version 3.9.0),将交集靶点导入Cytoscapebing以构建成分-靶点网络,计算度值(Degree),并根据度值大小定义各节点高度以反映节点的重要性。
1.4 核心靶点分析 将药物-疾病交集靶点上传至STRING数据库,构建蛋白-蛋白互作(protein-protein interaction,PPI)网络,置信度选择中等(0.75),隐藏无连接靶点,然后下载PPI网络文件。使用Cytoscape软件中的Cytohubba插件(用于PPI网络中的核心靶点)计算各靶点度值、最大基团中心性(maximal clique centrality,MCC)、最大邻域分量(maximum neighborhood component,MNC)和边过滤成分(edge percolated component,EPC)评分,提取同时满足上述算法的前10个靶点并在Jvenn在线网站进行交集处理,得到PPI网络中的核心靶点。
1.5 GO功能、KEGG通路富集分析 获得药物-疾病交集靶点后,使用在线网站OmicShare(https://www.omicshare.com/tools/)进行GO功能和KEGG通路富集分析,根据基因富集率和q值(校正后的P值)展示GO功能富集分析中生物学过程(biological process,BP)、细胞成分(cellular component,CC)和分子功能(molecular function,MF)共同排序前5位的结果条目及KEGG通路富集分析中信号通路排序前5位的信号通路。
1.6 制备ApoE-/-小鼠动脉粥样硬化模型 5~6周龄雄性C57BL/6小鼠7只和ApoE-/-小鼠30只均购自北京维通利华实验动物技术有限公司〔实验动物生产许可证:SCXK(京)2021-0006〕,体质量16~20 g,饲养于SPF级环境中的独立通气笼( individually ventilated cages,IVC),自由饮水饮食,12 h光照/黑暗循环,环境温度维持在25 ℃左右。适应性饲养1周。小鼠分组如下:(1)低脂对照组:C57BL/6小鼠7只,进食低脂饲料;(2)高脂模型组:ApoE-/-小鼠10只,进食高脂饲料;(3)低剂量灌胃组:ApoE-/-小鼠10只,进食高脂饲料,然后每10 g鼠重给予0.1 ml血府逐瘀汤药液(1 g/ml)灌胃,每日固定时间灌胃1次;(4)高剂量灌胃组:ApoE-/-小鼠10只,进食高脂饲料,然后每10 g鼠重给予0.1 ml血府逐瘀汤药液(2 g/ml)灌胃,每日固定时间灌胃1次。高脂/低脂饲料均购自南通特洛菲饲料科技有限公司。饲养周期为3个月,之后使用异氟烷麻醉小鼠,眼球取血后处死小鼠,并摘取胸腹主动脉样本。所有小鼠饲养方法和操作方法符合陕西中医药大学实验动物福利与伦理相关规定。
1.7 血府逐瘀汤药液制备 桃仁12 g,红花、当归、生地黄、牛膝各9 g,川芎、桔梗各4.5 g,赤芍、枳壳、甘草各6 g,柴胡3 g,均购自陕西中医药大学第二附属医院药剂科。每剂中药使用2 L水煎至300 ml,然后使用宁波新芝冷冻干燥机(SCIENTZ-10N)收集汤剂的干燥粉末,冷藏于-80 ℃超低温冰箱。使用灭菌用水将干燥粉末调配为1 g/ml和2 g/ml的药液。
1.8 全自动生化分析仪检测小鼠血清血脂指标 获得小鼠血液后,室温静置30 min,3 000 r/min(离心半径4.5 cm)离心10 min,获取上层血清,使用日立7180全自动生化分析仪检测血清LDL、HDL、TC、TG。
1.9 HE染色和Masson三色染色 采用多聚甲醛固定小鼠胸腹主动脉样本,常规石蜡包埋、切片、脱蜡、复水,分别进行HE染色和Masson三色染色,严格按照HE染色试剂盒(G1120,Solarbio)和Masson三色染色试剂盒(G1340,Solarbio)说明书进行操作。使用玻片扫描系统(Slideview VS200,Olympus)扫描组织样本后,使用Image J分别计算胶原纤维面积/斑块总面积、斑块总面积/血管腔面积。
1.10 免疫组化染色 采用多聚甲醛固定小鼠胸腹主动脉样本,常规石蜡包埋、切片,使用二甲苯和梯度乙醇溶液脱蜡,然后使用枸橼酸进行抗原修复、3%过氧化氢阻断内源性过氧化物,之后使用3% BSA组织封闭1 h,使用缺氧诱导因子1α(hypoxia inducible factor-1α,HIF-1α)(1∶200,Abmart)和血管内皮生长因子2型受体(vascular endothelial growth factor receptor 2,VEGFR2)(1∶200,Abmart)孵育过夜,次日使用二抗(HRP标记)孵育1 h,然后使用DAB显色,苏木素复染细胞核,梯度乙醇溶液、正丁醇和二甲苯脱水,最后使用中性树脂封固。使用玻片扫描影像系统(SQS-40P,深圳市生强科技有限公司)扫描组织,使用Image J计算阳性面积/斑块总面积。
1.11 统计学方法 应用Graphpad Prism 9.0软件进行数据处理。符合正态分布的计量资料以(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用Tukey检验;使用Graphpad Prism 9.0软件绘制条形图。以q或P<0.05为差异有统计学意义。
2 结果
2.1 血府逐瘀汤药物活性成分及作用靶点 在TCMSP数据库中筛选出226个血府逐瘀汤的药物活性成分,然后使用FAFDrugs4数据库进行再次筛选,共89个药物活性成分结果为“accepted”。此外,2015版《中国药典》增补了13个有效药物活性成分,共102个药物活性成分进入后续研究。其中在Swiss TargetPrediction中发现473个作用靶点,在SEA中发现365个作用靶点,在Drugbank中发现191个作用靶点。将上述3个作用靶点合并去重,共获得792个作用靶点。
2.2 冠心病致病靶点 在Drugbank中发现68个冠心病致病靶点,在GeneCards中发现1 844个冠心病致病靶点,在OMIM中发现144个冠心病致病靶点,在PharmGKB中发现115个冠心病致病靶点,在TTD中发现21个冠心病致病靶点。将上述5个疾病数据库的冠心病致病靶点合并并去重,共获得2 060个冠心病致病靶点。
2.3 血府逐瘀汤和冠心病的药物-疾病交集靶点及成分-靶点网络构建 共发现170个药物-疾病交集靶点,使用Cytoscape软件构建成分-靶点网络,其中度值排序前5位的成分为槲皮素(102)、木犀草素(40)、山柰酚(37)、汉黄芩素(30)、柚皮素(28);度值排序前5位的靶点为PTGS2(128)、ESR1(90)、HSP90AA1(87)、CALM1(84)、AR(82)。
2.4 核心靶点 将170个药物-疾病交集靶点输入STRING数据库,获得PPI网络,共169个节点和3 133条边。采用Cytoscape软件中的Cytohubba插件对169个节点进行计算,提取度值、MCC、MNC、EPC评分的前10个靶点并进行交集处理,共获得6个核心靶点:IL6、TNFA、STAT3、EGFR、HIF1A和MMP9,见图1。
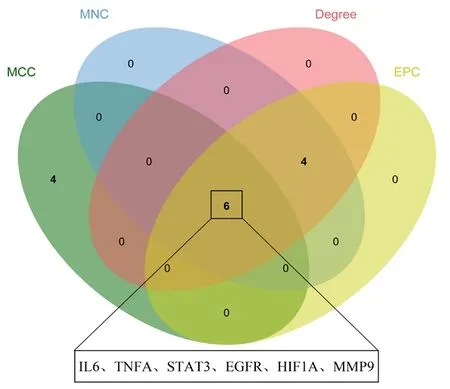
图1 PPI网络中的核心靶点Figure 1 Core targets of the PPI network
2.5 GO功能、KEGG通路富集分析结果 对170个药物-疾病交集靶点进行GO功能、KEGG通路富集分析。GO功能富集分析结果显示,排序前5位的结果条目为细胞迁移的正向调节(RR=9.87%)、细胞移动的正向调节(RR=9.64%)、细胞运动的正向调节(RR=9.38%)、细胞组分移动的正向调节(RR=9.35%)和循环系统过程(RR=7.82%)。根据q值进行排序,前3个条目为磷代谢过程的正向调控(q=7.43E-48)、细胞内信号转导的正向调节(q=3.45E-47)和细胞运动的正向调节(q=5.60E-41)。
KEGG富集分析结果显示,根据RR排序前5位的结果条目为HIF-1α信号通路(RR=23.97%)、肿瘤坏死因子信号通路(RR=19.30%)、血管内皮生长因子信号通路(RR=19.04%)、催乳素信号通路(RR=17.95%)和白介素17信号通路(RR=16.94%);根据q值降序排列,HIF-1α信号通路位列第1。
2.6 血府逐瘀汤对ApoE-/-小鼠动脉粥样硬化模型血脂指标的影响 四组小鼠TG比较,差异无统计学意义(F=1.330,P=0.299);四组小鼠LDL、HDL、TC比较,差异有统计学意义(F值分别为95.72、208.70、106.60,P值均<0.001);其中高脂模型组小鼠LDL、TC高于低脂对照组,HDL低于低脂对照组,差异有统计学意义(P<0.05);低剂量灌胃组、高剂量灌胃组小鼠LDL、TC低于高脂模型组,HDL高于高脂模型组,差异有统计学意义(P<0.05),见图2。
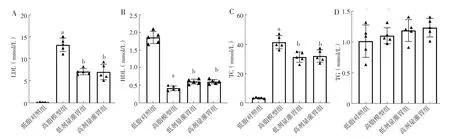
图2 四组小鼠血脂指标比较Figure 2 Comparison of blood lipid indexes in the four groups of mice
2.7 血府逐瘀汤对ApoE-/-小鼠动脉粥样硬化模型主动脉粥样硬化斑块的影响 低脂对照组主动脉组织未见明显着色,故未进行定量分析。高脂模型组、低剂量灌胃组、高剂量灌胃组小鼠主动脉组织胶原纤维面积/斑块总面积、斑块总面积/血管腔面积比较,差异有统计学意义(F值分别为53.00、32.00,P值均<0.001);低剂量灌胃组和高剂量灌胃组小鼠主动脉组织胶原纤维面积/斑块总面积高于高脂模型组,斑块总面积/血管腔面积低于高脂模型组,高剂量灌胃组小鼠主动脉组织胶原纤维面积/斑块总面积高于低剂量灌胃组,斑块总面积/血管腔面积低于低剂量灌胃组,差异有统计学意义(P<0.05),见图3~6。

图3 四组小鼠主动脉组织HE染色结果(比例尺=100 μm)Figure 3 HE staining results of abdominal aorta in the four groups of mice

图4 高脂模型组、低剂量灌胃组、高剂量灌胃组小鼠主动脉组织胶原纤维面积/斑块总面积比较Figure 4 Comparison of collagen fiber area/total plaque area of abdominal aorta in the high-fat model group, low-dose gavage group and high-dose gavage group

图5 四组小鼠主动脉组织Masson三色染色结果(比例尺=100 μm)Figure 5 Masson trichrome staining results of abdominal aorta in the four groups of mice
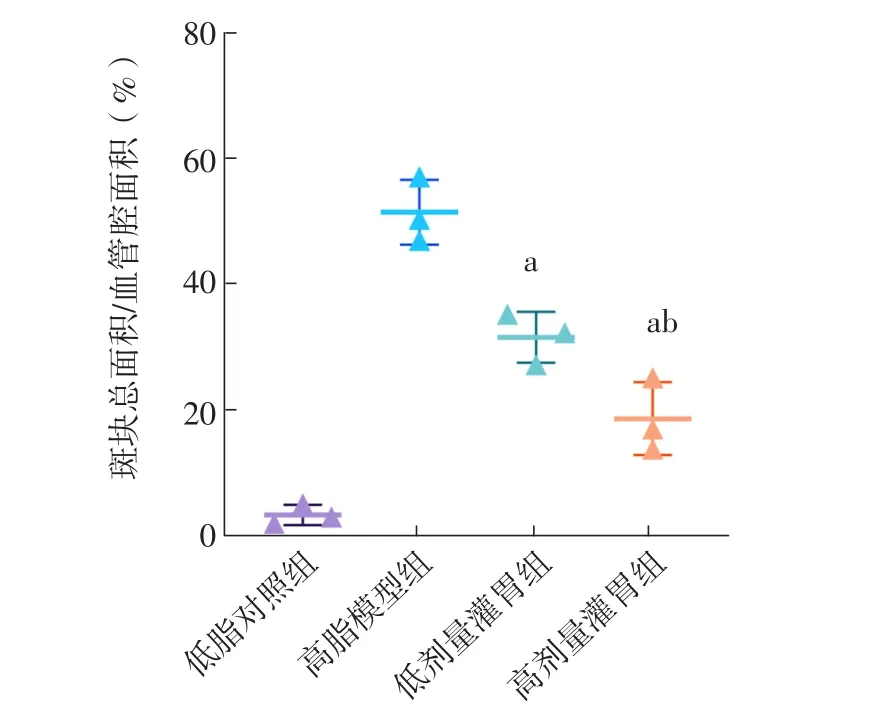
图6 四组小鼠主动脉组织斑块总面积/血管腔面积比较Figure 6 Comparison of plaque area/lumen area of abdominal aorta in the four groups
2.8 血府逐瘀汤对HIF-1α、VEGFR2表达的影响 低脂对照组主动脉组织未见明显着色,故未进行定量分析。免疫组化染色结果显示,高脂模型组、低剂量灌胃组、高剂量灌胃组小鼠HIF-1α、VEGFR2阳性面积/斑块总面积比较,差异有统计学意义(F值分别为33.00、27.00,P值均<0.05);低剂量灌胃组和高剂量灌胃组小鼠HIF-1α、VEGFR2阳性面积/斑块总面积低于高脂模型组,高剂量灌胃组小鼠HIF-1α、VEGFR2阳性面积/斑块总面积低于低剂量灌胃组,差异有统计学意义(P<0.05),见图7~8。
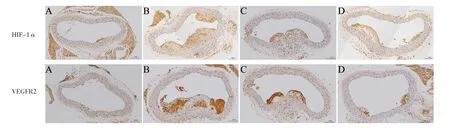
图7 四组小鼠主动脉组织免疫组化染色结果Figure 7 Immunohistochemical staining results of abdominal aorta in the four groups of mice
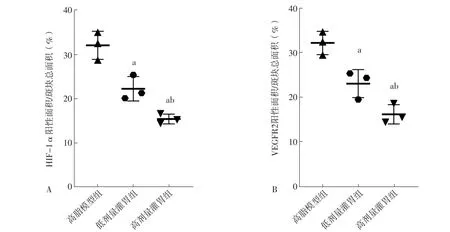
图8 高脂模型组、低剂量灌胃组、高剂量灌胃组小鼠主动脉组织HIF-1α、VEGFR2表达水平比较Figure 8 Comparison of expression levels of HIF-1α and VEGFR2 of abdominal aorta in the high-fat model group, low-dose gavage group and high-dose gavage group
3 讨论
近年来虽然我国心血管疾病的防治已经取得长足进步,但冠心病患者人数仍呈快速上升趋势,尤其是农村地区,冠心病死亡率明显升高[6]。目前,常规抗血小板、降脂和扩血管等药物治疗并未有效阻止冠心病病情进展及减少急性事件的发生。近年来,采用中药防治冠心病取得较大进展,如脑心通胶囊、通心络胶囊和刺五加注射液等可以通过多种途径减轻冠心病患者症状及改善其心功能[7]。但中药治疗冠心病的机制尚未明确,本研究基于网络药理学和动物实验探索了血府逐瘀汤治疗冠心病的作用靶点及机制。
血府逐瘀汤由多味中药组成,其治疗冠心病的药理机制包括保护内皮功能、改善血液流变学、拮抗血小板聚集、抗炎、抗氧化应激等[8]。本研究通过查询药物数据库,得到血府逐瘀汤11味中药含有的102个药物活性成分,并发现槲皮素、木犀草素、山柰酚、汉黄芩素、柚皮素可能在冠心病的治疗中发挥了重要作用。槲皮素是一种类黄酮化合物,其在抑制粥样硬化斑块形成方面具有多种作用,如降低前蛋白转化酶枯草杆菌蛋白酶9(proprotein convertase subtilisin/kexin type 9,PCSK9)水平、血脂[9],缓解氧化低密度脂蛋白(oxidized low density lipoprotein,ox-LDL)引起的巨噬细胞自噬[10],调节氧化应激,保护血管内皮细胞功能[11]等。木犀草素同为黄酮化合物,其被证明可以通过调节AKT和SRC而抑制血管平滑肌细胞增殖和迁移[12],并通过调节mRNA稳定性和NOX4/ROS-NF-κB通路而减轻炎症和氧化损伤[13]。山柰酚是天然类黄酮,作为一种植物源性雌激素,其能激活G蛋白偶联雌激素受体和下游的PI3K/AKT/Nrf2通路,进而抑制小鼠动脉粥样硬化进展[14];此外,山柰酚还可以通过炎症依赖性途径而减轻ox-LDL诱导的内皮细胞损伤[15]。汉黄芩素具有丰富的抗炎特性,可以通过作用于VEGFR2而抑制脂多糖诱导的血管生成[16],而炎症刺激的血管生成是粥样硬化斑块不稳定的重要因素[17];同时,汉黄芩素还可以干扰DAG-PKC通路,改善高脂诱导的血管平滑肌细胞凋亡[18],在一定程度上保护了晚期动脉粥样硬化斑块的稳定性。柚皮素是一种柑橘类黄酮,具有强效降脂特性,有助于降低高脂血症、提高胰岛素敏感性[19],故可以有效减轻低密度脂蛋白受体(low density lipoprotein receptor,LDLR)-/-小鼠动脉粥样硬化并抑制其复杂病变的形成[20]。一项使用分子网络建模和分析药物基因组学的研究发现,血府逐瘀汤有667个药物活性成分[21],而本研究经过检索和筛选得到血府逐瘀汤的102个药物活性成分,数量上存在差异的原因可能是上述研究并未对667个药物活性成分进行ADMETox(吸收、分布、代谢、排除和毒性)过滤,而经过FAFDrugs4数据库的ADME-Tox规则筛选后的药物活性成分具有更可靠的“可药性”[22]。综上,血府逐瘀汤包含的重要药物活性成分可以从控制血脂、减轻氧化应激、抑制平滑肌细胞凋亡和保护内皮细胞等方面抑制或减缓动脉粥样硬化的发生和发展。
本研究通过KEGG通路富集分析发现,HIF-1α在富集率和可信度上均显著,其是筛选出的核心靶点之一。HIF-1α是缺氧反应中的重要分子,在缺氧状态下,其蛋白质水平稳定,蛋白质进入细胞核与HIF-1β伴侣形成二聚化体。生成的HIF-1α/β复合物与靶基因启动子区域中的特定缺氧反应元件结合,并调节靶基因的表达[23]。在动脉粥样硬化发生发展中伴随动脉血管逐渐狭窄,机体组织开始缺氧或缺血,这会诱导HIF-1α活性增加及血管生成因子生成,刺激血管重塑以增加侧支血管血流量,并增加输送至心肌代偿性肥大部位的氧气。此外,HIF-1α还是血管内皮细胞增殖和迁移的重要调控因子,敲除HIF-1α可导致血管内皮细胞凋亡,而适度增加HIF-1α可以缓解局部缺氧[24]。
本研究通过构建ApoE-/-小鼠动脉粥样硬化模型发现,低剂量灌胃组、高剂量灌胃组小鼠胶原纤维面积/斑块总面积高于高脂模型组,斑块总面积/血管腔面积低于高脂模型组。一项纳入6 333例冠状动脉粥样硬化患者的荟萃分析发现,斑块体积百分比每减少1%,患者主要心血管不良事件发生风险降低约20%[25]。通常认为斑块中胶原相对含量越高,提示斑块越稳定。且既往研究表明,血府逐瘀汤可以减少金属蛋白酶类表达,抑制斑块内胶原降解,调节心肌梗死后心肌胶原代谢,从而改善心功能和减轻心室重构[26]。因此,通过本研究结果推断血府逐瘀汤可能通过抑制斑块中胶原纤维降解,进而维持斑块纤维帽稳定,这从动物水平证实了血府逐瘀汤对动脉粥样硬化的治疗作用。
虽然HIF-1α可能在心脏肥大期间发挥保护心肌、促血管生成作用,但其可能通过导致能量衰竭的代谢重编程而在心力衰竭终末期发挥致病作用[27]。更重要的是,斑块形成和并发症进展的主要风险因素是新的弱血管形成,因HIF-1α在动脉粥样硬化斑块核心内表达,可诱导VEGF和VEGRF2表达并产生脆弱的新生血管[17]。本研究GO功能富集分析发现,药物-疾病交集靶点中与细胞运动和迁移条目显著富集,因内皮细胞向缺血区域移动、迁移是促进新生血管形成的重要过程[28]。因此,本研究将后续的验证重点聚焦在HIF-1α信号通路方面,结果显示,低剂量灌胃组和高剂量灌胃组小鼠主动脉组织HIF-1α、VEGFR2阳性面积/斑块总面积低于高脂模型组,高剂量灌胃组小鼠主动脉组织HIF-1α、VEGFR2阳性面积/斑块总面积低于低剂量灌胃组。虽然本研究并未对斑块内的新生血管进行检测,但作为血管生成的主要调节因子,HIF-1α和VEGFR2变化足以说明血府逐瘀汤具有降低斑块内新生血管生成的能力,而较少的新生血管可增加斑块的稳定性[29],因此认为血府逐瘀汤可通过稳定斑块、延缓动脉粥样硬化进展,避免斑块破裂导致的急性事件发生。
既往研究报道,LDL每降低1 mmol/L,患者主要血管事件发生风险可降低21%[30],且减少LDL沉积可以实现斑块的逆转[31]。本研究结果显示,高脂模型组小鼠LDL、TC高于低脂对照组,HDL低于低脂对照组;低剂量灌胃组、高剂量灌胃组小鼠LDL、TC低于高脂模型组,HDL高于高脂模型组,提示血府逐瘀汤可有效改善冠状动脉粥样硬化小鼠的血脂指标,且这种改善作用与血府逐瘀汤剂量无明显关系;但高剂量血府逐瘀汤在减少斑块面积及维持斑块稳定性方面较低剂量血府逐瘀汤更好,推测血府逐瘀汤抗动脉粥样硬化斑块和维持斑块稳定性的作用不仅与其降脂作用有关,还与其抑制HIF-1α信号通路有关。
综上所述,HIF-1α信号通路是血府逐瘀汤治疗冠心病的核心靶点之一,血府逐瘀汤可以通过降低血脂、抑制HIF-1α信号通路而减少动脉粥样硬化斑块面积及维持斑块的稳定性,进而有效治疗冠心病。
作者贡献:马淑慧、赵学飞进行文章的构思与设计,负责撰写、修订论文;马淑慧、赵学飞、王少兰进行研究的实施与可行性分析;李敏杰进行数据收集、整理、分析;马淑慧、董静、王海芳进行结果分析与解释;赵学飞负责文章的质量控制及审校,对文章整体负责、监督管理。
本文无利益冲突。
