大黄炮制前后的化学成分变化及其减毒研究
2022-12-13李春帅徐文娟杨琳琳张姝妍程水清李向日
王 敏 韩 婷 李春帅 徐文娟 杨琳琳 张姝妍 程水清 王 璇 文 佳 李向日
(北京中医药大学中药炮制研究中心/北京市中药品质评价重点实验室,北京,102488)
大黄是蓼科植物掌叶大黄(PalmatumL.)、唐古特大黄[RheumtanguticumMaxim,ex Bal(F)]或药用大黄(RheumofficinaleBaill.)的干燥根和根茎[1]。其药用历史悠久,最早见于《神农本草经》。“主下瘀血,血闭,寒热,破癥瘕积聚,留饮,宿食,荡涤肠胃,推陈致新,通利水谷,调中化食,安和五脏”,列为下品。大黄临床应用极其广泛,有“将军”之称,目前在临床上多用于胃肠道疾病和慢性肝病等的长期治疗。研究发现,大黄具有良好的保肝作用,可使肝脏免受纤维化、肝硬化、肝癌以及各种类型的肝炎等的发病[2-7]。统计《中华人民共和国药典》(2020年版)、中医方剂数据库、药智网,得到以大黄入药的古方7 000多首和现代中成药处方700多条[8]。目前,大黄被欧洲各国、美国等许多国家所认可,它已作为一种世界性药物被列入19个国家的药典[9]。
然而,有报道称,长期服用大黄制剂可能存在肝损伤的风险[10-11]。尽管大黄安全性引起了公众的质疑,但其仍是临床肝病治疗的常用药物,因此,对大黄的肝毒性评估是必不可少的。同时,大黄生品苦寒,药性峻烈,易损伤脾胃功能,耗损元气,对于久病体弱、年老患者可选用药性缓和的炮制品,以降低不良反应[12]。关于大黄的炮制最早见于汉代张机的《金匮玉函经》,“皆去黑皮、或炮或生,清酒洗,酒浸”[13]。传统用药常根据辨证选择不同炮制品施治,目前大黄有多种炮制规格,其中临床以熟大黄较为常用。
斑马鱼与人类的基因具有87%的同源性,其基因的传导通路和代谢通路与哺乳动物也有高度的相似性[14-15]。作为一种新兴模式生物,斑马鱼兼具体外细胞模型的高通量性和啮齿类动物模型的生物复杂性等优势,同时基于其发育迅速、繁殖快、操作简单等特点[16-18],近些年,作为一种替代模型被广泛应用于药物诱导肝毒性的评价。为了更深入地探讨大黄肝毒性,本研究以不同批次的生大黄、熟大黄为研究对象,利用斑马鱼幼鱼肝毒性评价方法和现代化学技术分析大黄及其炮制品的化学成分差异和毒性大小,探讨大黄炮制减毒的物质基础和科学内涵,为临床合理用药和早期监测、诊断病情提供参考。
1 材料与方法
1.1 材料
1.1.1 动物 野生型斑马鱼(品系:AB品系)、转基因型斑马鱼[品系:CZ16(gz15Tg,Tg(fabp10a:dsRed;ela3l:EGFP)]均购置于中国科学院水生生物研究所,养殖于集中式斑马鱼养殖系统(水温28.5 ℃、光照周期为14 h光照/10 h黑暗)。
1.1.2 药物 芦荟大黄素对照品(成都瑞芬思生物科技有限公司,批号:RFS-L01411810008);大黄酸对照品(成都瑞芬思生物科技有限公司,批号:RFS-D01002010012);大黄素对照品(成都普思生物科技有限公司,批号:PS010624);大黄酚对照品(成都普思生物科技有限公司,批号:PS011322);大黄素甲醚对照品(成都普思生物科技有限公司,批号:PS0291);没食子酸对照品(成都普思生物科技有限公司,批号:PS000688)
1.1.3 试剂与仪器 4%多聚甲醛(北京拜尔迪生物技术有限公司,货号:DE-0094);磷酸缓冲盐溶液(美国康宁公司,货号:21-040-CVR);干酪素(北京奥博星生物技术有限责任公司,货号:S12002);无水碳酸钠(上海麦克林生化科技有限公司,货号:S818014);磷钼钨酸(天津市光复精细化工研究所,货号:20220111);NaCl(北京化工厂,货号:A1060005)、KCl(北京化工厂,货号:A1049003)、Na2HPO4(北京化工厂,货号:A1060056)、CaCl2(北京化工厂,货号:A1011002)、K2HPO4(北京化工厂,货号:A1049021)、MgSO4(北京化工厂,货号:A1037009)、NaHCO3(北京化工厂,货号:A1060001);吖啶橙(上海源叶生物科技有限公司,货号:S47568);分析纯甲醇(上海易恩化学技术有限公司,货号:67-56-1);纯水(杭州娃哈哈集团有限公司)。
体式荧光显微镜(卡尔·蔡司公司股份公司,型号:V16);体视显微镜(卡尔·蔡司公司股份公司,型号:Stemi508);光学倒置显微镜(徕卡显微系统(上海)贸易有限公司,型号:TE-2000-S);微型漩涡混悬器(上海振荣科学仪器有限公司,型号:WH-90A);高速台式冷冻离心机(长沙湘仪离心机仪器有限公司,型号:TGL-16M);灭菌锅(日本松下公司,型号:MLS-3751L);荧光成像系统(伯乐生命医学产品(上海)有限公司,型号:BIO-RAD ChemiDoc MP);斑马鱼养殖系统(北京爱生生物科技有限公司,型号:集中养殖与发育系统设备);细胞移液器(Eppendorf,规格:200 μL、1 mL和5 mL);分析天平(北京赛多利斯仪器系统有限公司,型号:SARTORIUS AG);数控超声波清洗器(昆山市超声仪器有限公司,型号:KQ-600DE);紫外可见分光光度计(上海美谱达仪器有限公司,型号:P7双光束型);高效液相色谱仪(沃特世科技(上海)有限公司,型号:Waters 2695);Agilent ZORBAX SB-C18色谱柱(北京赛普瑞斯科技有限公司,型号:250 mm×4.6 mm,5 μm)。
1.2 方法
1.2.1 样品的收集和炮制
1.2.1.1 生大黄的收集 收集7批生大黄样品,经北京中医药大学李向日教授鉴定,为掌叶大黄(RheumpalmatumL.)的干燥根茎。产地和批号信息见表1。
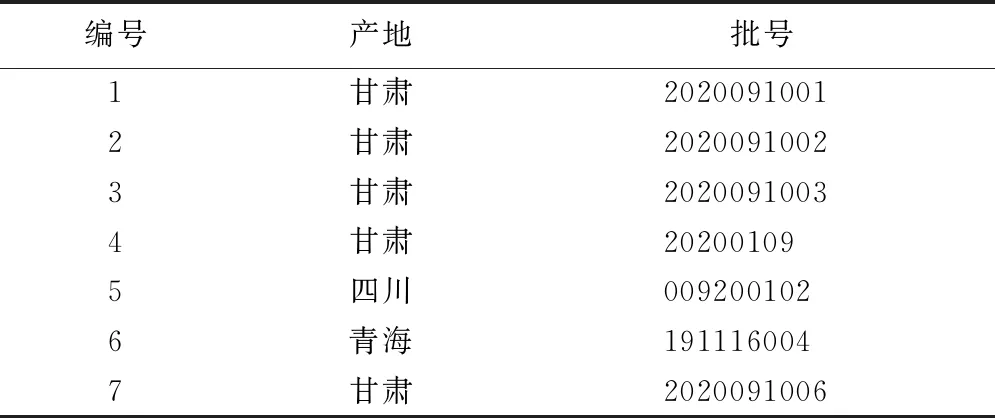
表1 生大黄样品信息
1.2.1.2 熟大黄的炮制 本研究根据《中华人民共和国药典》(2020版)和《北京市中药饮片炮制规范》(2008版),将7批生大黄饮片分别炮制成熟大黄,具体方法如下:取大黄片,加黄酒拌匀(100 kg大黄片用黄酒50 kg),闷润1~2 h至黄酒被吸尽,装入不锈钢可蒸制饭盒内,密封,蒸制24 h,此时,其表面和内部均呈黑色,取出,晾干。
按照以上方法炮制得到的炮制品置于干燥器中,阴凉处避光保存。
饮片呈椭圆形或不规则块片状,直径大小不等,外表皮黄棕色或棕褐色,有纵皱纹,切面黄棕色有明显散在或排列成环的星点,有空隙;熟大黄形如生品,表面和内部均呈黑色,质坚硬,气微香。见图1。

图1 大黄炮制前后的性状(代表性样品)
1.2.1.3 水提物的制备 称取生、熟大黄饮片150 g,加入10倍量的蒸馏水浸泡30 min后,煎煮30 min,过滤,药渣中再加入8倍量的蒸馏水继续煎煮1 h,合并水煎液,3 500 r/min,离心半径8.7 cm,离心5 min,过滤,取上清液,浓缩,冷冻干燥后得到各生大黄及熟大黄炮制品的水提物粉末。于4 ℃冰箱保存,备用。
药物储备液的配制:精确称取适量大黄水提取物粉末,溶于含50 mL胚胎培养水的离心管中,超声30 min,根据实验需要,分别配置成2 000、1 000和400 μg/mL的母液,-20 ℃冰箱中保存,在实验前将母液稀释成一系列的药物浓度进行实验。
1.2.2 鞣质的含量测定
1.2.2.1 对照品溶液的制备 精密称取没食子酸对照品25.04 mg,置50 mL棕色量瓶中,加水溶解并稀释至刻度,精密吸取5 mL,置50 mL棕色量瓶中,用水稀释至刻度,摇匀,即得没食子酸对照品溶液(49.08 μg/mL)。
1.2.2.2 供试品溶液的制备 取药材粉末(过四号筛)约0.25 g,精密称定,置250 mL棕色量瓶中,加水150 mL,放置过夜,超声处理10 min,放冷,用水定容至刻度,摇匀,静置,滤过,弃去初滤液50 mL,精密量取续滤液20 mL,置100 mL棕色量瓶中,用水稀释至刻度,摇匀,即得供试品溶液。
1.2.2.3 方法学考察
1.2.2.3.1 线性关系考察 精密量取对照品溶液0.5 mL、1.0 mL、2.0 mL、3.0 mL、4.0 mL、5.0 mL,分别置25 mL棕色量瓶中(使溶液中没食子酸含量分别为0.98 μg/mL、1.96 μg/mL、3.93 μg/mL、5.89 μg/mL、7.85 μg/mL、9.82 μg/mL),各加入磷钼钨酸试液1 mL,再分别加水11.5 mL、11.0 mL、10.0 mL、9.0 mL、8.0 mL、7.0 mL,用29%碳酸钠溶液稀释至刻度,摇匀,放置30 min,同时制备相应的空白对照溶液,在760 nm波长处测定吸光度。
1.2.2.3.2 仪器精密度实验 分别取没食子酸对照溶液(49.08 μg/mL)和供试品溶液(编号:生大黄-3),采用所确定的检测条件,连续测定吸光度值6次。
1.2.2.3.3 稳定性实验 精密吸取供试品溶液(编号:生大黄-3)1.0 mL,采用所确定的检测条件,显色30 min后放置0、10、20、30、40、60 min,并分别测定吸光度。
1.2.2.3.4 重复性实验 精密称取同一批大黄样品6份(编号:生大黄-3),按1.2.2.2项下方法制备供试品溶液,并按所确定的检测条件进行测定。
1.2.2.3.5 加样回收实验 取同一批已知鞣质含量的样品6份(编号:生大黄-3,鞣质含量为4.04%),每份0.25 g,精密称定,置于250 mL容量瓶中,并精密加入没食子酸对照品溶液1 mL,其酚酸含量与所取大黄样品总酚酸含量相等,按1.2.2.2项制备供试品溶液,采用所确定的检测条件,测定样品总酚含量,计算加样回收率。
1.2.2.4 含量测定 按1.2.2.2项下方法制备生、熟大黄供试品溶液,以确定的检测条件测定吸光度。实验重复2次。
1.2.3 蒽醌的含量测定
1.2.3.1 对照品溶液的制备 精密称取芦荟大黄素对照品、大黄酸对照品、大黄素对照品、大黄酚对照品、大黄素甲醚对照品各2.53 mg、2.63 mg、2.43 mg、2.55 mg和2.50 mg,加甲醇分别制成1 mL含芦荟大黄素、大黄酸、大黄素、大黄酚分别为19.84 μg、20.62 μg、19.05 μg、19.99 μg,大黄素甲醚9.80 μg的溶液,即得。
1.2.3.2 供试品溶液的制备 参照《中华人民共和国药典》大黄【含量测定】项下总蒽醌和游离蒽醌供试品溶液的制备[1]。
1.2.3.3 色谱条件 符合《中华人民共和国药典》大黄含量测定项下色谱条件:色谱柱为Agilent ZORBAX SB-C18色谱柱(250 mm×4.6 mm,5 μm);以甲醇-0.1%磷酸溶液(85∶15)为流动相,检测波长为203 nm,进样量为10 μL;流速为1.0 mL/min;柱温为20 ℃。
1.2.3.4 含量测定 取生、熟大黄样品粉末(过四号筛),按照2.3.3项下方法分别制备总蒽醌和游离蒽醌供试品溶液,分别精密吸取对照品溶液与上述2种供试品溶液各10 μL,注入液相色谱仪,测定,即得。结合蒽醌含量=总蒽醌含量-游离蒽醌含量。
1.2.4 斑马鱼幼鱼模型评价生、熟大黄水提物的肝毒性
1.2.4.1 斑马鱼的繁殖与饲养 暗周期开始前1 d,选择健康的成年斑马鱼按雌雄比1∶2放入具筛板的产卵缸内,中间放置隔板,光周期开始后抽去隔板,0.5 h后收集鱼卵于干净的培养皿中,胚胎培养水冲洗3遍,在显微镜下挑选健康的胚胎重新放入新的含胚胎培养水的培养皿中,28 ℃恒温培养箱中培养,相同光照条件下发育至4 dpf(Days Post Feritilization,受精后天数)。在3 dpf阶段前,在体式显微镜下挑选出健康的斑马鱼幼鱼。
1.2.4.2 急性毒性实验 随机挑选发育正常的4 dpf健康斑马鱼幼鱼置于12孔板的样孔中,每孔20尾,每组设3孔重复。根据预实验,设定空白对照组(斑马鱼胚胎培养水)和不同浓度的生大黄、熟大黄组。整个暴露过程在28.5 ℃的恒温培养箱中进行。在暴露处理期间,每隔8 h统计各实验的斑马鱼死亡数量并及时移除死亡的幼鱼。在实验暴露终点,于体式显微镜下确定不同处理存活幼鱼的数量,统计每组的死亡率。整个实验重复3次。
1.2.4.3 表型评价 选择AB系野生型斑马鱼,在实验暴露终点,移除暴露液,并用胚胎培养水将各处理的斑马鱼幼鱼冲洗3次,用三卡因溶液麻醉后,侧位摆放,固定于含3%甲基纤维素的载玻片上,每组随机选取10尾斑马鱼,于体式显微镜下观察活体斑马鱼的肝脏变性情况,并用显微镜软件(ZEN lite)拍照记录。
1.2.4.4 肝脏病理组织学评价 选择AB系野生型斑马鱼,在实验暴露终点,使用胚胎培养水冲洗3次,每组随机选取10尾斑马鱼幼鱼,转移至含4%多聚甲醛的1.5 mL洁净离心管中,室温下贮存。乙醇逐步脱水,石蜡包埋,切成4~5 μm的切片后进行苏木精-伊红(Hematoxylin-eosin,HE)染色,在光学倒置显微镜下观察斑马鱼幼鱼肝组织病理学的改变,并拍照记录。
1.2.4.5 体内细胞凋亡评价 选择AB系野生型斑马鱼,在实验暴露终点,胚胎培养水清洗3遍,每组随机选取10尾斑马鱼,在孔板中快速加入2.5 μg/mL吖啶橙溶液2 mL,于避光条件下染色30 min,使用胚胎培养水和磷酸缓冲盐溶液各冲洗3遍,在荧光显微镜下观察生、熟大黄对肝细胞凋亡的影响,并拍照记录。
1.2.4.6 斑马鱼肝脏荧光面积的测定 选择CZ16转基因型斑马鱼,在实验暴露终点,利用荧光显微镜和Image J软件统计不同处理组中斑马鱼幼鱼的肝脏荧光面积,整个实验重复3次。

2 结果
2.1 鞣质的含量测定
2.1.1 方法学考察
2.1.1.1 线性关系考察 计算回归方程为Y=0.103 1X+0.034 9(R2=0.999 1,n=6)。结果表明,没食子酸浓度在0.099 4~1.274 8 μg/mL之间与其吸光度呈良好的线性关系。
2.1.1.2 仪器精密度实验 结果表明,精密度相对标准偏差(Relative Standard Deviation,RSD)分别为0.09%和1.76%,表明仪器精密度高。
2.1.1.3 稳定性实验 结果表明,在60 min内溶液吸光度RSD为1.66%和1.67%,因此,样品显色后至少在60 min内稳定。
2.1.1.4 重复性实验 结果表明,鞣质的平均含量为4.04%,RSD=2.48%,表明此方法重复性良好。
2.1.1.5 加样回收实验 总酚的平均加样回收率为100.59%,RSD=1.77%,表明该测定方法准确度高,符合测定要求。见表2。
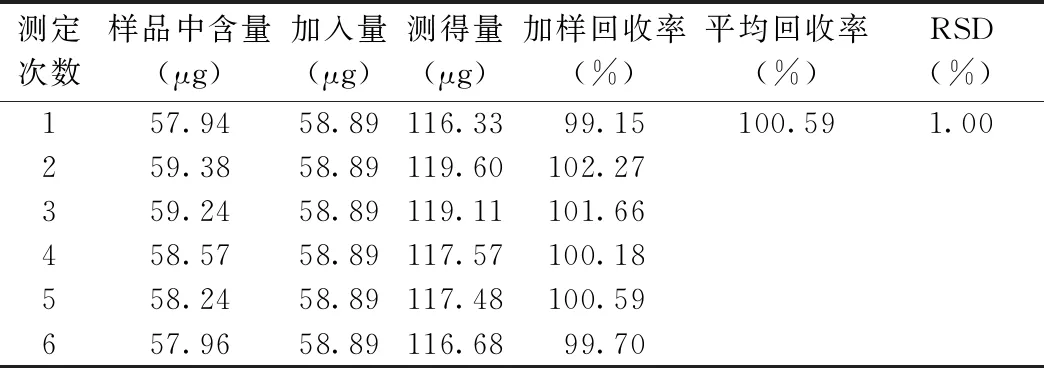
表2 加样回收试验结果(n=6)
2.1.2 含量测定 测得生大黄的鞣质含量为3.59%,熟大黄的鞣质含量为0.33%;与生大黄比较,炮制成熟大黄后鞣质含量降低8~10倍(P<0.01)。见表3。

表3 生大黄、熟大黄的鞣质含量测定结果(%,n=2)
2.2 蒽醌的含量测定 生大黄、熟大黄饮片中总蒽醌和游离蒽醌的含量均符合现版《中华人民共和国药典》规定。总蒽醌、游离蒽醌、结合蒽醌在生大黄中的含量分别为1.96%、1.01%和0.95%;在熟大黄中的含量分别为1.86%、1.27%和0.64%。见表4。与生大黄比较,熟大黄中结合蒽醌的含量降低,游离蒽醌的含量升高,差异无统计学意义(P>0.05)。见图2。
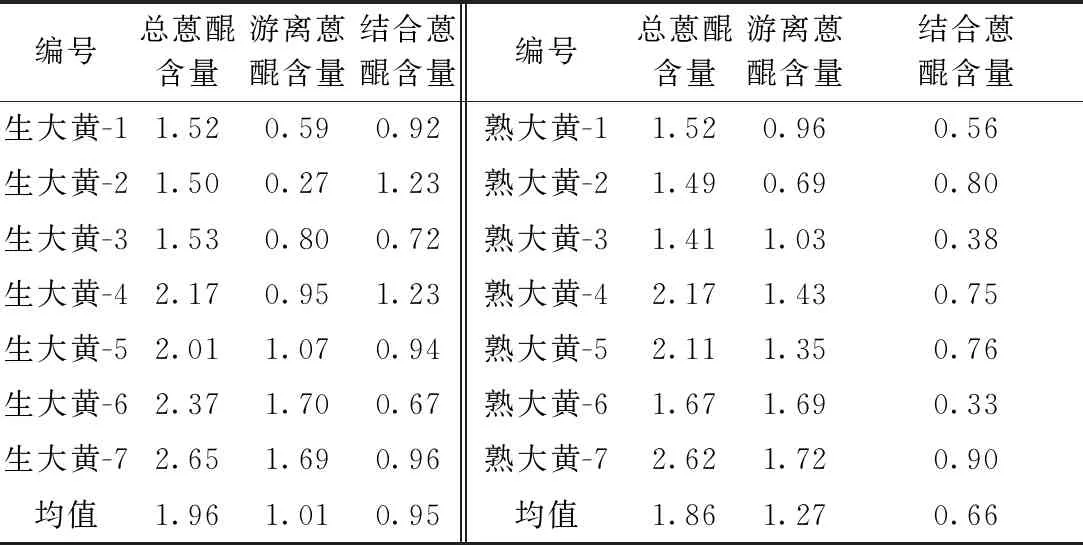
表4 生大黄、熟大黄的蒽醌含量测定结果(n=2,%)
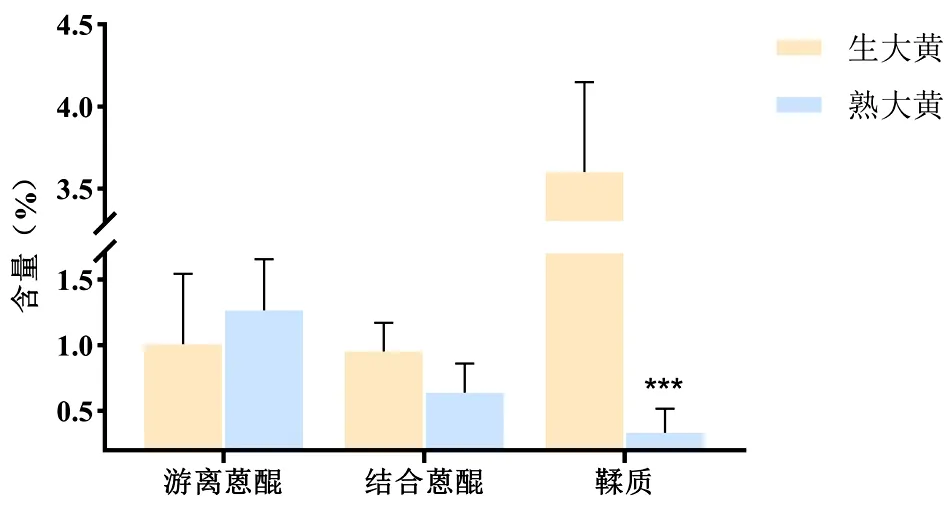
图2 生大黄、熟大黄中游离蒽醌、结合蒽醌和鞣质的成分含量
2.3 斑马鱼幼鱼模型评价生、熟大黄水提物的肝毒性研究结果
2.3.1 急性毒性表现和量-毒曲线评价 低浓度大黄给药时,斑马鱼幼鱼略为安静,部分幼鱼伏于水底或沿壁正常游动,未见明显异常状况;而加入高浓度大黄时,幼鱼出现应激反应,游动迅速。8 h后,斑马鱼幼鱼安静伏于水底,受到外界刺激时反应迟钝,可观察到幼鱼的体表被染成黄色;后期可观察到斑马鱼幼鱼处于侧卧状态,用玻璃棒多次触碰这些鱼的尾部,如无反应,则判定为死亡。在实验暴露终点,空白对照组的幼鱼体形舒展、行动活泼;给药组死亡斑马鱼体态蜷曲,未死亡斑马鱼部分尾部弯曲,色素沉着降低,行动迟缓。
结果表明,大黄的急性毒性强弱为:生大黄>熟大黄,熟大黄的最大非致死浓度约为生大黄的9倍,证明生大黄经炮制后毒性显著降低,且3批大黄的毒性下降趋势几乎一致。见图3,表5。
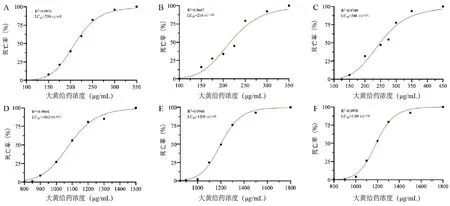
图3 生大黄、熟大黄对斑马鱼死亡率的影响(n=3)

表5 生熟大黄对斑马鱼的致死浓度表(μg/mL)
2.3.2 表型评价 空白对照组中斑马鱼幼鱼肝脏形态清晰,呈透明状;生大黄组给药后肝脏透明度降低,随着暴露浓度的增加,肝脏区域边缘逐渐模糊,颜色趋于灰暗状,表明出现肝脏变性;熟大黄低浓度组肝脏变性程度不明显,高浓度可见轻微肝脏变性。此外,还观察到一些非肝毒性特异特征,如表面呈黄染现象,肠道被染红等。见图4。

图4 生大黄、熟大黄对斑马鱼幼鱼肝脏表型的影响(×32,×80)
2.3.3 肝脏病理组织学评价 空白对照肝脏区域细胞结构完整,细胞核呈规则圆形;生大黄低浓度可观察到肝细胞排列不规则,组织间隙增大;高浓度组细胞核萎缩变形,肝组织排列及组织空隙严重程度加剧,并呈现空泡化,生大黄高浓度组偶见炎症细胞浸润;肝组织损伤程度随着给药浓度的增加而加重;熟大黄低浓度组对斑马鱼幼鱼的肝脏组织无明显影响,高浓度仍可见组织空泡化,但较生大黄组肝脏变性程度有所减轻。见图5。
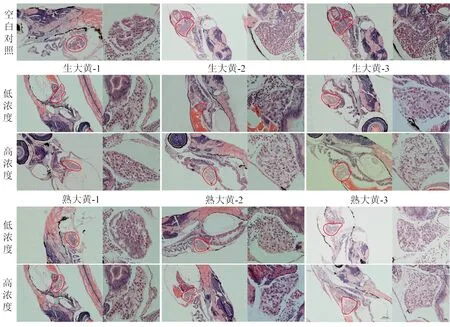
图5 生大黄、熟大黄对斑马鱼幼鱼肝脏病理组织的影响(×10,×40)
2.3.4 体内细胞凋亡评价 与空白对照组比较,生、熟大黄给药组对斑马鱼肝脏细胞凋亡的影响不同,生大黄组中斑马鱼的肝脏区域表现出黄绿色荧光小点,随着浓度增大,凋亡细胞数量变多,说明生大黄能够引起显著的肝细胞凋亡;熟大黄低浓度组未见凋亡,高浓度组偶见凋亡。见图6。
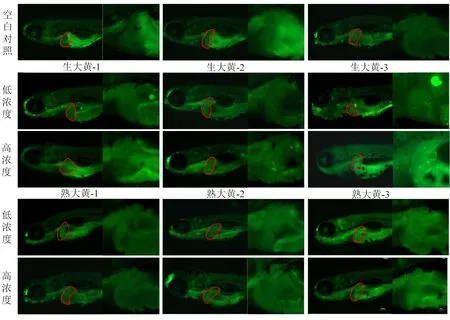
图6 生、熟大黄对斑马鱼幼鱼肝脏细胞凋亡的影响(×32,×80)
2.3.5 斑马鱼肝脏荧光面积的测定 与空白对照组比较,生大黄低浓度组肝脏荧光面积呈下降趋势,差异无统计学意义(P>0.05),高浓度组的肝脏荧光面积显著性减小(P<0.05),熟大黄低、高浓度组肝脏荧光面积比较,差异无统计学意义(P>0.05)。见图7。
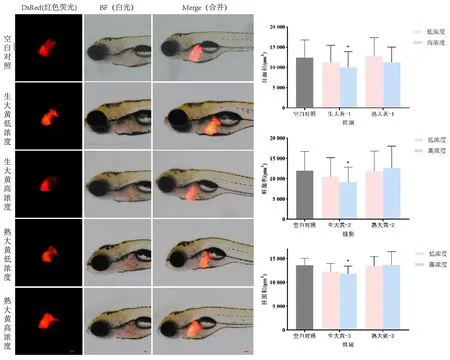
图7 生大黄、熟大黄对斑马鱼幼鱼肝脏荧光面积的影响(n=3)
3 讨论
大黄并非传统的毒剧中药,但因其生品苦寒之性峻烈,损伤脾胃功能,致使各种不良反应发生,因此,应对临床用药剂量进行严格控制。自2010年起,《中华人民共和国药典》建议大黄的用量从3~30 g/d减少到3~15 g/d,临床应用较为安全,然而,当应用于慢性病长期给药时,大黄潜在的肝毒性不容忽视。当前对大黄的多数研究常采用单体给药,仅关注中药成分中的单一毒性评价,但仅凭单体的毒性表现并不能断言大黄肝毒性的物质基础必然是其中的单个成分,而与其他成分无关。本研究并不只关注某个成分,而是选择结合蒽醌、游离蒽醌和鞣质3类成分,基于临床中药饮片炮制前后的真实生物学评价,通过化学分析结合生物学评价,对大黄的肝毒性进行评估。
本研究将7批生大黄分别炮制成熟大黄,利用高效液相色谱法和紫外分光光度法对生大黄、熟大黄中的结合蒽醌、游离蒽醌和鞣质进行含量测定,比较大黄炮制前后3类成分的含量差异。结果显示,生大黄中3种成分的含量为:鞣质(3.59%)>游离蒽醌(1.01%)>结合蒽醌(0.95%),而炮制成熟大黄后的含量为:游离蒽醌(1.27%)>结合蒽醌(0.64%)>鞣质(0.33%)。炮制后鞣质含量降低8~10倍,分析原因可能是:在炮制过程中温度较高,鞣质的化学性质不稳定,在高温下易被破坏,分解为单体后含量降低[13]。与生大黄比较,熟大黄的结合蒽醌含量减低,游离蒽醌含量升高,可能在双相水解过程中导致结合蒽醌的水解。
同时,以4 dpf斑马鱼幼鱼模型对炮制前后的大黄进行肝毒性评价,急性毒性实验结果表明,熟大黄的最大非致死浓度显著升高,约为生大黄的9倍,且3批大黄的毒性下降趋势几乎一致,表明大黄的炮制减毒作用客观存在。然后,在低于最大非致死浓度的暴露条件下,本实验通过表型、病理组织切片和整体吖啶橙染色来确定生、熟大黄暴露处理对斑马鱼幼鱼肝脏的影响,利用斑马鱼的光学透明性和荧光转基因特性,肝脏被确定为大黄毒性的靶器官。结果表明,与空白对照比较,生大黄能引起斑马鱼模型出现明显的肝损伤,如肝区域透明度降低,肝脏萎缩、卵黄囊吸收延迟、肝脏细胞变形及凋亡;而相同浓度下的熟大黄,仅在高浓度条件下呈现轻微的肝脏变性。这表明经炮制后,熟大黄对斑马鱼幼鱼肝脏的毒性大大降低。以上指标在不同条件下均表明生大黄能引起肝脏表型及组织结构的显著变化,引起细胞凋亡;而熟大黄的暴露处理对肝脏的损伤表现远轻于生大黄。
综上所述,大黄对斑马鱼幼鱼肝脏具有毒性作用,造成其不良反应的主要成分可能为鞣质类成分,炮制成熟大黄后该成分的含量以及对斑马鱼的急性毒性和肝损伤均显著降低。然而,其他化学成分是否也是毒性成分仍需要深入研究,关于大黄肝毒性的物质基础以及毒理学机制,还有待大量且全面的研究来阐明,以期提高大黄临床应用的安全性。
