国产盐酸溴己新可溶性粉在鸡体内的生物等效性评价
2022-12-12孙健李彦段笑笑郭莉莉吴宁鹏李慧素杨洁赵永达
孙健,李彦,段笑笑,郭莉莉,4,吴宁鹏,李慧素,杨洁,赵永达,4
(1. 青岛农业大学动物医学院,山东青岛 266109; 2. 青岛市动物疫病预防控制中心,山东青岛 266073;3. 河南省兽药饲料监察所,河南郑州 450015; 4. 青岛博霖生物科技有限公司,山东青岛 266111)
动物呼吸道因直接接触外界环境,易受环境、气候变化等因素的影响而诱发各种呼吸道疾病,如肺炎、支气管炎、支气管哮喘等。畜禽患呼吸道疾病的常见临床表现为咳嗽,流鼻涕,伸颈、张口呼吸,带有呼噜音或发不出声音,频繁甩头,严重时会因痰液过多而呼吸困难。近年来,畜禽呼吸道疾病多发且难以控制,引起呼吸道疾病的主要原因为多种复杂病原体、不利的环境因素、多重混合感染等,禽流感、鸡新城疫、传染性支气管炎等疾病也会诱发呼吸道症状[1]。畜禽类呼吸道疾病除需要对因治疗外,还应辅以镇咳、祛痰、平喘等药物来缓解呼吸道症状。祛痰药可以促进呼吸道分泌,降低痰液黏稠度,使痰液容易排出。盐酸溴己新(bromhexine hydrochloride)为半合成的鸭嘴花碱衍生物,最早由德国勃林格殷格翰公司开发,它可直接作用于支气管腺体,促进黏液分泌,降低痰液黏度,有利于黏痰的咳出[2],常用于急/慢性支气管炎、哮喘、支气管扩张等疾病的治疗[3],欧盟已批准用于牛、猪等畜类和禽类的呼吸道疾病治疗[4]。此外,盐酸溴己新还可增强对抗生素的吸收效果,提高疗效[5]。本试验根据文献[6]要求,以德国勃林格殷格翰公司生产的盐酸溴己新可溶性粉为参比制剂,以国产盐酸溴己新可溶性粉为受试制剂,通过鸡血浆中溴己新HPLC-MS/MS测定方法的建立,研究2种盐酸溴己新可溶性粉的生物等效性,为兽医临床盐酸溴己新可溶性粉的合理使用提供参考。
1 材料与方法
1.1 材料与试剂
盐酸溴己新,质量分数99.8%,批号100427-201903,中国食品药品检定研究院;受试制剂盐酸溴己新可溶性粉,规格1%,批号20200319,保定冀中药业有限公司;参比制剂盐酸溴己新可溶性粉,规格1%,批号0602506,德国勃林格殷格翰公司;甲醇、乙腈,色谱级,美国Sigma公司;甲酸,色谱级,德国Merck公司;不锈钢灌胃针,20号90 mm,创博环球(北京)生物科技有限公司;一次性负压采血管(含肝素钠),3 mL,山东奥赛特医疗器械有限公司;水为自制超纯水。
1.2 仪器与设备
高效液相色谱-串联质谱仪,配电喷雾离子源,Thermo Fisher TSQ Quantiva;3-30K高速台式离心机,美国Sigma公司;CenLee 4K台式低速离心机,湖南湘立科学仪器有限公司。
1.3 溶液的配制
盐酸溴己新标准储备液(1 mg/mL):准确称取盐酸溴己新11.15 mg于10 mL棕色容量瓶中,用甲醇溶解定容至刻度,摇匀,-20 ℃保存。
盐酸溴己新标准中间工作液(10 μg/mL):准确吸取盐酸溴己新标准储备液1 mL于100 mL棕色容量瓶中,用甲醇定容至刻度,摇匀。现配现用。
盐酸溴己新标准工作液:准确吸取一定量盐酸溴己新标准中间工作液,用超纯水稀释为所需浓度。现配现用。
0.1%甲酸乙腈溶液:取乙腈1 000 mL,加入1 mL甲酸,混匀。
30%乙腈溶液(含0.1%甲酸):取乙腈300 mL,加入0.3 mL甲酸,并用超纯水稀释定容至1 000 mL。
0.1%甲酸水溶液:取甲酸1 mL,用超纯水稀释定容至1 000 mL。
1.4 实验动物
随机挑选健康黄羽肉鸡(罗斯317)70只,体质量1.5~1.8 kg,雌雄各半,河南后羿生物工程股份有限公司提供。肉鸡每天定时给料2次,饲料不含药物,自由饮水,给药前适应性饲喂10 d,并记录鸡群每天的精神状态、饮水、采食等情况。动物房和隔离器使用前用甲醛+高锰酸钾熏蒸、消毒3 d,隔离器温度18~25 ℃,相对湿度30%~50%。
1.5 样品处理与测试条件
1.5.1 样品处理
血浆样品自然解冻后,取0.2 mL于离心管中,加入0.1%甲酸乙腈溶液1 mL,涡旋2 min,以10 000 r/min离心10 min。取上清液0.3 mL,加入超纯水0.7 mL,混匀,过0.22 μm有机滤膜。
1.5.2 溴己新浓度测定
血浆样品按1.5.1节方法处理后,使用高效液相色谱-串联质谱仪分析测定。每批样品测定前须重新制备空白基质匹配标准曲线,线性范围0.2~30 ng/mL,并制备500 ng/mL、100 ng/mL、10 ng/mL、5 ng/mL 4个浓度水平的质控样品。超出检测线性范围的,使用空白基质稀释后重新测定。
1.5.2.1 色谱条件
色谱柱,Waters ACQUITY BEH C18(100 mm×2.1 mm,1.7 μm);柱温,30 ℃;进样量,2 μL;流动相A相为乙腈,B相为0.1%甲酸水溶液;流量,0.3 mL/min。梯度洗脱程序见表1。
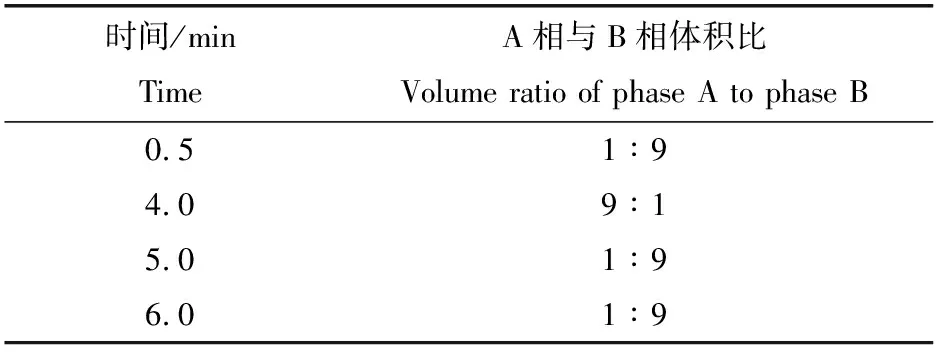
表1 梯度洗脱程序
1.5.2.2 质谱条件
离子源,电喷雾离子源;扫描方式,正离子扫描;检测方式,多反应监测(multi reaction monitor,SRM);电离电压,3.0 kV;鞘气,20(相对单位);辅助气,5(相对单位);离子迁移管温度,300 ℃;雾化温度,350 ℃。定性离子对、定量离子对及碰撞能等参数见表2。

表2 溴己新的定量离子对、定性离子对及碰撞能
1.6 方法学考察
参照文献[7]进行溴己新浓度测定方法学验证。
1.6.1 方法特异性考察
取6份来自不同鸡的空白血浆,各取0.2 mL,按1.5.1节方法处理,按1.5.2节测试条件测定。考察本试验条件下方法特异性,分析是否存在内源性物质干扰。
1.6.2 基质匹配标准曲线绘制
取8份鸡空白血浆,按1.5.1节方法处理,离心后分别取上清液0.3 mL,加入超纯水0.65 mL及一定浓度盐酸溴己新标准工作液0.05 mL,使盐酸溴己新浓度分别为0.2 ng/mL、0.5 ng/mL、 1 ng/mL、2 ng/mL、5 ng/mL、10 ng/mL、20 ng/mL、30 ng/mL,按1.5.2节测试条件测定。以测得的溴己新定量离子峰面积为纵坐标(y轴),以溴己新浓度为横坐标(x轴),1/x2为权重系数,进行线性回归,绘制基质匹配标准曲线,得回归方程和相关系数。
1.6.3 检测限与定量限确定
取鸡空白血浆6份,添加不同浓度的盐酸溴己新标准工作液,按1.5.1节方法处理,按1.5.2节测试条件测定,分别将信噪比>3、信噪比>10确定为检测限和定量限。
1.6.4 精密度与回收率考察
取鸡空白血浆24份,分别添加不同浓度盐酸溴己新标准工作液,进行盐酸溴己新浓度分别为5 ng/mL(定量限)、10 ng/mL(低浓度)、100 ng/mL(中浓度)和500 ng/mL(高浓度)的添加回收试验,计算回收率。每个浓度水平设6个平行样品,重复3次,每批次间隔1 d以上。计算回收率和精密度平均值及批内、批间变异系数。
1.6.5 反复冻融稳定性考察
取鸡空白血浆8份,分别添加一定量盐酸溴己新标准工作液,配制盐酸溴己新浓度分别为500 ng/mL(高浓度)和10 ng/mL(低浓度)的血浆样品,每个浓度4个平行,-20 ℃冷冻12 h,然后取出常温融化,反复冻融3次,得冻融后血浆样品。取冻融后血浆样品0.2 mL,按1.5.1节方法处理,按1.5.2节测试条件测定,考察盐酸溴己新的稳定性。
1.6.6 样品溶液储存稳定性考察
取鸡空白血浆12份,分别添加一定量盐酸溴己新标准工作液,配制盐酸溴己新浓度分别为500 ng/mL(高浓度)、100 ng/mL(中浓度)、10 ng/mL(低浓度)的血浆样品,每个浓度4个平行,按1.5.1节方法处理后,所得样品分别在自动进样器中4 ℃放置24 h、48 h、72 h,并按1.5.2节测试条件测定,考察样品溶液中盐酸溴己新的储存稳定性。
1.6.7 基质效应考察
取5份来自不同鸡的空白血浆,每份一分为二,分别添加一定量盐酸溴己新标准工作液,配制盐酸溴己新浓度分别为500 ng/mL(高浓度)、5 ng/mL(低浓度)的血浆样品,每个浓度5个平行,按1.5.1节方法处理,按1.5.2节测试条件测定,考察不同鸡空白血浆的基质效应。
1.6.8 稀释可靠性考察
取鸡空白血浆5份,分别添加一定量盐酸溴己新标准工作液,配制盐酸溴己新浓度1 000 ng/mL血浆样品。取血浆样品0.2 mL,按1.5.1节方法处理后,用空白基质稀释10倍制成样品稀释溶液,按1.5.2测试条件测定稀释溶液,考察样品的稀释可靠性。
1.6.9 残留效应考察
在鸡空白血浆中添加一定量盐酸溴己新标准工作液,配制盐酸溴己新浓度600 ng/mL血浆样品,按1.5.1节方法处理,按1.5.2节测试条件测定,进样顺序为血浆样品—空白血浆,考察高浓度血浆样品进样后的残留情况。
1.7 生物等效性试验
1.7.1 设盲
申请者去除参比制剂、受试制剂外包装并另行统一包装,以A、B字母标记区分。设盲人员按照鸡编号随机对应给予A药或B药。鸡的编号对应的给药字母作为一级盲底,A和B字母对应的药物作为二级盲底,分别由设盲人员和申请者保存。
1.7.2 给药剂量与给药方法
受试制剂、参比制剂均以盐酸溴己新可溶性粉计,单次给药剂量为250 mg/kg。
根据鸡体质量,计算并准确称取受试制剂、参比制剂,分别用超纯水溶解并吸取至注射器中,然后给注射器编号,并按照设盲程序,将鸡编号与注射器编号对应。给药时,将注射器中的药液全部灌入鸡胃,再使用3~5 mL生理盐水冲洗灌胃针并灌入鸡胃。给药过程持续时间不超过1 min,给药完成后,立即开始计时。
1.7.3 血浆样本采集
鸡采用侧卧方式保定,翅下静脉设置留置针,于采血开始后2 h拆除。每次使用留置针采血时,弃去前端0.5 mL血液,采血后立即向留置针管帽中注入肝素钠溶液约0.5 mL抗凝。采血分别于给药前0 min以及给药后2 min、4 min、8 min、12 min、16 min、20 min、25 min、30 min、45 min、1 h、2 h、4 h、8 h、12 h、24 h进行,每次采血约1.5 mL至一次性负压采血管(含肝素钠)。采集的血浆样本以4 000 r/min离心10 min,移取上层血浆至带标记的离心管中,于-20 ℃冷冻保存,作为血浆样品。
1.8 数据处理
采用Phoenix WinNonlin 5.2.1软件中的非房室模型,按照采血时间和所测得的溴己新浓度计算盐酸溴己新在鸡体内的药物代谢动力学参数,包括从0到计算时间(t)药时曲线下面积(AUC0-t)、从0到无限长时间(∞)药时曲线下面积(AUC0-∞)、峰浓度(Cmax)、峰时间(tmax)、消除半衰期(t1/2β)等。其中AUC0-t值、AUC0-∞值、Cmax经自然对数转换后,采用软件SPSS 22.0多因素方差分析法(ANOVA)进行显著性检验,采用双侧t检验法和90%置信区间法评价药品生物等效性。
2 结果与分析
2.1 方法学验证
由图1可知,溴己新保留时间3.5 min,血浆样品中溴己新与杂质峰分离效果较好,峰形良好,杂质对溴己新的测定无干扰,方法特异性好。
详细的方法学研究结果显示:血浆中溴己新浓度为0.2~30 ng/mL时,溴己新浓度与峰面积线性关系良好,相关系数大于0.99;血浆中溴己新检测限为2 ng/mL,定量限为5 ng/mL;盐酸溴己新浓度5~500 ng/mL范围内,批内平均回收率91.6%~116.2%,批内变异系数1.8%~7.8%,批间平均回收率98.1%~110.3%,批间变异系数3.7%~7.7%,变异系数均小于15%,精密度符合要求。结果见表3。
此外,盐酸溴己新在鸡血浆中反复冻融3次后,溴己新稳定性良好,且处理后的样品溶液4 ℃保存72 h后仍稳定,不同浓度检测均值与标示浓度的相对标准偏差均小于15%。6份来自不同鸡的空白血浆存在不同程度的基质增强效应,定量计算时须采用基质匹配标准曲线进行外标法校正。血浆样品稀释10倍后,5份样品的盐酸溴己新浓度检测相对标准偏差为1.68%,表明不存在稀释效应。残留效应考察结果显示,高浓度血浆样品进样后,在空白样品中的残留小于0.1%,表明本方法残留效应较小。上述方法学验证结果说明本方法满足检测要求。
2.2 生物等效性试验结果
2.2.1 两种盐酸溴己新可溶性粉在鸡体内的药物代谢动力学参数
通过分析,A组(参比制剂)主要药物代谢动力学参数为:AUC0-t值(575.55±308.75)h·ng/mL,AUC0-∞值(636.56±325.58)h·ng/mL,Cmax=(164.09±152.04)ng/mL,tmax=(0.86±1.18)h,t1/2β=(4.70±1.95)h。B组(受试制剂)主要药物代谢动力学参数为:AUC0-t值(551.13±371.33)h·ng/mL,AUC0-∞值(621.18±396.46)h·ng/mL,Cmax=(128.50±83.83)ng/mL,tmax=(0.86±1.32)h,t1/2β=(4.96±2.34)h。参比制剂、受试制剂的主要药物代谢动力学参数无显著性差异(p>0.05)。
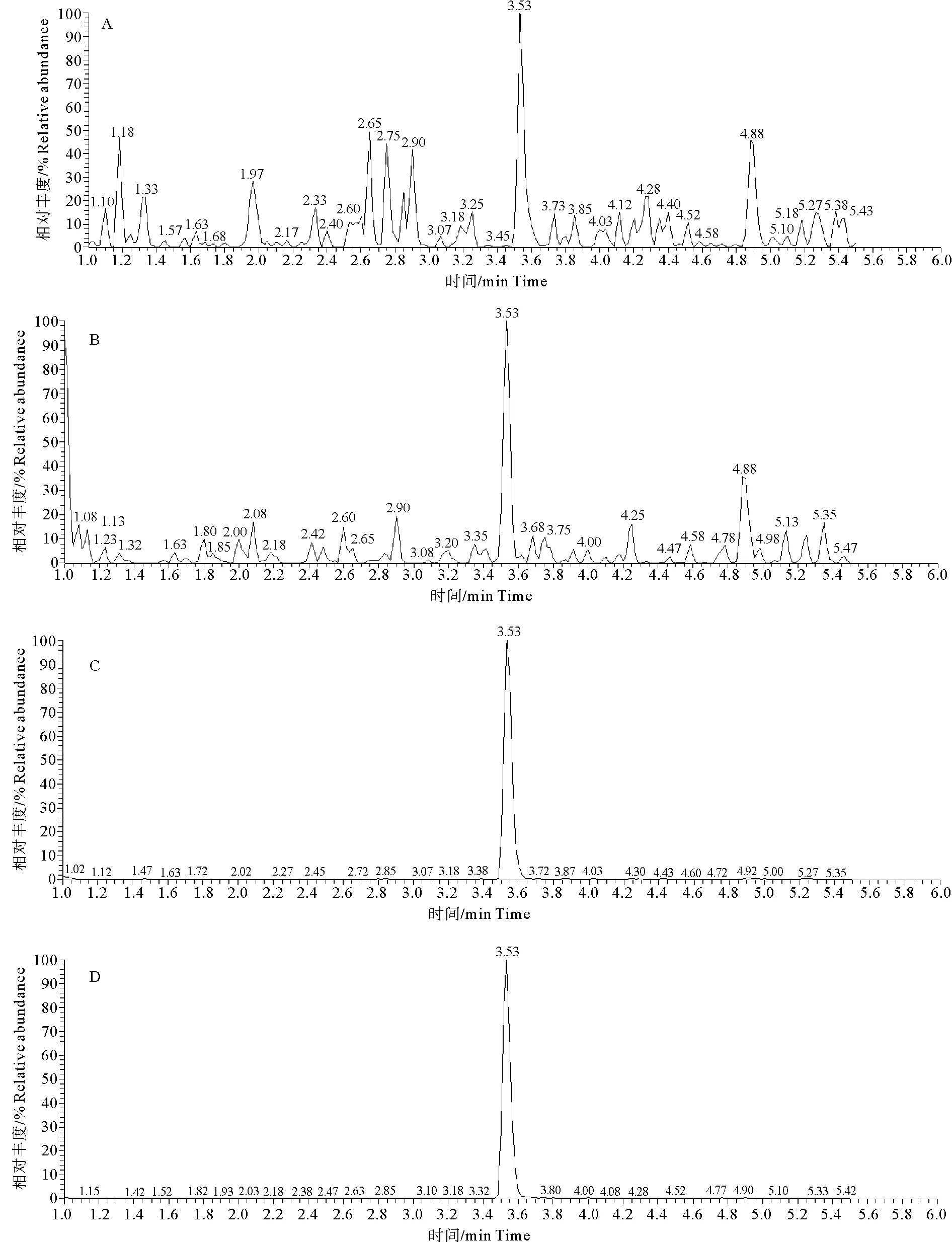
A. 空白溶剂;B. 空白血浆; C. 添加2 ng/mL盐酸溴己新血浆样品;D. 添加5 ng/mL盐酸溴己新血浆样品;E. 实测样品。
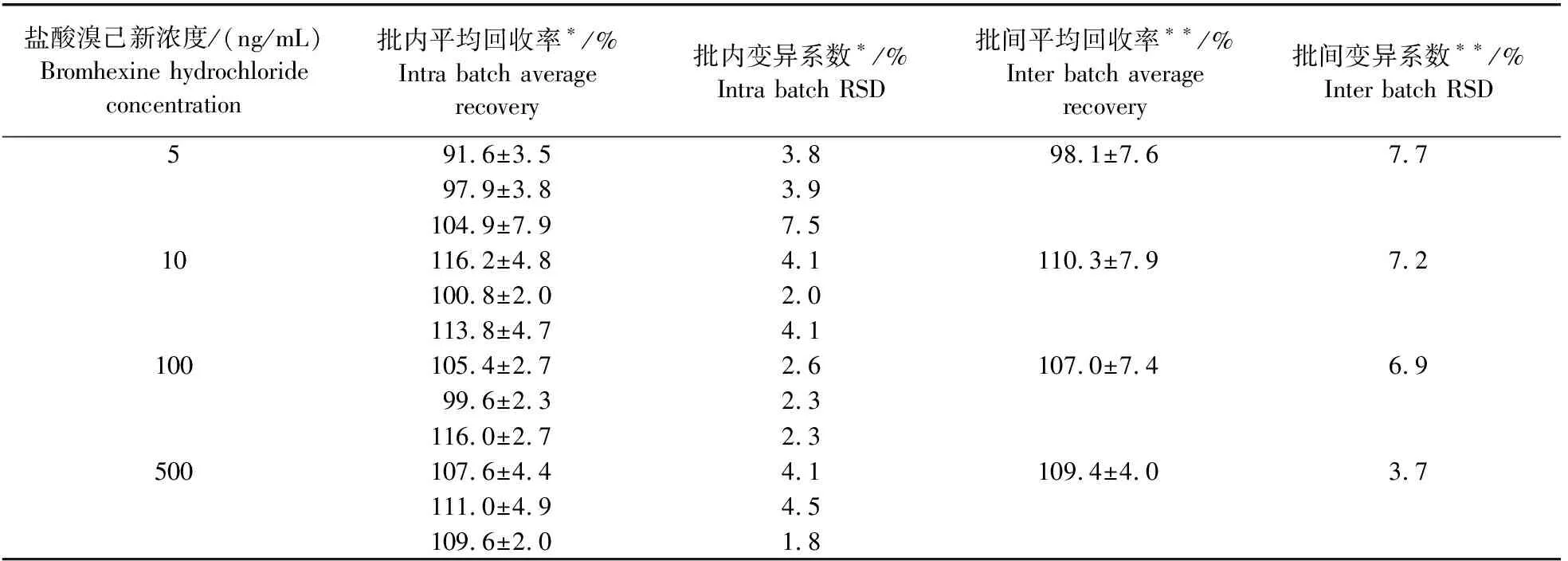
表3 鸡血浆中溴己新的回收率及精密度
2.2.2 生物等效性分析
经二次揭盲,A药为参比制剂,灌服A药的鸡为A组,B药为受试制剂,灌服B药的鸡为B组。两种制剂的血药浓度-时间曲线见图2。
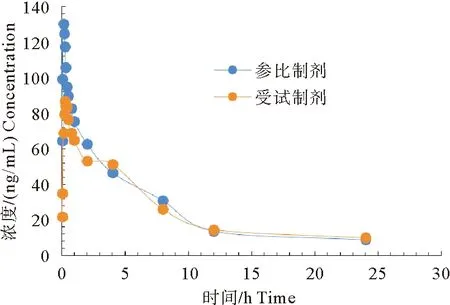
图2 两种盐酸溴己新可溶性粉口服给药后 在鸡体内的浓度-时间曲线
AUC0-t值、AUC0-∞值、Cmax经自然对数转换后,参比制剂、受试制剂数据间均无显著性差异(p>0.05),p值分别为0.52、0.63、0.48。生物等效性分析结果显示,受试制剂AUC0-t的90%置信区间为95.02%~102.14%,符合在80%~125%之间的要求[6];AUC0-∞的90%置信区间为95.57%~102.39%,符合在80%~125%之间的要求[6];Cmax的90%置信区间为93.18%~103.51%,符合在70%~143%之间的要求[6]。
3 讨论
盐酸溴己新是呼吸道疾病辅助性用药,目前已有盐酸溴己新在多种动物体内的药物代谢动力学研究报道,结果说明盐酸溴己新具有吸收迅速、分布广泛、蛋白结合率高、血浆清除率低、分布容积大等特征。Iwaki等[8]以大鼠为实验动物,分别静脉注射0.3 mg/kg、1 mg/kg剂量的盐酸溴己新,结果显示:注射剂量为0.3 mg/kg时,AUC0-∞值为(789±295)h·ng/mL,t1/2β为(9.41±2.26)h;注射剂量为1 mg/kg时,AUC0-∞值为(2 181±425)h·ng/mL,t1/2β为(12.80±4.51)h。Iwaki等[8]还研究了盐酸溴己新的绝对生物利用度,当按10 mg/kg、25 mg/kg剂量分别给药后,AUC0-∞值分别为(535±57)h·ng/mL和(1 315±394)h·ng/mL,与静脉注射1 mg/kg剂量时所得AUC0-∞值比较,得盐酸溴己新的绝对生物利用度为1.8%±3.9%。绝对生物利用度低可能是由首过效应引起的。
de Backer等[9]采用单交叉试验设计,分别通过静脉注射1 mg/kg剂量、口服2 mg/kg剂量2种方式给药,研究盐酸溴己新在马体内的生物利用度。结果显示:静脉注射给药组t1/2β为(3.57±0.59)h,体清除率为(52.93±4.29)mL·kg-1·min-1,表观分布容积为(16.23±2.25)L/kg,AUC0-∞值为(289.80±21.65)h·ng/mL;口服给药组tmax为(1.17±0.24)h,Cmax为(13.97±2.71)ng/mL,AUC0-∞值为(33.23±2.71)h·ng/mL,生物利用度为5.73%±0.21%。Vandecasteele-Thienpont等[10]进行了犬体内盐酸溴己新的生物等效性研究,发现盐酸溴己新在犬体内的药物代谢动力学特征符合二室开放模型,口服给药时生物利用度较低,可能存在首过效应。
Dutta等[11]进行了兔联合使用阿莫西林和盐酸溴己新的生物利用度研究,设置3个口服给药试验组,分别单独服用46 mg/kg剂量的阿莫西林、1.5 mg/kg剂量的盐酸溴己新,以及阿莫西林(剂量46 mg/kg)与盐酸溴己新(剂量1.5 mg/kg)混合物。结果说明联合使用阿莫西林和盐酸溴己新对溴己新tmax、Cmax等参数没有影响。
根据欧洲药品管理局(European Medicines Agency,EMA)发布的盐酸溴己新总结报告可知[4]:盐酸溴己新口服后能被猪迅速吸收,1~3 h内血药浓度达到峰值,在第2次或第3次给药后12 h时,达到稳态血药浓度;被牛口服后的数小时内,血药浓度会逐渐升高;被鸡或火鸡口服后,2~4 h内血药浓度可达到峰值。盐酸溴己新有亲脂性,对脂质组织有很高的亲和力,在这些组织里消耗缓慢。盐酸溴己新在不同靶动物体内的半衰期不同,在猪体内为20~30 h,在牛体内为40~50 h,在鸡或火鸡体内为40~50 h。该报告还显示:猪单次肌肉注射0.5 mg/kg剂量的盐酸溴己新1.5 h时,血药浓度达到峰值,t1/2β为7.3 h;注射部位盐酸溴己新清除迅速,给药后24 h时,注射部位盐酸溴己新仅剩余约4%;而对于鸡或火鸡,按1 mg/kg剂量连续口服5 d,在最后一次给药后2~4 h时,血药浓度达到峰值。
本文建立的鸡血浆中溴己新浓度测定方法稳定性好,准确度、精密度、检测限和定量限均满足生物样品定量分析要求,可为盐酸溴己新可溶性粉在鸡体内生物等效性研究提供可靠的浓度测定方法。根据该方法,测得国产盐酸溴己新可溶性粉、德国勃林格殷格翰公司生产的盐酸溴己新可溶性粉2种制剂在鸡体内的tmax、Cmax及药时曲线下面积等参数均无显著性差异,说明两者具有生物等效性,有相似的临床疗效。另外,药物代谢动力学参数tmax与文献[8-10]数据略有差异,可能与靶动物品种有关。
