近十万例胃黏膜活检样本中幽门螺杆菌检测结果分析
2022-12-12吴俊秀王晓伟陈皇王也钟定荣
于 芳,吴俊秀,王晓伟,陈皇,王也,钟定荣
(1.中国医学科学院北京协和医学院 研究生院,北京 100006;2.中日友好医院病理科,北京 100029)
1994 年,国际癌症研究机构将幽门螺旋杆菌(Helicobacter Pylori,HP)列为胃癌的Ⅰ类致癌因子。HP 感染已经成为全球性的严重危害人类健康的公共卫生问题。一项来自六大洲、囊括73 个国家、基于40 多万人的HP 检测结果显示,全球HP 的总体患病率为44.3%,发达国家HP 的感染率明显低于发展中国家(34.7% vs.50.8%)[1]。我国的HP感染率为55%[2]。不同地区、不同国家HP的感染率存在很大差异,HP感染状况可能与经济水平、受教育程度、饮食习惯、生活方式、医疗卫生条件等因素相关。
本研究收集中日友好医院2020年之前共5年的胃黏膜活检标本,分析HP 感染情况、分子分型、感染强度。试图探讨HP 感染与性别、年龄的相关性。
1 资料和方法
1.1 研究对象
回顾性收集中日友好医院2016年1月—2020年12 月间送病理科的胃镜活检标本98318 例,HP检测共102639 人次,其中男47445 例(48.26%),女50873 例(51.74%);年龄12~95 岁,平均51.1岁。所有病例均经病理学检查,结果由2 位以上具相关资质的病理医师出具,其中至少包括1 名主治以上职称的医师。
1.2 方法
1.2.1 检测设备及方法
采用实时荧光定量PCR 法,按说明书步骤进行检测。核酸提取试剂盒购自武汉纳磁生物科技有限公司,运用NanoMaBio S-96自动核酸提取仪进行核酸提取。PCR反应液购自北京新基永康生物科技有限公司,7500 型实时荧光定量PCR 仪购自ABI公司(美国)。
1.2.2 诊断标准
临床分离株分为Ⅰ型和Ⅱ型,Ⅰ型菌株能产生细胞毒素相关蛋白(CagA)和空泡毒素(VacA),Ⅱ型菌株不产生CagA 和VacA。根据仪器软件系统绘制的实时扩增曲线判断检测结果。方法参考试剂盒说明书。
1.2.3 分组比较方法
将接受活检人群按性别分组,按年龄<20 岁、20~29岁、30~39岁、40~49岁、50~59岁、60~69岁、>70 岁进行分组。比较HP 感染在不同性别、年龄中的差异。
1.3 统计学方法
采用SPSS22.0 软件进行统计学处理,计数资料组间比较采用χ2检验。各级变量间相关性采用Spearman等级相关分析。
2 结果
2.1 HP感染检测结果
表1示:进行胃黏膜活检共98318例,HP总检出率为23.7%。2016年—2020年的HP检出率,分别为26.8%、24.6%、23.4%、22.6%、19.0%。
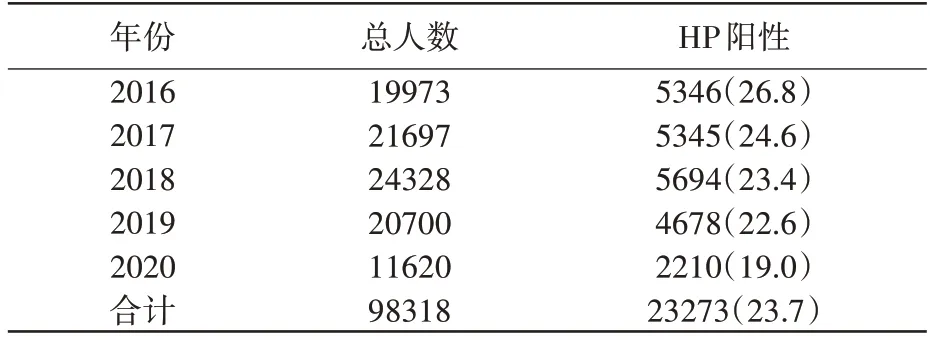
表1 2016年~2020年中日友好医院HP感染情况 n(%)
HP 分型结果:HPⅠ、Ⅱ型患者的检出率分别为22.1%(21699/98318)和1.6%(1574/98318)。Ⅰ型占比93.2%,Ⅱ型占比6.8%。HP 感染强度占比见图1。
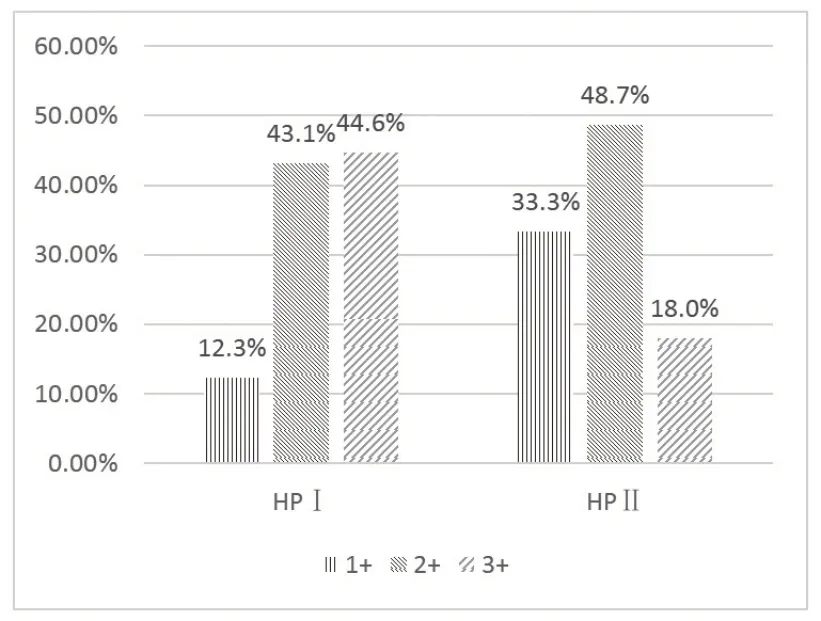
图1 2016年~2020年中日友好医院HP感染强度分布
2.2 不同性别HP抗体分型及感染强度情况分析
表2 示,男性HP 检出率高于女性(25.7%vs.21.8%),HP 感染在不同性别中差异有统计学意义(P<0.01)。男性患者中HPⅠ、Ⅱ型占比分别为93.5%、6.5%,女性患者中HPⅠ、Ⅱ型占比分别为92.9%、7.1%。男性患者中HP 感染阳性强度1+、2+、3+占比分别为13.5%、42.9%、43.6%,女性患者为13.9%、44.1%、42.0%。其中HP分型结果、感染强度在不同性别中的差异均无统计学意义(P>0.05)。
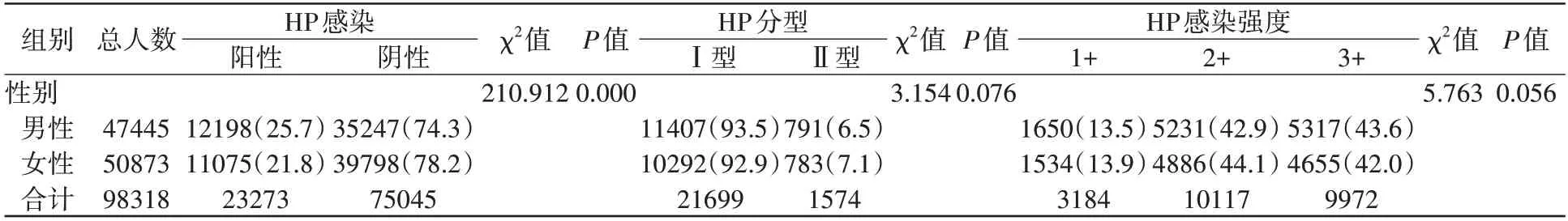
表2 不同性别HP分型及感染强度 n(%)
2.3 不同年龄HP抗体分型及感染强度情况分析

表3 不同年龄组HP分型及感染强度 n(%)
图2 示,不同年龄组患者的HP 检出率分别为19.54%、29.25%、29.82%、27.09%、23.14%、18.98%、14.02%,在20~49岁4个年龄组中均高于20%。表3示,HP感染率、感染强度在不同年龄组中差异均有统计学意义(P<0.01)。HP分型结果在不同年龄组中差异无统计学意义(P>0.05)。但HP感染强度并未随着年龄增大而明显增强(r=0.013,P=0.043)。
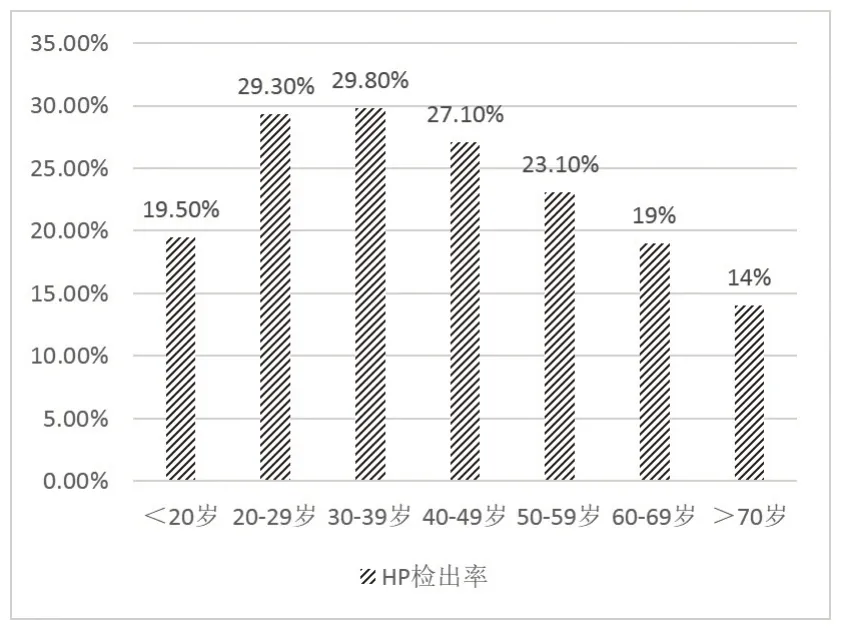
图2 各年龄组中HP检出率
3 讨论
3.1 HP感染率的地区差异分析
全球调查系统显示,2015年全球约有44亿人口感染HP[3]。我国最近一次跨省市大规模HP 感染流行病学调查于2002—2004年进行,对全国19个省市的一般人群进行了HP 感染率的调查,结果显示HP 感染率在我国不同地区存在较大差异,HP 流行病学调查的总感染率为56.22%[4]。本研究针对来医院就诊人群,HP 的总检出率为23.67%,明显低于2002—2004 年的调查结果。我国的一项研究显示,以南京为代表的中国东南部HP 感染率在2003~2012 年间以每年2%的速度降低[5]。2010 年调查研究发现西藏地区的HP 感染率在全国居于首位,约为84.62%[4]。而2018 最新研究显示西藏地区HP 感染率下降至51.6%[6]。可见我国各地区HP 感染率正在降低。本研究结果也显示HP检出率在2016年—2020年有逐年下降趋势。但本研究人群为来我院就诊行胃镜检查者,并非自然人群,不能代表自然人群的感染率,但5年间近十万的HP 分型及感染强度的分析,可做为开展流行病学调查的基础。分析HP 感染率下降的可能原因:本研究观察对象主要是在北京城区居住或工作的成年群体,个人卫生习惯良好,生活条件较优越,居民健康素养较高,降低了HP在人群中的传播。
3.2 HP分型、HP感染强度检测的必要性
本研究采用实时荧光定量PCR 方法检测HP感染情况,包括HP 分子分型及感染强度。Ⅰ型HP 因含有CagA 和VacA 基因而有强致病性。CagA 是胃癌患者胃黏膜中最常见的HP 菌株毒力基因[7]。因不同基因型HP之间致病性差异大,HP阳性患者的临床结局除与宿主个体差异有关外,还与HP的分型结果有关[8]。本研究显示,HP感染者以Ⅰ型为主,HPⅠ型和HPⅡ型检出率为14∶1。且Ⅰ型感染者中以感染密度大的2+、3+为主。以往研究表明HP 感染密度越高,感染者胃糜烂、胃溃疡的发生率越高,抗生素治疗的根除率也越低[9]。HP 分型、HP 感染强度的检测非常重要,有助于我们了解HP 的毒力和致病性,从而制定最科学有效的根除治疗方案,对临床治疗和预后有着非常重要的指导意义。
3.3 HP感染的性别差异
本研究中HP 感染存在性别差异,男性阳性率高于女性(P<0.05),与类似研究报道一致[10]。男性感染率之所以高于女性,分析可能的原因为男性人群中吸烟、喝酒者所占比例高于女性,而吸烟增加了受检者根除HP 治疗的失败率[11],并且失败率与受检时的吸烟状态和吸烟量有关。研究表明有饮酒和吸烟习惯的受检者发生HP 感染的比例高于无饮酒及吸烟习惯者[10]。而且男性相比女性承受着更重的工作压力和经济压力,人体神经系统和内分泌系统调节着消化系统的功能,当有严重心理障碍和心理负担时会导致胃内胃酸分泌过多,反之当压力缓解时胃酸分泌减少[12],通过胃酸分泌的多少,改变胃内pH值,从而影响胃内HP的生存环境。男性社交比较频繁,在外就餐较多,卫生意识差,增加了HP 感染风险。可见吸烟、饮酒、熬夜、压力等不良的生活习惯都是男性感染率高于女性的重要因素。我们的研究结果并没有发现HP分型及感染强度在不同性别中存在差异。
3.4 HP感染的年龄差异
本研究中HP 感染率在各年龄组中存在差异(P<0.05)。HP 的感染率在20~29 岁组、30~39 岁组中最高,而后随着年龄的增大HP 感染率逐渐降低,>70 岁组最低。我们的研究结果与陈燕梅等[13]的研究结果相似,HP 感染主要集中在20~39岁的中青年,老年人HP 感染率降低。分析可能的原因:青年组人群喜爱进食刺激性食物;集体生活可能存在的交叉感染;生活、工作、家庭、情感压力较大;处于社会活动活跃期,较频繁在外就餐等。而70 岁之后除社交活动较少外,免疫力会有所降低,产生抗体的能力减弱,同时随着年龄增长胃部萎缩,腺体减少,胃黏膜发生严重的肠上皮化生,不利于HP在胃部定植[14]。
本研究结果显示,HP 分型结果与年龄无关。HP感染强度在不同年龄组中存在差异,但年龄与HP 感染强度的相关性并不很大(r=0.013,P=0.043)。而孟凡娜等[15]发现,2017 年在重庆地区,<30 岁、30~45 岁、46~60 岁和>60 岁人群的HP 感染率依次为14.31%、23.7%、28.29%和31.36%,可见地域和饮食因素对HP 感染率的影响不容忽视。长期的HP 感染被认为是导致胃癌的关键因素,因此我们需要深入了解HP 的流行病学特点。HP 是一种传染性致病菌,主要通过“口-口传播”和“粪-口传播”,这可能是家庭聚集性HP 感染的重要原因[16]。
我院近十万样本量的幽门螺旋杆菌检测结果显示,北京地区HP感染率有逐年降低的趋势,且趋于年轻化,主要以CagA+的Ⅰ型及感染强度强的2+、3+为主,男性HP感染率高于女性。本研究为单中心研究,涉及局部小范围地区人群,待后续收集全国多区域多中心数据,研究结论会更可靠。
