探究人参败毒散对肺炎小鼠干预调控以及线粒体自噬蛋白表达的影响
2022-12-12樊建设樊佳佳孙力超杨道文张洪波
王 柯,樊建设,樊佳佳,孙力超,杨道文,张洪波*
(1.北京中医药大学,北京 100029;2.中日友好医院 中医肺病科,北京 100029;3.中日友好医院 急诊科,北京 100029)
肺炎是临床常见疾病,细菌是最常见的致病诱因[1]。随着医学的发展,肺炎的研究获得了长足的进步,但由于抗生素的大量使用,导致获得性多重耐药的出现,因此肺炎的病死率仍较高[2]。长久以来,人参败毒散被广泛应用于感冒、咳嗽、肺炎等呼吸系统疾病的治疗,并取得了较好的疗效。其出自于《太平惠民和剂局方》[3],记载原文为:“治伤寒时气,头痛项强,壮热恶寒,身体烦疼,及寒壅咳嗽,鼻鼾声重,风痰头痛,呕哕寒热,并皆治之”。而人参败毒散是通过何种途径来干预调控肺炎过程以及其是否与自噬通路相关,目前仍尚不明确。本研究旨在揭示人参败毒散与肺炎的炎症反应有何相关性,以及自噬在肺炎中的作用,进一步探究人参败毒散是否能通过调节肺炎小鼠模型的自噬水平以减轻器官损伤。
1 材料与仪器
实验动物为SPF级别8~10周的ICR雄性小鼠24 只,体重25±2g。饲养条件为6 只/笼。照明条件:明暗交替各12h。动物饲养室:北京中医药大学SPF级动物饲养室(温度23℃,湿度45.4%)。
人参败毒散,由中日友好医院中药房煎制(柴胡9g,前胡9g,川芎6g,枳壳9g,羌活6g,独活6g,茯苓9g,炒桔梗6g,人参6g,甘草5g,生姜2 片,薄荷2g,浓煎100ml)。脂多糖(lipopolysaccharide,LPS 和3-甲基腺嘌呤(3-methyladenine,3-MA)均为美国Sigma-Aldrich公司产。
高效组织裂解液(solarbio 公司,中国);BCA法蛋白定量试剂盒(solarbio 公司,中国);IL-1β,IL-6,TNF-α 的ELISA 试剂盒(上海森雄,中国);P62,LC3B,β-actin 抗体(Sigma 公司,美国);HRP标记二抗(北京中杉金桥有限公司,中国)。
主要仪器设备:电子显微镜(日本JEM-1400Plus);电子天平(诸暨市超泽衡器设备有限公司);移液器(德国Eppendorf);舒式切片机(公司:樱花病理仪器株式会社);组织包埋机(樱花病理仪器株式会社,日本);BIO-RAD 酶标仪(美国产,721BR16681);BIO-RAD 电泳仪(美国产,042BR03674);旋转式组织脱水机(樱花病理仪器株式会社);石蜡溶蜡箱(樱花病理仪器株式会社);冰冻切片机(LEICA CM 1950);多功能酶标仪(美国MD公司)。
2 方法
2.1 肺炎小鼠模型建造
通过LPS 诱导的急性肺炎动物模型,已经被广泛应用于肺炎小鼠模型的构建[4,5]。预实验我们以10μg/只的LPS 剂量进行肺炎小鼠模型的构建,阴性对照组(Ctrl)小鼠采用同体积的0.9%氯化钠注射液滴鼻。分别在LPS 处理的3h、6h 和12h 处死小鼠,取其肺脏和肺泡灌洗液进行肺脏组织病理切片、肺脏炎症因子及肺泡灌洗液炎性细胞的观察,结果发现随着LPS处理时间的延长,小鼠肺损伤越来越严重,表明我们成功构建了LPS诱导肺炎小鼠模型。
2.2 分组、给药与取材
采用随机数字表法,将其平均分为4 个实验小组,即假手术组(Ctrl)、肺炎模型对照组(NC)、人参败毒散治疗组(Ginseng)和自噬抑制剂干预组(Ginseng+3-MA)。分组给药见表1。4 个实验小组均于术后6h处死取材肺脏。
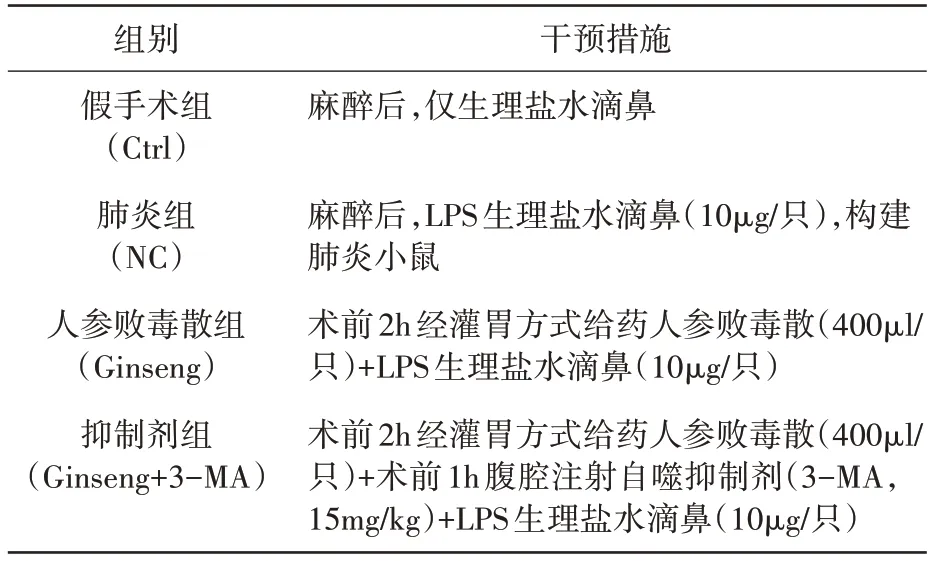
表1 实验分组及干预措施
3 观察及检测指标
3.1 肺组织病理学观察
取肺部组织,常规进行固定、石蜡包埋、切片以及脱蜡处理,通过HE 染色及脱水,于光镜下观察相关组织病理改变。
3.2 酶联免疫吸附法(ELISA)进行肺泡灌洗液检测
取出小鼠肺泡灌洗液,按ELISA 试剂盒相关说明,检测肺泡灌洗液中IL-1β、IL-6 以及TNF-α含量。
3.3 RNA 提取与细胞因子(IL-1β,IL-6 和TNFα)荧光定量PCR
对取出的肺组织,采用Trizol 法提取总RNA,并检测总RNA 的浓度。参照RNA 逆转录试剂盒说明完成逆转录,并合成cDNA。IL-1β 引物序列为上游:CATGGGATAACGAGGCTTATGT,下游:CATATGGACCAGACATCACCAA。IL-6引物序列为上游:CACTCACCTCTTCAGAACGAT;下游:GCTGCTTTCACACATGTTACTC。TNF-α 引物序列为上游:CCAGGGACCTCTCTCTAATCA;下游:TCAGCTTGAGGGTTTGCTAC。β-actin 引物序列为上游:GGACCTGACTGACTACCTCAT;下游:CGTAGCACAGCTTCTCCTTAAT。PCR 扩增程序为:50℃2min;95℃2min;(95℃15s;60℃30s)×40。反应结束后,用仪器自带软件分析样本Ct值,并参照相对定量法进行计算,得出相关mRNA的相对表达量。
3.4 血球计数板法及Wright-Giemsa 染色法观察肺泡灌洗液炎症细胞含量
先以血球计数板方法计数白细胞总数,再以Giemsa 染色计数巨噬细胞、中性粒细胞及淋巴细胞的数目。
3.5 蛋白质印迹法(Western Blot)检测肺部组织内LC3蛋白表达
低温剪碎小鼠肺组织,每20mg 组织混入200μl 裂解液。使用匀浆器匀浆,冰上静置1h 使组织完全裂解。在12000r/min 的条件下,使用高速离心机对配制好的组织匀浆液进行分离,取上清液放入温度为-80℃的冰箱中冷冻保存。BCA法测定样本蛋白浓度。根据目标蛋白的分子量制作不同浓度的凝胶,并进行上样、电泳。采用半干法转PVDF 膜后,5%脱脂奶粉室温封闭2h。根据说明书操作添加一抗,4℃孵育过夜,TBST 洗涤5min,添加二抗,室温孵育1h,TBST 洗涤5min。在条带上滴加适量显色液,用BIO-RAD 凝胶成像仪软件Image lab 5.2曝光并拍照,分析灰度值。
3.6 统计学方法
应用SPSS26.0 进行统计学分析,将所获得的实验数据以均数±标准差来进行对比。多个组别间比较,采用单因素方差相关分析。
4 结果
4.1 各组小鼠肺组织形态
NC 组经过LPS 处理后,在小鼠肺组织细支气管管壁周边可以观察到明显的炎性细胞浸润(图1,见封三)。人参败毒散(400μl/只)干预后,Ginseng组肺部损伤情况得到明显减轻(图1,见封三)。抑制剂组添加3-MA处理后,肺组织的炎性细胞浸润明显增多(图1,见封三)。
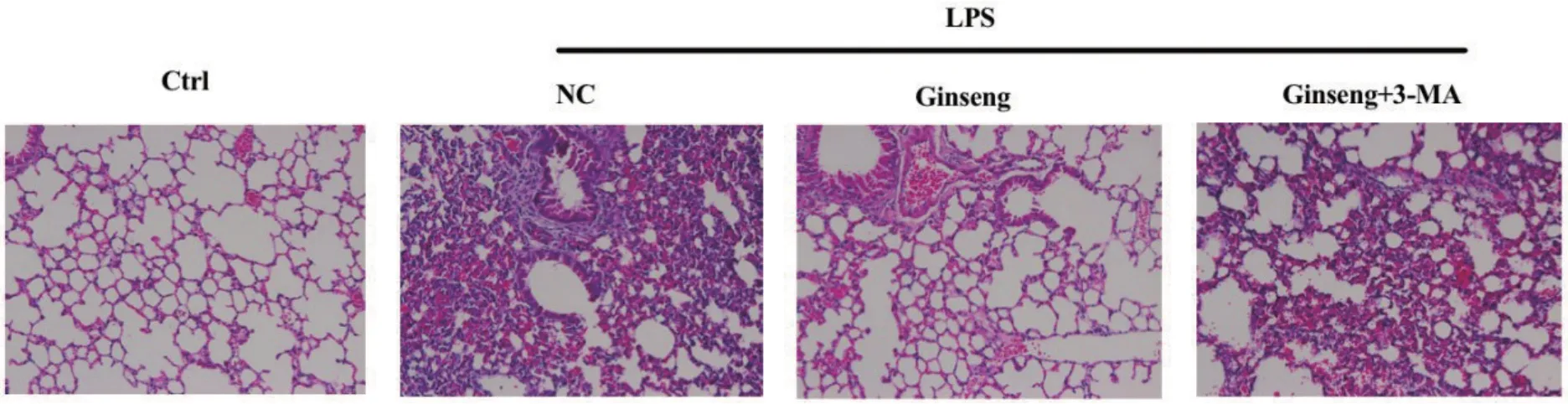
图1 各组小鼠的肺组织(HE×200)
4.2 肺泡灌洗液IL-1β、IL-6、TNF-α mRNA 水平
与LPS 对照组(NC)相比,人参败毒散干预组的IL-1β、IL-6、TNF-α 的mRNA 水平明显下降,具统计学意义(P<0.01)。自噬抑制剂组中IL-1β、IL-6、TNF-α 的mRNA 水平较人参败毒散组明显提高,具统计学意义(P<0.01)(图2A、2B、2C)。

图2 各组小鼠肺组织中细胞因子的表达水平
4.3 肺泡灌洗液IL-1β、IL-6、TNF-α蛋白水平
与LPS 对照组(NC)相比,人参败毒散干预组的IL-1β、IL-6、TNF-α 的蛋白水平明显下降,具统计学意义(P<0.01)。自噬抑制剂组中IL-1β、IL-6、TNF-α 的蛋白水平较人参败毒散组明显提高,具统计学意义(P<0.05)(图2D、2E、2F)。
4.4 肺泡灌洗液炎症细胞含量
经人参败毒散处理后,炎症细胞的数量减少;而经自噬抑制剂3-MA 处理,炎症细胞数量如白细胞(图3A)、巨噬细胞(图3B)、中性粒细胞(图3C)和淋巴细胞(图3D)都出现了不同程度的增加(P<0.05)。

图3 各组小鼠的肺泡灌洗液中炎性细胞含量
4.5 肺部组织内LC3蛋白表达
LPS 诱导的小鼠肺炎时,引起肺组织内自噬相关蛋白LC3Ⅱ/LC3Ⅰ比值的降低;经人参败毒散干预后,LC3Ⅱ/LC3Ⅰ比值显著升高(P<0.01)(图4、5)。与此同时,使用p62追踪选择性自噬过程,结果显示10μg LPS 处理小鼠6h 后,P62 蛋白水平呈升高趋势;与肺炎对照组相比,人参败毒散组P62蛋白水平显著下降。
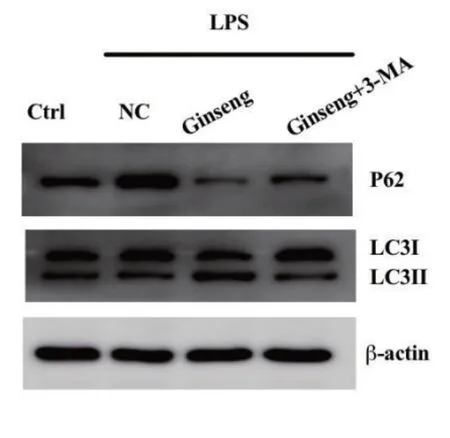
图4 WB蛋白条带
5 讨论
肺炎典型症状为发热、咳嗽、咳痰、痰中带血、呼吸困难等临床表现[6,7],归属于中医“咳嗽”和“肺痈”等病范畴。《中医内科疾病诊疗常规》[8]认为本病病因多由风热疫毒之邪自口鼻而入,首先犯肺,或肺本有伏热,复感外邪而发。
人参败毒散不仅是治疗虚人外感的经典名方,在我国古代亦被称为“治疫第一方”[9],当今多认为肺炎病因与风热疫毒之邪相关[8]。《素问·评热病论》中记载:“邪之所凑,其气必虚”。故方中人参扶助正气,鼓邪外出,为全方最为精妙之处,《张氏医通》[10]言其:“全在人参一味,力致开闔,始则鼓舞羌、独、柴、前各走其经,而与热毒分解之门,继而调御津精血气各守其乡,以断邪气复入之路”;羌活与独活一上一下,合而驱散一身之邪;柴胡味辛而发散,既有疏散退热之功,又有升举阳气之力;川芎与柴胡配伍,治风兼以调血,正所谓“治风先治血,血行风自灭”;桔梗宣肺开肺,枳壳降气止咳,升降相依,调畅人体气机;前胡化痰,茯苓化湿,生姜、薄荷解表散邪,国老益气和中,调和方中药性。君臣佐使各守其位,驱邪而不伤正,《增订叶评伤暑全书》称其为“调和之宗也”。临床上,刘立昌[11]应用人参败毒散治疗风咳、感冒等,十分有效;林磊[12]等人在一项关于人参败毒散与上呼吸道感染的报道指出,人参败毒散在治疗上呼吸道感染方面有重要作用,值得临床进一步推广应用;在《新型冠状病毒肺炎(COVID-19)经方防治推荐方案(国际第1 版)》[13]中,人参败毒散被推荐为群体性治疗用方。另有报道[13,14],人参败毒散及其变方在新冠肺炎的防治上取得较好的疗效。
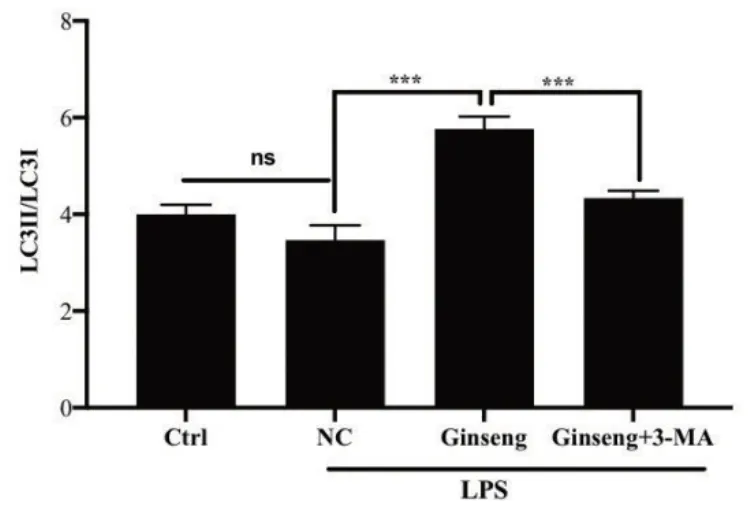
图5 WB条带灰度分析
基于现有的文献报告,自噬被广泛理解为保守的细胞内的降解途径,即可通过双层膜将本身受损的细胞器、错误蛋白质以及入侵的病原菌运至溶酶体降解,具有维持胞内微环境稳定的作用[15,16]。LC3 是参与自噬小体形成的主要蛋白,当自噬发生时,胞质型LC3(LC3Ⅰ)被激活,转变成膜型LC3(LC3Ⅱ)并附着于自噬体膜上,故LC3Ⅱ/LC3Ⅰ比值可评估自噬水平的高低[17]。LC3Ⅱ被认为是自噬的生物学标志[18],其表达水平与自噬呈正相关[19]。p62/SQSTM1 是自噬底物连接蛋白,含有多个结构域,可结合待降解蛋白将其运输至自噬体中,最终在溶酶体中降解[20]。因此,p62与细胞自噬呈负相关。在肺部的炎症性疾病发生发展中,自噬反应具有双重作用,细胞自噬一方面可能有利于病原菌的清除,另一方面,激活的自噬效应能增强肺部的炎症反应从而加重肺部损伤[21,22]。
本实验通过鼻腔滴注LPS 建立肺炎小鼠模型,我们发现在LPS(10μg/只)处理6h的小鼠肺组织中自噬相关蛋白LC3 的表达呈轻微降低趋势,而P62 呈明显上升趋势,提示LPS 处理6h 后可抑制自噬的形成。该结果揭露自噬在LPS建立的肺炎小鼠模型中可能有重要调控功能。我们进一步通过肺泡灌洗液测得了炎性细胞数量,结果显示LPS 处理后炎性细胞的数目明显增多。原理可能是自噬激活可促进中性粒细胞形成NETs,对外来性细菌发挥清除作用[23]。然而以10μg/只LPS 处理小鼠,极有可能是诱导了小鼠的急性肺损伤,进而造成了自噬的形成受阻,无法清除坏死的肺脏细胞。人参败毒散干预后,可将受阻的自噬重新激活,从而达到了减轻肺部炎性反应的效果,进而减轻了肺部损伤程度。予以3-MA(自噬抑制剂)处理后,LC3Ⅰ/LC3Ⅱ比值增加,P62 上升,使细胞自噬的程度减弱,肺部损伤的程度加剧。这揭示了自噬在减轻肺部炎症上具有重要的调节作用。
