外壳蛋白ε在非小细胞肺癌中作用的探索
2022-12-12谷润川杨雄涛王国辉许长丹葛舒童王昊高立伟
谷润川,杨雄涛,王国辉,许长丹,葛舒童,王昊,高立伟*
(1.中日友好临床医学研究所,北京 100029;2.昌平区医院 肿瘤科,北京 102200;3.天津市第一中心医院 放射治疗科,天津 300100;4.北京大学中日友好临床医学院,北京 100029;5.中日友好医院 放射肿瘤科,北京 100029)
肺癌在全球恶性肿瘤中发病率第二、死亡率高居榜首,在中国恶性肿瘤的发病率和死亡率统计数据中均居首位[1,2],其中非小细胞肺癌(nonsmall cell lung cancer,NSCLC)最常见,肺腺癌(lung adenocarcinoma,LUAD)和肺鳞癌(lung squamous cell carcinoma,LUSC)是NSCLC 中最常见的病理类型[3]。免疫球蛋白G样蛋白,也称唾液酸化免疫球蛋白G(sialylated-Immunoglobulin-G,SIA-IgG),在多种肿瘤组织均表达,我组前期工作发现,SIA-IgG 是ⅢA 期LUAD 患者术后放疗的独立预后因素并促进放射抵抗[4]。
在对SIA-IgG 的相互作用蛋白进行探索时发现外壳蛋白ε(coatomer subunit epsilon,COPE)与SIA-IgG 结合,结合量受射线照射影响。COPE 是外壳蛋白的7个组成亚单位之一(ε亚基),其他还有α-COP、β-COP、β'-COP、γ-COP、δ-COP、ε-和ζ-COP[5]。该复合体高度保守,并参与蛋白质在细胞内的运输[6]。研究发现,COPE 功能缺陷细胞中COPE 降解增多,并在不低于37℃环境中引发多种内吞和分泌缺陷[7]。此外,COPE 还参与中枢神经脉络丛炎症,猪细小病毒感染等过程[8]。现有文献对COPE 与NSCLC 的关系鲜有报道。本研究用免疫沉淀联合液相质谱分析COPE 与SIA-IgG的结合,并对COPE 在NSCLC 中的作用进行探索,研究设计思路见图1。
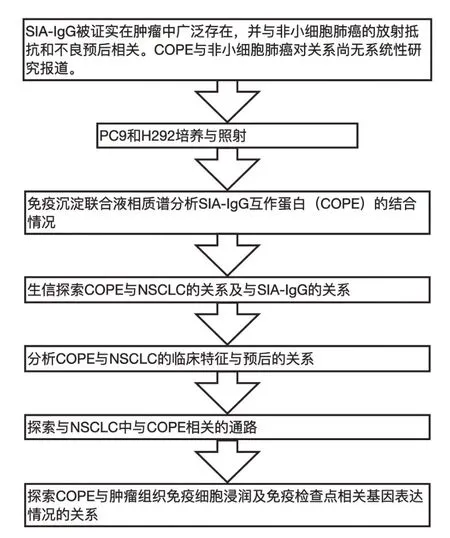
图1 研究设计路线图
1 方法
1.1 细胞培养及照射
NSCLC 细胞系PC9 和H292(10%胎牛血清,1%双抗的RPMI-1640 培养基)于37℃、5%CO2培养,取对数生长期的细胞,Varian 医用直线加速器照射(6MV,X 线,6Gy,300cGy/min)并迅速放回孵箱中,依实验需要处理。
1.2 免疫沉淀-液相质谱分析
取照射后2h、6h、12h、24h、36h、72h 细胞洗涤并加入适量含抑制剂的裂解液,冰上裂解5~10min 后刮下至离心管,13000rpm 4℃离心15min,取上清,加入适量RP215(北京大学医学部免疫系邱晓彦教授课题组馈赠)4℃过夜。加入适量Protein A&G 磁珠室温孵育1h。磁分离、洗涤并洗脱。将所得样品送至北京大学医学部基础医学院质谱中心分析。
1.3 COPE的泛癌表达情况分析
在Kaplan Meier Plotter 在线数据分析平台(https://kmplot.com/analysis/),以“COPE”为探针检索并分析TCGA(The Cancer Genome Atlas)、GEO(Gene Expression Omnibus)以及EGA(European Genome-phenome Archive)数据库中多种不同来源肿瘤组织中COPE 的表达情况(以正常肺组织中COPE的表达水平作为对照)。
1.4 COPE在肺腺癌与肺鳞癌中的表达情况分析
在TCGA 数据库以“lung adenocarcinoma”和“lung squamous cell carcinoma”为检索词获取肺腺癌和肺鳞癌肿瘤组织RNAseq数据(level3)及临床信息。在GTEx(genotype-tissue expression)数据库中以相同策略检索并获取正常组织测序信息作对照,将数据分为LUAD 组、LUSC 组及Normal组,用R(v4.0.3,以下省略)boxplot 绘制箱线图,Kruskal Wallis检验肿瘤与正常肺组织COPE差异情况(α=0.05)。
1.5 COPE与SIA-IgG表达情况验证
在GEO中筛选包含COPE和IGHG1表达信息且同时包含肿瘤测序信息和正常肺测序信息的数据集,log2 化处理后用normalize.quantiles 标准化。将探针ID 转化为gene symbol 并剔除可同时匹配多个基因的探针ID。用remove Batch Effect 去批次效应,ggord 绘制PCA 图作质控,boxplot 绘制箱线图,Wilcox 检验COPE 与IGHG1 的差异(α=0.05)。
1.6 免疫组化对比分析
在HPA 数据库以“COPE”为检索词检索并查阅正常肺和肺肿瘤组织COPE 免疫组化档案。选同型号抗体染色的正常肺、肺腺癌和肺鳞癌免疫组化图进行分析。HPA 数据库中已将免疫组化样本分为高、中、低、未见,本研究对不同分组进行秩和检验判断差异(α=0.05)。
1.7 临床意义评估
根据TCGA 数据库中COPE 表达中位值分为高低两组,用R 对2 组T、N、M 分期及性别、种族、吸烟史、新肿瘤类型进行分析,ggplot2 绘图,χ2检验组间差异(α=0.05)。在Kaplan-Meier Plotter 平台选择“auto-cut-off”和单因素分析方法对肺腺癌和肺鳞癌患者的生存信息进行cox 分析,绘制生存曲线(α=0.05)。
1.8 机制探索
收集TCGA 数据库中细胞增殖、凋亡、DNA 损伤修复、DNA 复制通路和肿瘤炎症通路中的基因表达信息及COPE表达信息,用GSVA包进行统计分析,选择参数“method=‘ssgsea’”,Spearman法分析相关性(α=0.05)。
2 结果
2.1 COPE 与SIA-IgG 结合,并在受到射线照射后升高
SIA-IgG 免疫沉淀联合液相质谱分析实验发现,照射后2h、6h、12h、24h、36h、72h 不同时间点免疫沉淀样本中均检出COPE(表1,表2),照射后COPE 含量上升,12h/24h 达峰后回落,照射后COPE 与SIA-IgG 的结合量呈时间依赖性变化(图2A,2B)。
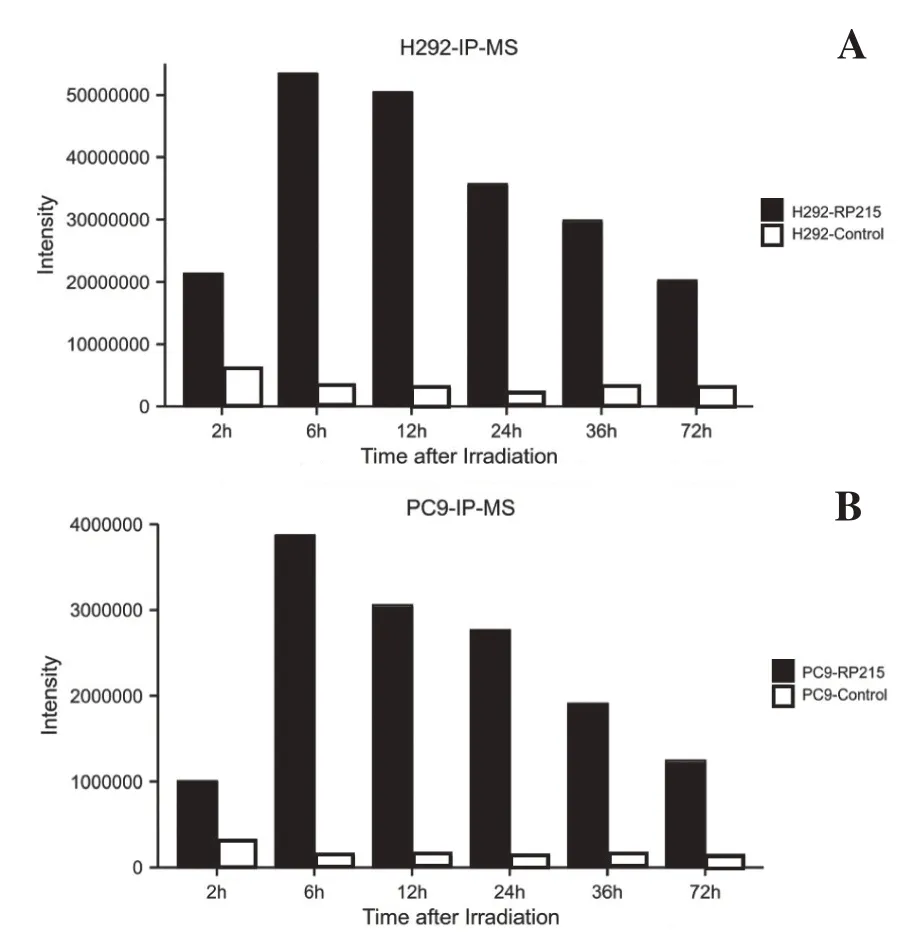
图2 SIA-IgG免疫沉淀联合液相质谱分析结果
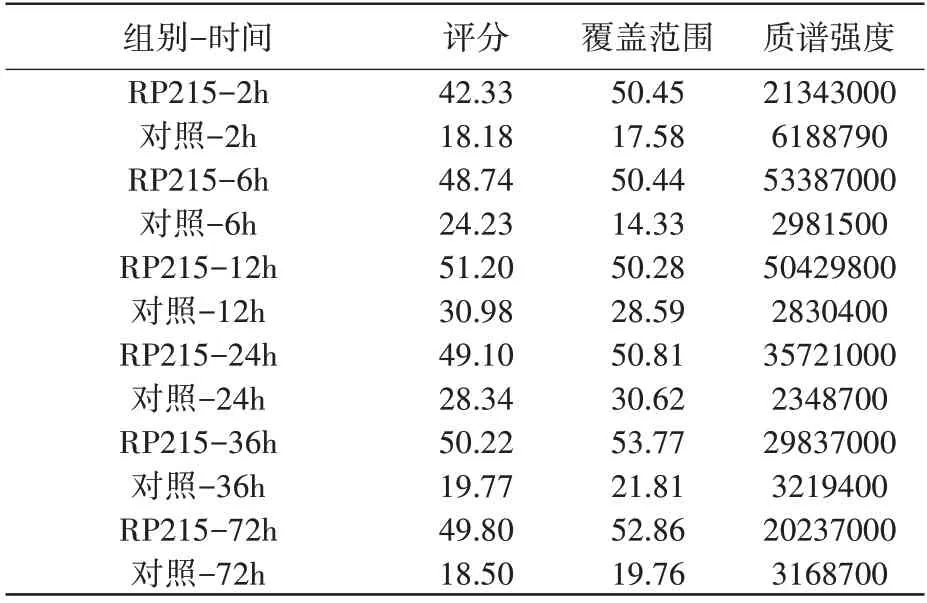
表1 H292细胞照射后不同时间点免疫沉淀样本COPE分析结果
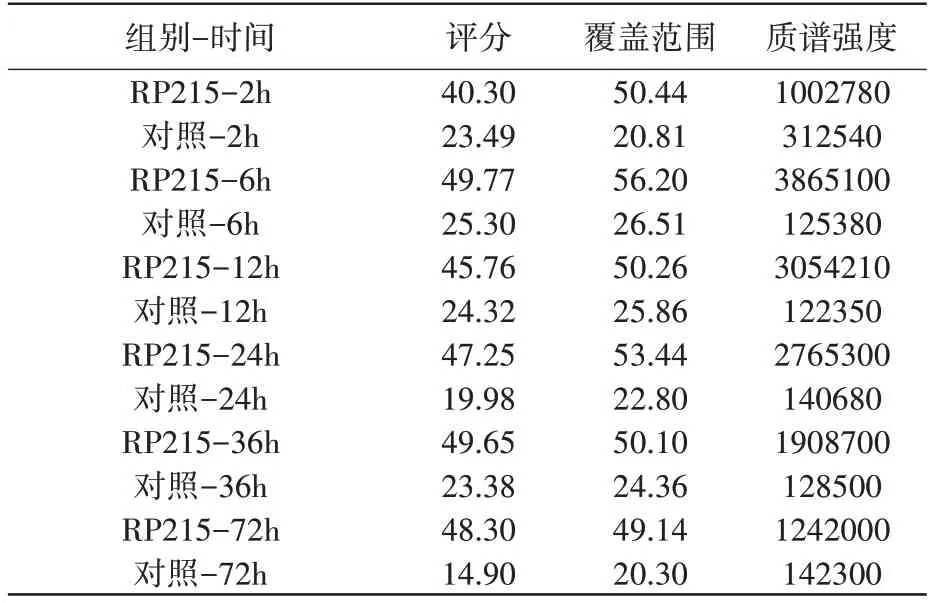
表2 PC9细胞照射后不同时间点免疫沉淀样本COPE分析结果
2.2 COPE在NSCLC中的表达情况
COPE 的表达在包括肺腺癌和肺鳞癌在内的大多数肿瘤组织中均上调,仅在少数肿瘤中下调(图3A、3B,见封二),3 个相互独立的GEO 数据集中COPE 在肿瘤组织中的表达均上调且与SIAIgG 的表达正相关(图3C~3E,见封二)。正常肺组织与NSCLC 组织COPE 免疫组化结果也显示NSCLC 组织中COPE 表达升高(图3F、3G,见封二)。
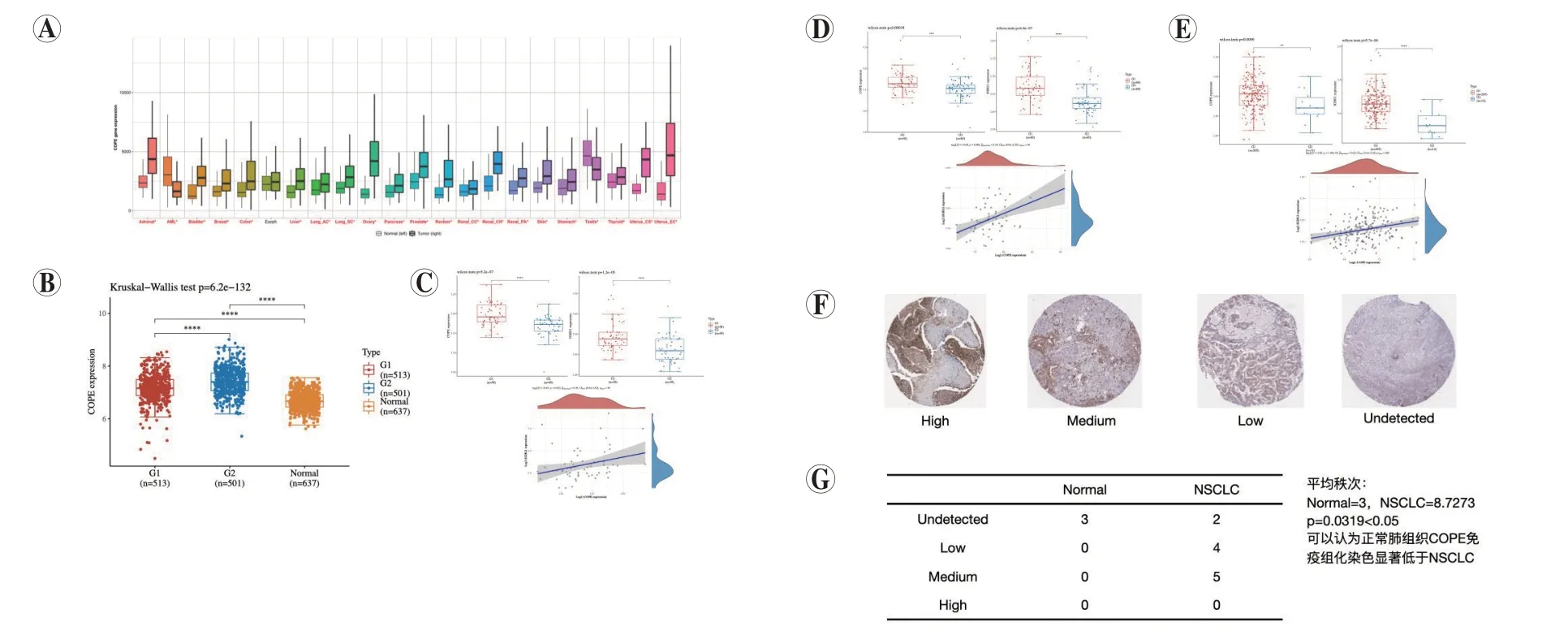
图3 NSCLC中COPE的表达情况分析
2.3 COPE与NSCLC患者临床特征及预后的关系
高表达COPE 的肺鳞癌患者与低表达COPE的患者相比,T1 期与N1 期患者比例显著降低(图4A、4B)。在M 分期(图4C)、临床分期(图4D)、性别(图4G)、种族(图4H)、新发肿瘤类型性别(图4E)及是否吸烟(图4F)方面暂不能认为2 组构成有显著差异。尽管如此,高表达COPE 的肺腺癌和肺鳞癌患者预后相较于低表达组均显著下降(图4I)。
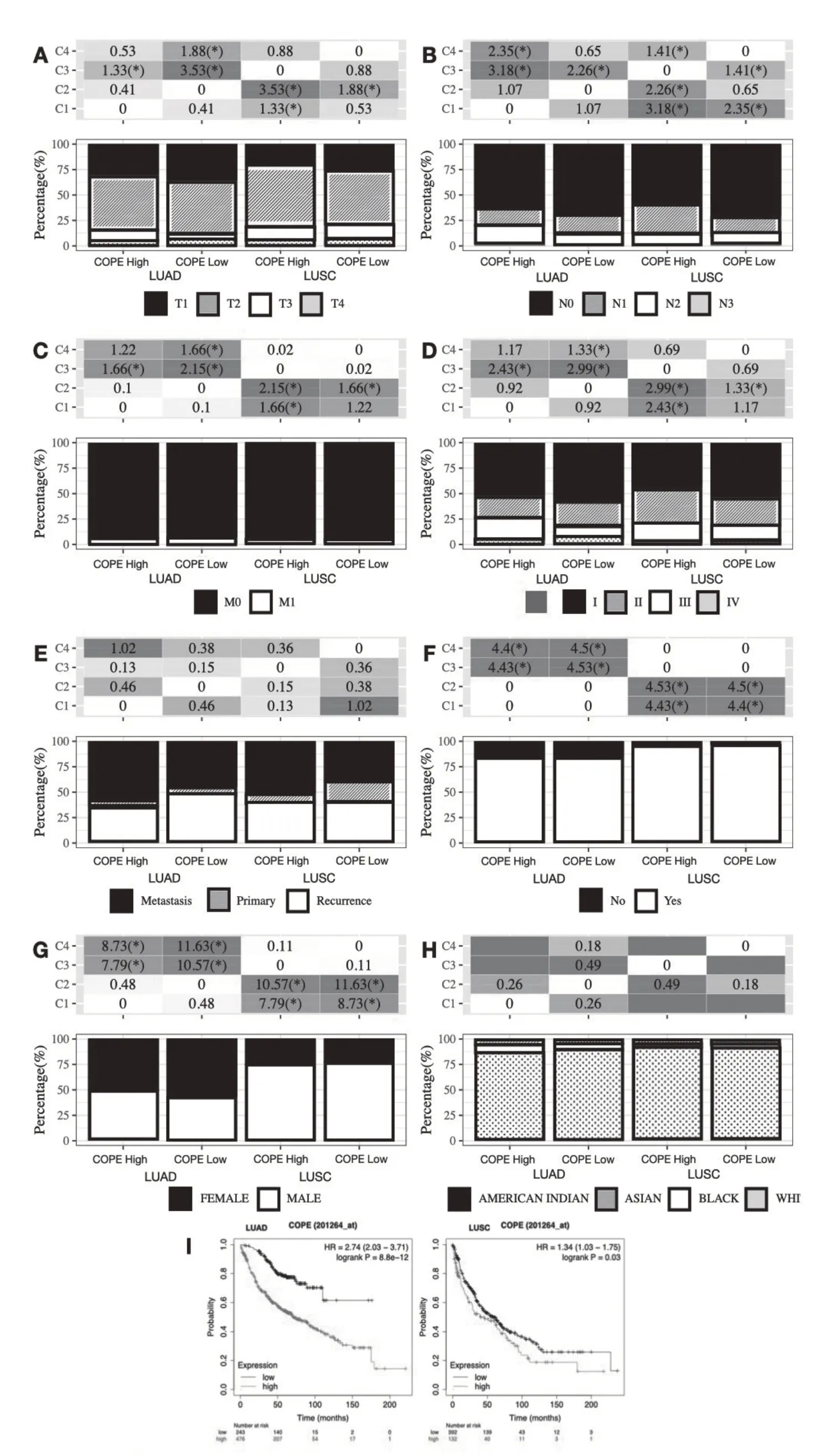
图4 NSCLC中COPE的表达情况与临床特征及预后关系的分析
2.4 COPE与NSCLC中部分已知信号通路相关蛋白印迹的关系
对TCGA 数据库中肺腺癌和肺鳞癌COPE 表达情况与多种已知的信号通路蛋白印迹进行相关性分析,发现COPE 的表达量与已知具有促肿瘤效应的肿瘤增殖通路相关蛋白、DNA 复制相关蛋白、DNA 损伤修复相关蛋白和MYC基因通路相关蛋白印迹均显著正相关(图5A~5D),同时与已知具有抗肿瘤效应的细胞凋亡通路相关蛋白印迹和肿瘤组织炎症反应相关蛋白印迹显著负相关(图5E、F)。
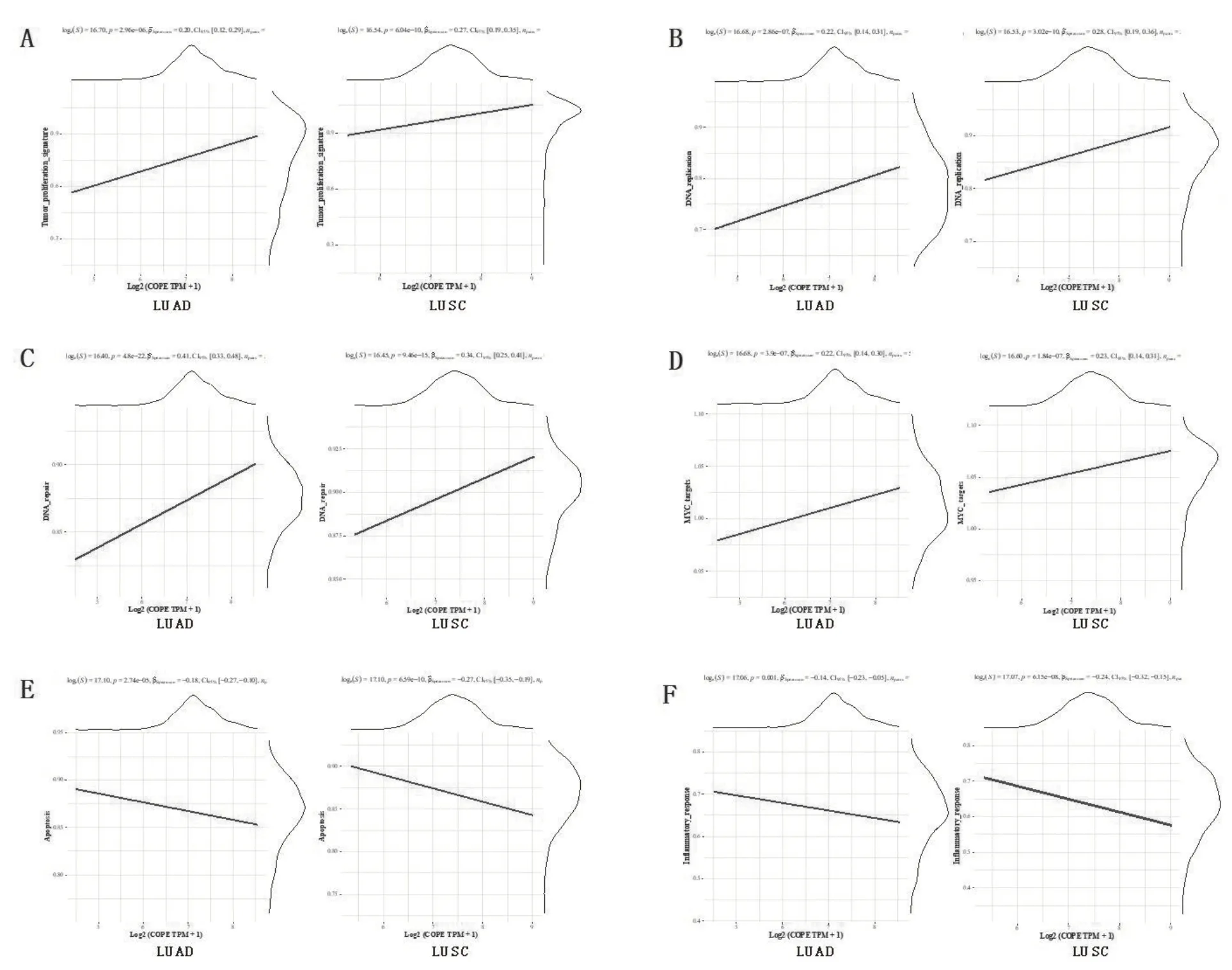
图5 NSCLC中COPE与多种已知通路相关性Spearman检验图
3 讨论
肺癌是目前人类健康的主要威胁[1,2]。随着各种治疗手段的发展,早期NSCLC 患者预后显著改善,放疗疗效已经与手术治疗无显著差别[9]。但肿瘤放射抵抗及复发仍存在,单纯提升剂量无法真正改善预后,放疗增敏才是未来方向。上世纪末,邱教授团队发现SIA-IgG 在多种肿瘤组织均存在并促进肿瘤发生发展[10],其表达与多种肿瘤标志物相关[11],可能成为预后指标[12],其机制与ROS 通路、FAK 通路、SOX2 等有关[13,14],并参与肿瘤细胞干性维持[15]。肿瘤微环境中SIA-IgG 可抑制T 细胞浸润[16]。我组前期工作发现,SIA-IgG 是ⅢA 期LUAD 患者术后放疗的独立预后因素并促进放射抵抗。
在对SIA-IgG 互作蛋白进行探索时,我们发现COPE 与SIA-IgG 结合,且结合量在照射后呈时间依赖性改变。现有文献对COPE 与NSCLC 的关系研究鲜有报道,本研究首次发现COPE 与SIAIgG 结合且在受照射后结合增多。对COPE 在NSCLC 中作用及潜在机制的系统性探索发现了COPE 在NSCLC 分期和不良预后方面的价值,推测了COPE 促进肿瘤发生发展和放射抵抗的机制,为今后的深入研究提供了明确的思路和方向。
我们先通过细胞照射、免疫沉淀联合液相质谱分析技术,发现了COPE 与SIA-IgG 的结合且COPE 的量在照射后上升。细胞在受到照射后往往会启动多种促生存机制以实现最终的细胞存活[17],而COPE 在此时升高提示COPE 可能发挥促肿瘤效应,COPE 与SIA-IgG 的结合及同步升高更支持了COPE 促肿瘤效应的猜想。依托数据库的大量NSCLC 样本进行的生物信息学分析发现,NSCLC 中COPE 高表达并与SIA-IgG 的表达正相关,与更高的T、N分期和不良预后相关,这支持了COPE 促肿瘤效应的猜想,同时揭示了COPE 对NSCLC预后预测的价值。
本研究中对COPE 与一些已知信号通路的相关性研究发现,COPE 与肿瘤增殖通路、DNA 复制、DNA 损伤修复和MYC通路相关基因的表达正相关,与细胞凋亡通路和肿瘤炎症反应相关基因的表达负相关。这提示COPE 的促肿瘤效应可能通过促进肿瘤细胞的增殖和DNA 的损伤修复实现,鉴于与之结合的SIG-IgG 有促肿瘤效应和促放疗抵抗效应,二者可能协同促进DNA 的损伤修复和放射抵抗,削弱放疗效果。COPE 的抗炎及抗凋亡效应也可促进肿瘤的生存和免疫逃逸。
本研究通过免疫沉淀联合液相质谱分析技术发现COPE 与SIA-IgG 结合,这一方法虽然具有可信度,但在后续研究中仍可考虑进行western blotting 实验和免疫荧光共定位加强论证。对COPE的探索主要依托数据库和生物信息学,可信度较好,但属描述性研究,尚缺乏干预实验的支持,后续研究中可考虑补充。总结来说,本研究发现了COPE 与SIA-IgG 的结合并在射线照射后增多,分析明确了COPE 在NSCLC 中的表达情况和临床价值,初步探索了COPE 促肿瘤效应的潜在机制,为后续基础实验验证提供了思路与支持,填补了COPE与NSCLC关系这一空白,为COPE在肿瘤检测和治疗方面的应用提供了依据与方向。
