胆管刷检细胞学及K-Ras基因突变检测在恶性胆管梗阻早期定性诊断中的价值
2022-12-12许颖颖王倩倩秦耿房龙
许颖颖,王倩倩,秦耿,房龙*
(1.中日友好医院 消化内科,北京 100029;2.北京大学医学部 中日友好临床医学院,北京 100029)
胆管梗阻是消化内科常见的疾病,恶性梗阻根治性手术切除率低,预后差,因此,尽早对胆管梗阻良恶性鉴别诊断至关重要,尤其对于有根治机会的早期恶性梗阻患者,而对于良性梗阻患者,也可以避免不必要的手术或药物干预[1]。然而,血液生化检查、无创性腹部影像学检查往往无法做出准确诊断,易导致漏诊或误诊,延误最佳治疗时机,最终的确诊仍有赖于病理学证据。目前,内镜下逆行性胰胆管造影(endoscopic retrograde cholangiopancreatography,ERCP)胆管刷检仍是获取病理学证据的主要手段,贴近病变刷检获取病理的同时,又可以避免胆管活检造成胆道出血、穿孔等风险[2]。而当细胞学诊断依据不充分时,随着分子生物学技术的发展,胆管刷检细胞学与KRas 基因突变联合检测是否可提高对恶性胆管梗阻的诊断效果,尚需要临床进一步验证。本研究对胆管梗阻患者进行胆管刷检、K-Ras 基因突变检测,对两种诊断方法单独及联合检测诊断恶性胆管梗阻的灵敏度、特异度、准确率进行评价和比较,评估胆管刷检细胞学、K-Ras 基因突变检测在恶性胆管梗阻早期定性诊断中的价值。
1 资料与方法
1.1 研究对象
以2021 年1 月—12 月因胆管梗阻在中日友好医院消化科住院治疗的患者为研究对象。入选标准:(1)年龄及性别不限;(2)腹部B 超、CT 或核磁证实肝内外胆管梗阻;(3)进行ERCP 手术的患者。排除标准:(1)全身一般情况差,不能耐受胃镜检查及ERCP 胆管刷检;(2)凝血功能障碍,无法耐受有创性操作;(3)除肝胆胰外的其他脏器恶性肿瘤伴肝脏转移导致肝内外胆管受累;(4)任何原因导致的食管胃底静脉重度曲张者。
良恶性胆管梗阻诊断标准:病理学未见明确恶性肿瘤证据,包括胆管活检病理、追加手术后病理、胆管刷检、胆汁细胞学等,或临床随访半年以上仍未发现恶性征象且患者生存良好者,最终诊断为良性胆管梗阻;病理学证实存在恶性肿瘤,或临床随访证实为恶性病程者,最终诊断为恶性胆管梗阻。
1.2 研究方法
1.2.1 胆管刷检:患者俯卧或侧卧于手术床,全身静脉麻醉后,常规ERCP 操作,首先采用电子十二指肠镜(日本Olympus TgF)进镜至十二指肠降段乳头开头处,插入黄斑马导丝,体外X线透视确认导丝进入到胆管内,随后碘伏醇造影明确胆管梗阻部位,沿导丝插入细胞刷(美国Boston Scientific RX Cytology Brush),在胆管梗阻部位刷检2次,每次在胆管梗阻部位往复移动大约10 次,刷检细胞全部置入液基细胞瓶(中国厦门麦克奥迪医疗诊断系统有限公司Non-GYN 型),半小时内送至病理科,1 份进行细胞学检测,1 份进行KRas基因突变检测。
细胞学阳性判断标准[3]为:(1)细胞大小不等,排列紊乱;(2)细胞核增大,核外形不规则,染色质增粗,核深染;(3)核浆比例(核质比)增大。中日友好医院病理科将细胞学诊断划分为:癌细胞、高度可疑癌细胞、可疑癌细胞、核异质细胞、未见癌细胞。癌细胞、高度可疑癌细胞、可疑癌细胞或核异质细胞提示病理学存在恶性肿瘤证据。
1.2.2 K-Ras 基因突变检测:留取1 份胆管刷检细胞液,进行K-Ras 基因第2、3、4 外显子突变检测,结果分为突变型及野生型,存在K-Ras基因突变者提示恶性胆管梗阻。
1.2.3 胆管刷检联合K-Ras 基因突变检测:采用胆管刷检联合K-Ras 基因突变进行诊断时,其中任何一种方法阳性,即可诊断为恶性胆管梗阻。
1.3 统计学方法
应用SPSS24.0 进行统计学分析。以病理学及临床随访结局作为金标准,比较胆管刷检、KRas 基因突变及胆管刷检联合K-Ras 基因突变对恶性胆管梗阻定性诊断的灵敏度、特异度、准确率等指标。率的比较采用χ2检验进行统计分析。
2 结果
2.1 患者纳入及最终诊断
2021 年1 月—12 月,本研究共纳入93 例胆管梗阻患者,其中2 例患者退出,要求转外院治疗或返家,1例胃癌伴肝脏转移,1例食管胃底静脉重度曲张。结合病理学及半年的临床随访,确诊良性胆管梗阻32 例,恶性胆管梗阻57 例,其中有原发性胆管恶性肿瘤46例,胰腺恶性肿瘤11例(图1)。
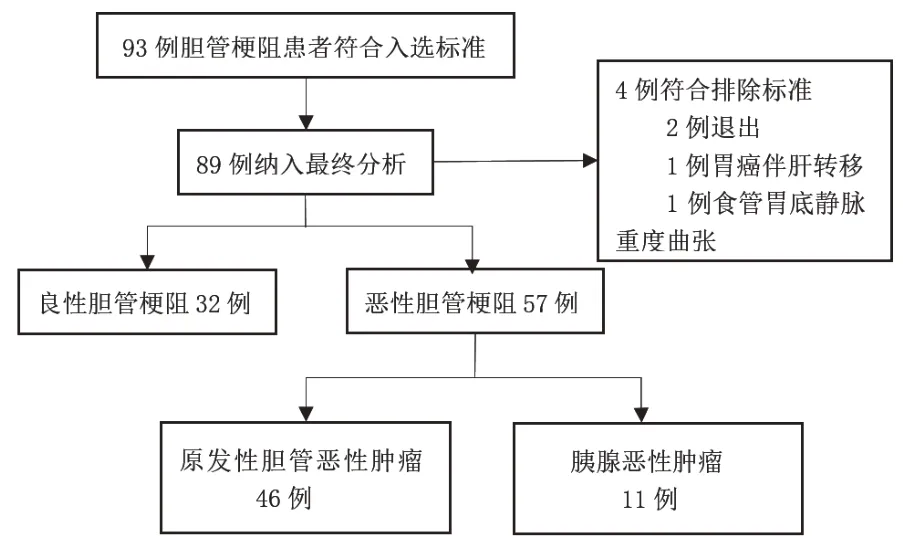
图1 患者纳排流程图
2.2 胆管刷检及K-Ras基因突变的诊断价值
2.2.1 胆管刷检诊断结果
表1 示细胞学阳性率,恶性胆管梗阻患者为52.6%(30/57),良性胆管梗阻患者为3.1%(1/32)。胆管刷检细胞学诊断恶性胆管梗阻的灵敏度为52.6%(30/57),特异度为96.9%(31/32)。
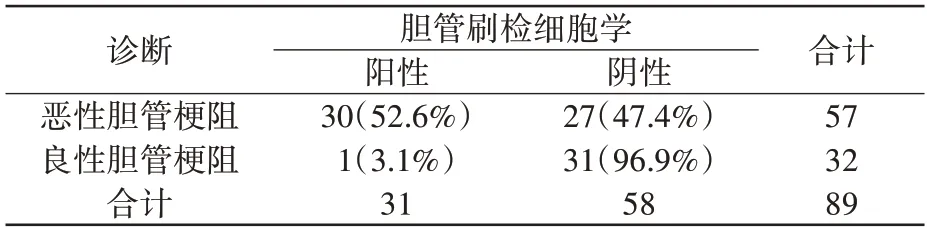
表1 胆管刷检对胆管梗阻的定性诊断
2.2.2 K-Ras基因突变诊断结果
表2 示K-Ras 基因突变率,恶性胆管梗阻患者为60.8%(31/51),良性胆管梗阻患者0(0/32)。K-Ras 基因突变对恶性胆管梗阻定性诊断的灵敏度为60.8%(31/51),特异度为100%(32/32)。
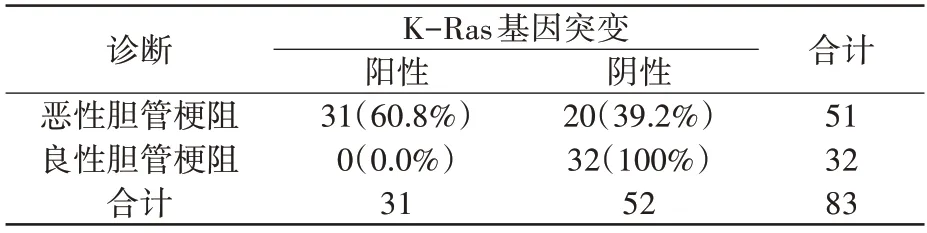
表2 K-Ras基因突变对胆管梗阻的定性诊断
2.2.3 胆管刷检与K-Ras基因突变诊断结果的交叉对比
表3 示,在57 例恶性胆管梗阻中,30 例胆管刷检细胞学呈阳性,其中15 例可见明确癌细胞,4例高度可疑/可疑癌细胞,11 例可见核异质细胞,K-Ras 基因突变率相应为86.7%(13/15)、75.0%(3/4)、72.7%(8/11)。在15 例可见明确癌细胞的患者中,K-Ras 基因突变率也未能达到100%,仍有2例患者K-Ras 基因为野生型。27例细胞学阴性患者中,7 例发生K-Ras 基因突变,表明在恶性胆管梗阻中,胆管刷检细胞学阴性而K-Ras 基因发生突变者达25.9%(7/27)。因此,需将胆管刷检细胞与K-Ras基因突变进行联合检测。
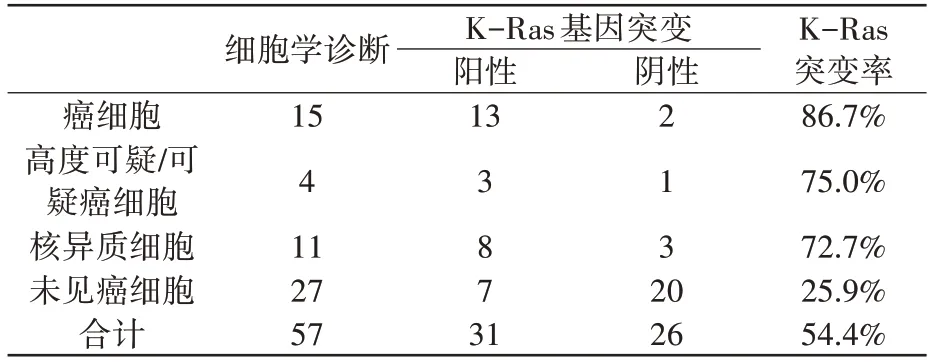
表3 胆管刷检与K-Ras基因突变诊断结果的交叉对比
2.2.4 联合检测诊断结果
表4 示,胆管刷检联合K-Ras 基因突变诊断恶性胆管梗阻的灵敏度为72.5%(37/51),特异度为96.9%(31/32)。
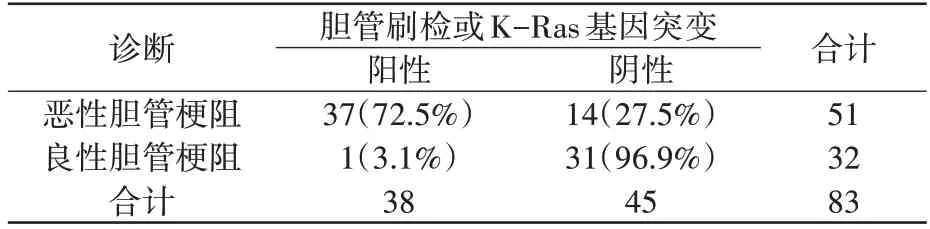
表4 胆管刷检联合K-Ras基因突变检测对胆管梗阻的定性诊断
2.2.5 3种检测方法的诊断结果比较
表5 示,胆管刷检联合K-Ras 基因突变检测可提高对恶性胆管梗阻诊断的灵敏度,增加诊断的准确率,与胆管刷检细胞学检测比较,差异均有统计学意义(P<0.05),同时降低误诊率。
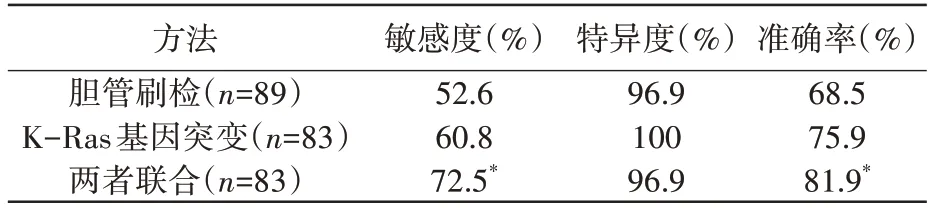
表5 3种定性诊断方法的比较
3 讨论
为评估胆管刷检、K-Ras 基因突变及两者联合检测这3 种检测方法对恶性胆管梗阻定性诊断的价值,本研究最终纳入89 例胆管梗阻患者,其中57例恶性胆管梗阻,32例良性胆管梗阻。胆管刷检诊断恶性胆管梗阻的灵敏度、特异度、准确率分别为52.6%、96.9%、68.5%,K-Ras 基因突变的诊断结果为60.8%、100%、75.9%,胆管刷检与KRas 基因突变联合检测的灵敏度可提高至72.5%(37/51),准确率可提高至81.9%(68/83),与胆管刷检细胞学检测比较,差异均有统计学意义(P<0.05),可推荐作为恶性胆管梗阻定性诊断的常规检测手段。
3.1 恶性胆管梗阻早期定性诊断的临床意义
胆管癌是继肝细胞癌之后第二大常见的肝脏恶性肿瘤[4]。在解剖学上,胆管癌可划分为肝内、肝门区和肝外胆管癌,其中以肝内胆管癌最为常见。肝炎病毒感染、炎症、吸烟饮酒、肥胖、糖尿病等均认为是胆管癌的危险因素[5]。最新的全球癌症流行病学调查数据显示,在过去的几十年中,胆管癌的发病率和死亡率在全球范围内呈逐步上升趋势[6]。手术切除是唯一的根治方法,然而,胆管癌恶性程度高,很少能在早期确诊,大多数患者确诊时已发展至不能手术切除的晚期阶段,即使存在手术机会,在完全手术切除后,也存在术后短期内复发及远处转移的风险,预后极差,据文献报道,确诊后患者生存期<12 个月,5 年生存率仅为5%~15%[4,7]。因此,对于可能治愈的早期胆管癌,早期准确诊断至关重要。
3.2 胆管刷检细胞学对恶性胆管梗阻的定性诊断价值及影响因素
早期鉴别良性和恶性胆管梗阻是非常困难的,尽管在过去的数十年里已经发展了多探测器计算机断层扫描、核磁共振胰胆管造影及超声内镜等检查,但单纯影像学检查对恶性胆管梗阻的诊断效果仍然有限。随着内镜技术的发展,ERCP被广泛用于获取不明性质胆管梗阻的病理学证据,包括胆管活检、胆管刷检等,理论上,胆管活检可以获取更大的组织样本并做出更准确的病理学诊断,但由于技术难度大,胆道出血、穿孔手术风险高,手术操作时间长,在很大程度上限制了胆管活检在临床中的广泛应用[8]。因此,ERCP 胆管刷检仍然是目前胆管癌的主要诊断方法,因为它在技术上易于实施,手术时间短,并发症发生率低,但其灵敏度和特异度比较有限,还存在很大的改进空间[2,9]。比如最近一项研究表明,在55例已明确诊断为恶性胆管梗阻患者中,单纯胆管刷检细胞学的灵敏度仅为47.1%[9]。与之相似,日本学者进行的一项研究表明,胆管刷检对恶性胆管梗阻定性诊断的灵敏度、特异度、准确率分别为36.1%、100%、50.0%。而在本研究中,胆管刷检的灵敏度为52.6%,灵敏度为中等水平,与既往研究结果不完全一致,但符合文献研究中的灵敏度波动范围。
细胞学诊断的灵敏度会受到诸多因素影响,可能的因素包括:刷检细胞量[1]、重复刷检频率、内镜医师的技术、细胞学病理医师的经验、总胆红素水平、患者年龄、肿块>1cm[10]、梗阻长度>1cm[11],上述因素均可能影响胆管刷检细胞学的阳性率。细胞量获取不足被认为是细胞学灵敏度低下的主要原因,提示在临床实践中,应在胆管梗阻部位重复多次刷检,以尽可能提高胆管刷检细胞学的阳性率[1]。既往一项研究的单因素联合多因素逻辑回归分析发现,年龄增长、总胆红素水平升高及肿块大小是细胞学阳性的独立预测因素[10]。而另一项研究的多元逻辑回归分析表明,总胆红素水平>4mg/dl 是胆管刷检细胞学阳性的独立预测因素,这表明总胆红素水平可能影响胆管刷检细胞学的诊断效果[8,10]。据文献报道,受上述多因素的影响,胆管刷检细胞学灵敏度波动于20%~50%,单纯细胞学检测无法满足临床实际需求,需联合其他诊断方法进一步提高诊断的灵敏度。
3.3 K-Ras 基因突变对恶性胆管梗阻的定性诊断价值
随着分子生物学技术的快速发展,对胆管癌生物学行为、潜在发生发展机制、靶向治疗药物及预后标志物的探索均已进入分子时代。例如Morita 等[4]指出经过数十年对胆管癌基因组的探索,基于基因组学特征,已成功开发出针对胆管癌的临床分子靶向药物,如成纤维细胞生长因子受体抑制剂(fibroblast growth factor receptor,FGFR)和异柠檬酸脱氢酶抑制剂(isocitrate dehydrogenase,IDH)。再如Kinjo 等[7]通过对胆管癌患者进行预后生存分析,发现SUOX 和GLUT1 可作为胆管癌的新型预后生物标志物。然而,总体预后差,药物治疗效果欠满意,促使研究者们重新聚焦于胆管癌的早期诊断。有研究发现,与胆管癌相关的几种潜在驱动突变包括K-Ras、p53、IDH1 和PTEN 等[10],其中又以K-Ras 和p53 研究较为广泛[12]。K-Ras 为RAS 基因家族的一名重要成员,含有4个编码外显子和1个非编码外显子,共同编码KRAS 蛋白,又称为p21 蛋白,在调节肿瘤微环境,以及细胞增殖、侵袭迁移等细胞生物学过程中发挥重要作用[13]。研究表明,K-Ras 基因的功能增益突变为胆管癌中最常见的变化之一,活化的K-Ras 基因突变导致Ras/Raf/MEK/ERK 通路发生级联反应和过度活化,肿瘤细胞过度增殖而凋亡减少,从而导致胆管癌的发生发展[14,15]。鉴于KRas 基因突变在胆管癌发生发展中的核心地位,国内曾有研究评估了K-Ras基因突变对胆管癌定性的诊断价值,结果显示在胆管癌患者中,K-Ras基因突变率为30.0%~43.75%,定性诊断胆管癌的灵敏度、特异度、准确率分别为38.46%、100%、61.9%[1]。而另一项研究的研究结论与之相反,胆管癌患者的K-Ras 基因突变率高达77.19%[16],这与我们的研究结果较为接近。
综上,在恶性胆管梗阻的定性诊断中,单一的诊断方法各有优劣、很难得出最终诊断结论,将多种诊断方法结合起来可能更有助于做出准确的诊断。因此,胆管刷检细胞学与K-Ras 基因突变联合检测的诊断效果优于单一方法检测,联合检测有助于恶性胆管梗阻的早期定性诊断,建议广泛应用。当然,本研究的局限之处在于单中心、小样本,还需在前瞻性、多中心的大规模研究中进一步验证。
