初探酰胺质子加权联合mDixon-Quant 序列评估前列腺癌骨转移的价值
2022-12-12李茜玮陈丽华王楠宋清伟孙鹏王家正刘爱连
李茜玮,陈丽华,王楠,宋清伟,孙鹏,王家正,刘爱连,3
(1.大连医科大学附属第一医院放射科,辽宁 大连 116011;2.飞利浦医疗,北京 100016;3.大连市医学影像人工智能工程技术研究中心,辽宁 大连 116011)
前列腺癌(Prostate cancer,PCa)是我国老年男性好发的恶性肿瘤之一,并且随着老龄化趋势的发展,在我国的发病率逐年增加[1]。骨转移为中晚期PCa 常见的转移方式之一,相较于国外,我国老年PCa 患者发生骨转移的几率更高[2]。PCa 骨转移为一种全身性疾病,严重影响患者预后。骨扫描(Emission computed tomography,ECT)和正电子发射断层成像-X 线计算机体层成像(Positronemissiontomography-computed tomography,PET-CT)是检查PCa骨转移的主要方法[3],但由于成本高及核素限制了其在骨转移患者中的广泛应用。常规MRI 检查虽然对于早期骨髓腔内的病变具有一定的敏感性,但仍存在成像局限性[4]。因此,需要寻找一种无创且精准地评估PCa 骨转移的方法。
酰胺质子加权成像(Amide proton transferweighted,APTw)作为一种定量成像技术,能检测病变组织内蛋白质及多肽的含量,对疾病的鉴别诊断具有一定的价值[5]。MR 多回波Dixon 定量成像技术(mDixon-Quant)作为一种新型脂肪定量成像技术,通过定量参数脂肪分数(FF)值、表观弛豫率(R2*)值及横向弛豫时间(T2*)值,可以无创且快速地评估组织脂肪含量及顺磁性物质的含量[6-7]。目前尚无研究分析以上两种序列在评估PCa 骨转移中的价值。本研究旨在探究APTw 联合mDixon-Quant 序列评估PCa 骨转移的价值。
1 资料与方法
1.1 研究对象
该回顾性研究获得本院医学伦理委员会批准(批件号:PJ-KS-XJS-2021-20(X)),免患者知情同意。回顾性收集2019 年5 月—2022 年1 月于本院因临床怀疑PCa 行3.0T MRI 扫描的46 例患者的资料。入组标准:①经穿刺(29 例)、电切(3 例)及根治术(14 例)证实为PCa;②MRI 检查诊断为PCa 骨转移的患者于MRI 检查后15 d 内行ECT 检查进一步证实;③MRI 扫描序列完整,包括APTw 及mDixon-Quant 序列;④图像质量好,无伪影。排除标准:①除PCa 外伴有前列腺炎的患者;②检查前行手术、内分泌治疗及放化疗等。最后入组:PCa 骨转移19例,年龄61~85岁,平均(72.10±7.25)岁,非骨转移27例,年龄54~87岁,平均(70.70±7.96)岁。入组流程图见图1。
1.2 检查设备与方法
本研究采用飞利浦公司3.0T MR 扫描仪(Ingenia CX,Philips,Holland)进行前列腺扫描。患者禁食,扫描前嘱患者排尿。采取仰卧位,双侧髂前上棘连线与线圈中心线重合。采用32 通道腹部线圈,扫描序列包括T1WI、T2WI、DWI(b 值=0、1 200 s/mm2)、APTw 及mDixon-Quant。扫描方位包括冠状位、矢状位及轴位。扫描参数详见表1。

表1 扫描参数表
1.3 临床及病理资料
记录患者临床及病理资料,年龄、总前列腺特异性抗原(Total prostate specific antigen,tPSA)、神经侵犯及Gleason 评分见表2。

表2 PCa 骨转移与非骨转移临床一般资料分析
1.4 图像处理与测量
获得APTw 及mDixon-Quant 扫描原始图像后,将原始图像上传至ISP(IntelliSpacePortall,Philips Healthcare)工作站,经后处理生成APTw 及FF 图、R2*图。参考DWI 图像寻找病变结节显示最大的层面,并分别将DWI 与APTw 及FF 图、R2* 图融合生成相应的伪彩图。由两名观察者(前列腺MRI 读片经验分别为1 年及5 年)在未知患者病理的情况下,于融合后的伪彩图上结节显示最大层面放置感兴趣区(ROI)(面积约为40 mm2),进行病灶勾画并记录APTw 值、FF 值及R2*值,勾画病灶时应避开囊变区及坏死区(图2,3)。
1.5 统计学分析
获得的数据采用SPSS 23.0 及Medcala 15 软件进行统计学分析。采用Bland-Altman 图评估两名观察者之间APT 值及FF 值、R2* 值测量的一致性,若大部分散点均匀分布在+1.96 与-1.96 线内则代表一致性好。取一致性良好的参数值的平均值进行后续分析。采用Kolmogorov-Smirnov 检验数据的正态性,符合正态分布的数据,表示为均值±标准差();不符合正态分布的数据,表示为中位数(25百分位数,75 百分位数)。采用独立样本t 检验或Mann-Whitney U 检验比较两组间APT 值及FF 值、R2* 值的差异。采用Logistic 回归计算APTw 及mDixon-Quant 序列联合参数模型的预测值。采用受试者工作特征(Receiver operator characteristic,ROC)曲线评估有差异的参数单独或联合鉴别两组疾病的效能,并计算各参数鉴别两组疾病的曲线下面积(AUC)、敏感性、特异性及阈值。采用Delong 检验两两比较有差异参数单独或联合鉴别两组疾病的ROC 曲线。采用独立样本t 检验、Pearson’s 卡方检验及Fisher 确切概率法评估PCa 骨转移相关临床一般资料。
2 结果
2.1 临床一般资料
PCa 骨转移组及PCa 非骨转移组的临床病理资料见表2。研究结果发现:PCa 骨转移组与PCa 非骨转移组的tPSA 差异有统计学意义(P=0.020);余临床与病理资料两组间差异无统计学意义。
2.2 两名观察者各参数测量一致性评估
两名观察者APTw 值及FF 值、R2* 值测量的一致性好,表现为Bland-Altman 图中大部分散点均匀分布在+1.96 与-1.96 线内(图4)。
2.3 两组病例各序列参数值的比较
两组病例各序列参数值的比较结果见表3。骨转移组的APT 值及R2*值大于非骨转移组,差异具有统计学意义(P<0.05)。骨转移组与非骨转移组的FF 值间比较无统计学差异(P>0.05)。
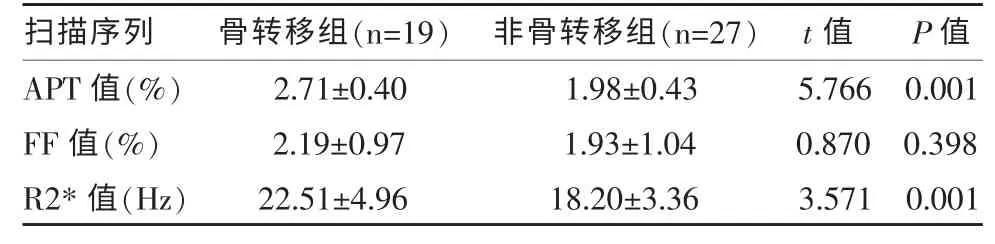
表3 两组病例各序列参数值的比较
2.4 两组病例APT 值、R2*值及APT-R2*值联合诊断效能评估
利用APT 值、R2* 值及APT-R2* 联合参数模型鉴别两组疾病的AUC 值分别为0.887、0.768 及0.902(表4,图5);其中两两比较APT 值、R2* 值及APT-R2* 联合参数模型的ROC 曲线,发现R2* 值与APT-R2*联合参数模型鉴别两组疾病的AUC 差异有统计学意义(P=0.0259),余APT 值与R2* 值、APT 值与APT-R2* 联合参数模型鉴别两组疾病的AUC 差异无统计学意义(P=0.125 7、0.528 6)。
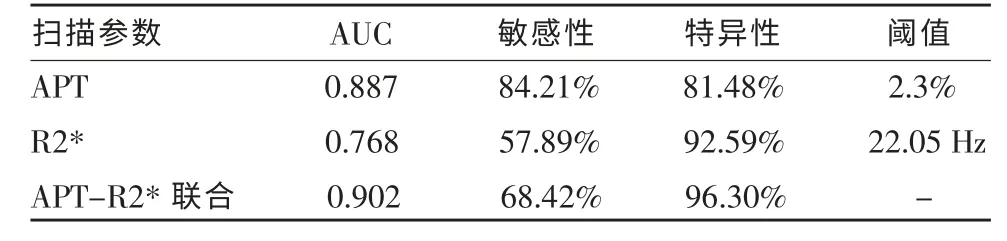
表4 APT、R2* 值及APT-R2* 联合参数模型诊断效能评估
2.5 APT 值与R2*值相关性分析
APT 值与R2* 值呈正相关(r=0.47,P<0.05),结果见图6。
3 讨论
中晚期PCa 易发生骨转移,癌细胞可通过Baston 脊椎静脉丛转移至骨盆及脊柱[8-9]。因此,早期PCa 患者多无明显临床症状,而随着病变的进展,多数患者可继发骨痛、病理性骨折及脊髓压迫等,最终导致神经功能减退、生活质量下降甚至缩短患者寿命[10]。MRI 是一项无创评估PCa 骨转移的检查技术,由于转移至骨髓中的肿瘤细胞使正常骨髓中的脂肪含量及水分子含量发生了变化,因此通过信号强度的改变诊断PCa 骨转移具有一定的敏感性。但Park等[11]研究发现骨髓良性红细胞增多症和骨髓多发肿瘤细胞的信号强度存在重叠,因此常规MRI 检查仍存在一定的局限性。近年来,随着多参数磁共振成像(Mult-parameter MRI,mp-MRI)的发展,定量参数成像在疾病的鉴别诊断方面具有很好的潜力,目前在直肠、子宫、前列腺等部位疾病的诊断中均有应用[12-14]。
APTw 基于游离水和蛋白质、多肽之间化学交换饱和转移效应的存在,其可以检测出肿瘤中丰富的酰胺质子成分[15],结果受蛋白浓度及酸碱度的影响。APTw 在脑缺血、脑肿瘤、乳腺癌和宫颈癌以及神经退行性疾病的评估中显示出了强大的性能[16-20]。目前,有学者已经证明APTw 能够为PCa 与前列腺增生的鉴别诊断提供帮助[21],但尚无研究将APTw用于评估PCa 骨转移。本研究中,两名观察者测量的APT 值及R2*值一致性良好,证明数据稳定,可用于评估PCa 骨转移;研究结果示PCa 骨转移组的APT 值大于非骨转移组,其原因可能为:PCa 骨转移组肿瘤的恶性程度增加,肿瘤增值速度增快,导致肿瘤细胞所含蛋白质及多肽的含量增加,化学交换饱和转移效应增强,进而使得PCa 骨转移组的APT 值大于非骨转移组。此外,Kulanthaivelu等[22]研究发现脑胶质瘤瘤周组织的APT 值较高,推测与瘤周血脑屏障破坏导致血管内蛋白渗漏到血管外空间有关。因此,我们推测肿瘤新生血管形成或血管内皮受损致血管通透性增大也可能是造成本研究中PCa 骨转移组APT 值大于非骨转移组的原因之一。最后肿瘤乏氧使得微环境PH 值减低,通过影响蛋白质的结构及酶促反应,进一步引起APT 值的变化。tPSA对于PCa 的诊断具有一定的价值,本研究中两组tPSA 有差异,与韩跃辅等[23]的研究结果一致,同时该研究表明,对于部分分化极差、恶性程度极高的PCa,其对tPSA 的表达程度低,致血清tPSA 水平较低,因此利用tPSA 鉴别PCa 是否发生骨转移仍面临挑战。
采用6 个回波、7 个脂肪峰模型的mDixon-Quant 成像技术在定量检测脂肪的研究中具有一定价值[23],能获得定量FF 值、R2* 值。近年来,也有研究应用该序列定量参数R2* 值鉴别Ⅰ期子宫内膜癌与子宫内膜息肉等,显示出很好的价值[7]。mDixon-Quant 成像技术中的定量参数R2* 值指一段时间脉冲回聚的横向弛豫速率,T2* 值指横向弛豫时间,两者关系为R2*=1/T2*。R2*值反映了组织的氧合水平,可以定量评估组织细胞顺磁性物质的含量,通过分析组织细胞微环境来评估不同疾病的病理生理状态[24]。本研究中,PCa 骨转移组的R2*值大于非骨转移组,其原因可能为:PCa 骨转移组肿瘤细胞增值速率更快,耗氧量增加致组织脱氧血红蛋白含量增加,作为一种顺磁性物质,脱氧血红蛋白加快了横向磁化矢量由同相位向矢相位的转变,进而横向弛豫时间缩短,T2* 值减小,R2* 值增大;此外,推测由于骨转移组较非骨转移组肿瘤新生血管数量增加,肿瘤出血及血液瘀滞可能同样使得顺磁性物质如脱氧血红蛋白及含铁血红素增加,破坏磁场均匀性,最终导致T2*值减小,R2*值增大。
本研究中,APT 值与R2* 值呈正相关,原因可能为:首先,随着APT 值的升高,即水分子与蛋白质、多肽的化学交换饱和转移效应增强,预示肿瘤增值的能力更强,此时肿瘤耗氧量的增加使肿瘤微环境中顺磁性物质含量增加,进而导致T2* 值减小,R2*值增大;其次,肿瘤乏氧可导致肿瘤微环境中PH值减低,而PH 值通过调节蛋白质的结构及酶的作用进而影响化学交换速率,最终致APT 值减低[25-26]。
总之,APT 值、R2* 值及APT-R2* 值均能很好地鉴别PCa 骨转移,且APT-R2* 值的鉴别效能显著提升。APTw 和mDixon-Quant 序列从分子及代谢水平为预估PCa 骨转移提供全新的成像技术。
本研究仍存在一定的局限性:①研究样本量较小,有待后续扩大样本量深入研究;②ROI 勾画仅限于肿瘤最大层面,未对肿瘤全域进行分析,不能全面反映肿瘤的异质性。
