质量守恒定律的应用
2022-12-11赵培龙
赵培龙
[考点速览]
考點1:确定未知物质的化学式
例1 (2022·黑龙江·齐齐哈尔)利用催化剂将工厂废气中的二氧化碳转化为燃料X,是实现“碳中和”的路径之一,该反应的化学方程式为CO2+ 3H2[催化剂]X + H2O,X的化学式为()。
A. C B. CH4 C. CH3OH D. CH2O
解析:根据质量守恒定律可知,化学反应前后原子的种类和数目不变,反应物中碳原子、氢原子、氧原子的个数分别为1、6、2,生成物中碳原子、氢原子、氧原子的个数分别为0、2、1,所以X中碳原子、氢原子、氧原子的个数分别为1、4、1。答案:C。
小结:确定未知化学式应根据化学反应前后原子的种类和数目不变进行分析。
考点2:化学反应微观示意图
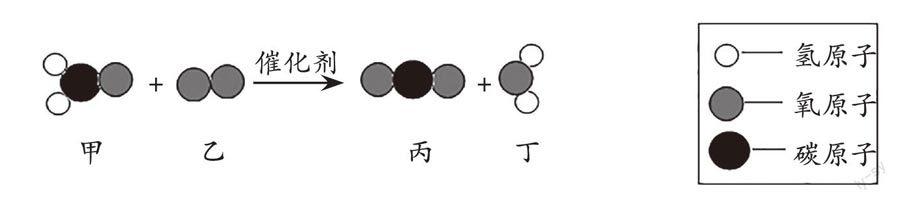
例2 (2022·山东·泰安)如下图为某反应的微观示意图,关于该反应的说法不正确的是()。
A. 该反应属于置换反应
B. 反应前后原子的种类和数目没有改变
C. 生成物丙和丁都属于氧化物
D. 反应前后催化剂的质量和化学性质不变
解析:由反应的微观示意图可得,该反应的化学方程式为CH2O + O2 [催化剂] CO2+ H2O。该反应的生成物是两种化合物,因此该反应不属于置换反应,A错误;由质量守恒定律可知,反应前后原子的种类和数目没有改变,B正确;氧化物是由两种元素组成且其中一种元素是氧元素的化合物,因此生成的二氧化碳和水均属于氧化物,C正确;化学反应前后,催化剂的质量和化学性质不变,D正确。答案:A。
小结:先根据微观示意图写出反应的化学方程式,再根据化学方程式判断反应物或生成物的分子个数、质量比,判断所属反应的基本反应类型,最后根据质量守恒定律——化学反应前后,元素的种类不变,原子的种类、数目不变,分子个数可能改变判断选项正误。
考点3:根据表格计算反应前后各物质质量
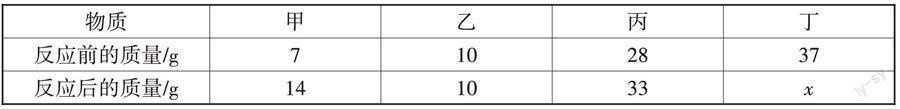
例3 (2022·湖南·邵阳)把一定质量的甲、乙、丙、丁四种物质放入密闭容器中,在一定条件下反应一段时间后,测得各物质的质量如下表所示,下列说法正确的是()。
A. x的值是25 B. 乙一定是催化剂
C. 甲和丁都是反应物 D. 反应中,甲与丙发生改变的质量比是14∶33
解析:分析表中数据可知,反应后甲的质量增加了14 g - 7 g = 7 g,故甲是生成物,生成的质量为7 g;同理可以确定乙的质量不变,则乙可能作该反应的催化剂,也可能没有参加反应;丙是生成物,生成的质量为33 g - 28 g = 5 g;由质量守恒定律可得,丁是反应物,参加反应的质量为7 g + 5 g = 12 g,故x的数值为37 - 12 = 25,由此可得,A正确,B、C错误。反应中,甲与丙发生改变的质量比是7 g∶5 g = 7∶5,D错误。答案:A。
小结:先根据反应前后各物质的质量总和不变,计算未知物的质量。再根据各物质反应前后质量的变化情况确定该物质属于反应物、生成物还是催化剂等:反应后质量减小→反应物;反应后质量增大→生成物;反应后质量不变→催化剂或不参与反应的杂质。
[应用提升]
1. (2022·江苏·扬州)北京冬奥会火种灯使用化合物X作燃料,其燃烧反应方程式为X + 5O2[点燃]3CO2 + 4H2O。推断X的化学式是()。
A. C3H8 B. C3H6 C. C2H6O2 D. C3H8O3
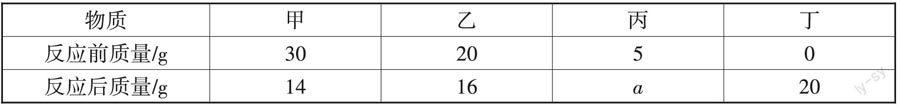
2. (2022·云南·昆明)将下列四种物质放入密闭容器中充分反应,测得反应前后各物质的质量如下表,下列说法错误的是()。
A. a = 5 B. 甲和乙为反应物
C. 丙可能是催化剂 D. 甲、乙、丁的相对分子质量之比为2∶1∶2
答案:1. A 2. D
