产褐藻胶裂解酶弧菌HB161653的产酶条件优化
2022-12-11葛东振鲍时翔武慧宇黄惠琴
葛东振,鲍时翔,高 荣,武慧宇,朱 军,黄惠琴*
(1.河北农业大学 海洋学院,河北 秦皇岛 066000;2.中国热带农业科学院 热带生物技术研究所,海南 海口 571101)
褐藻胶是褐藻重要的结构成分,作为细胞壁及细胞间质的填充物质,占褐藻干质量的40%左右[1-3]。褐藻胶寡糖是褐藻胶降解后形成的聚合度在2~20的低分子物质,在医药、食品、日化、饲料和农业方面有广泛的应用[4-6]。
降解褐藻胶的方法主要有物理法、化学法和酶解法。酶解法具有底物专一、反应条件温和等优点,可以定向制备褐藻胶寡糖,相较于物理、化学法是一种理想且环保的方法[7-9]。褐藻胶裂解酶通过β消除机制断裂褐藻胶分子间的1,4-糖苷键催化褐藻胶降解,并在非还原端形成不饱和双键,该双键在波长235 nm处具有强烈吸收峰[10-12]。褐藻胶裂解酶不仅可以降解褐藻胶、定向制备褐藻胶寡糖,而且可以制备海藻原生质体、发酵生产乙醇、降解生物膜等,可应用于食品、农业、制药及能源等方面[13-15]。海洋细菌是获取褐藻胶裂解酶的重要途径,如假单胞菌(Pseudomonassp.)QD03[16]、固氮菌(Azotobacter vinelandii)[17]、黄杆菌(Flavobacteriumsp.)LXA[18]、交替假单胞菌(Pseudoalteromonassp.)CY24[19]、鞘氨醇单胞菌(Sphingomonassp.)A1[20]、弧菌(Vibriosp.)QY102等。本课题组从海南省琼海市海域采集到的腐烂马尾藻中分离出菌株HB161653,经分子鉴定可能为弧菌属(Vibriosp.)新的分类单元,且具有较好的产褐藻胶裂解酶活性。本研究对该菌产褐藻胶裂解酶的培养基及发酵条件进行优化,以期为褐藻胶裂解酶的规模化生产奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
弧菌(Vibriosp.HB161653):由本实验室保存。
1.1.2 培养基
活化培养基(2216E琼脂培养基)、种子培养基(2216E液体培养基):青岛海博生物科技有限公司。
初始发酵培养基[21]:海藻酸钠5 g/L,蛋白胨5 g/L,NaCl 20 g/L,K2HPO41 g/L,MgSO40.5 g/L,pH值为7.0±0.2。
1.1.3 试剂
可溶性淀粉、蔗糖、葡萄糖(均为分析纯)、蛋白胨、酵母粉(均为生化试剂):生工生物工程(上海)股份有限公司;海藻酸钠(分析纯):天津大茂化学试剂厂;尿素、硫酸铵、NaCl、K2HPO4、MgSO4(均分析纯):西陇科学股份有限公司。
1.2 仪器与设备
DK-8AD型电热恒温水槽、GHP-9080型隔水式恒温培养箱:上海一恒科技有限公司;UV-1600型可见分光光度计:上海美普达仪器有限公司;SW-CJ-1FD型超净工作台:苏州安泰空气技术有限公司。
1.3 方法
1.3.1 种子液制备
将保存的弧菌HB161653划线于活化培养基,28 ℃条件下静置培养24 h。从活化平板上挑取单菌落接种于50 mL种子培养基,28℃、180r/min条件下振荡培养24h,制得种子液。
1.3.2 产褐藻胶裂解酶培养基优化
固定初始发酵条件为接种量1.0%、装液量50mL/250mL,28 ℃、180 r/min振荡培养14 h,10 000 r/min、4 ℃离心10 min收集上清液。以褐藻胶裂解酶活力为考察指标,分别考察碳源(添加量均为5 g/L可溶性淀粉、蔗糖、葡萄糖、海藻酸钠)、最佳碳源添加量(2.5 g/L、5.0 g/L、7.5 g/L、10.0 g/L、12.5 g/L),氮源(添加量均为5 g/L蛋白胨、酵母粉、尿素、硫酸铵)、最佳氮源添加量(2.5 g/L、5.0 g/L、7.5 g/L、10.0 g/L、12.5 g/L),NaCl添加量(10 g/L、15 g/L、20 g/L、25 g/L、30 g/L)、K2HPO4添加量(0.05 g/L、0.10 g/L、0.15 g/L、0.20 g/L、0.25 g/L)和MgSO4添加量(0.10 g/L、0.15 g/L、0.20 g/L、0.25g/L、0.30 g/L)对弧菌HB161653产酶的影响。
在单因素试验的基础上,进一步以海藻酸钠(A)、蛋白胨(B)、NaCl(C)、K2HPO4(D)和MgSO4(E)添加量为考察因素,设计L27(35)正交试验,正交试验因素与水平如表1所示。
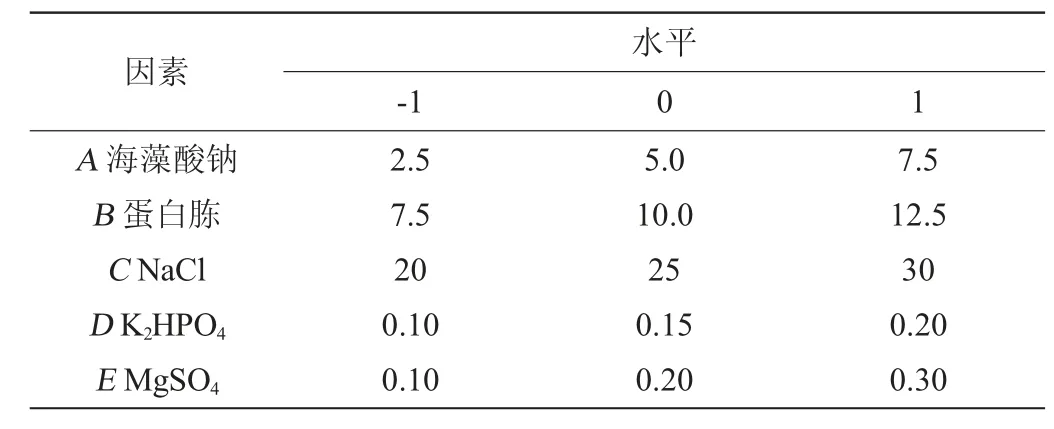
表1 弧菌HB161653产褐藻胶裂解酶培养基组成优化正交试验因素与水平Table 1 Factors and levels of orthogonal experiments for optimization of alginate lyase production medium composition of Vibrio sp.HB161653 g/L
1.3.3 产褐藻胶裂解酶培养发酵条件优化
在优化产酶培养基基础上分别考察培养基初始pH(5.0、6.0、7.0、8.0、9.0)、接种量(0.5%、1.0%、1.5%、2.0%、2.5%)、发酵温度(22 ℃、25 ℃、28 ℃、31 ℃、34 ℃)对弧菌HB161653产酶的影响。
1.3.4 发酵产酶周期的测定
在优化培养基组成和培养条件下进行发酵,定期取样测定褐藻胶裂解酶活力和发酵液菌体生物量。以发酵时间为横坐标,以褐藻胶裂解酶活力、菌体生物量为纵坐标,确定弧菌HB161653的发酵周期。
1.3.5 测定方法
生物量测定:采用分光光度法,细菌生物量以波长600 nm处的吸光度值表示。
褐藻胶裂解酶活性测定:采用紫外吸收法[22]。取1.8 mL底物(3.0 g海藻酸钠溶于1 L 50 mmol/L磷酸盐缓冲液(pH 7.0)),40 ℃预热5 min,加入0.2 mL待测样品于40 ℃温浴10 min,以灭活酶液为对照,测定反应体系在波长235 nm处的紫外吸收值。在上述酶活性测定方法下,波长235 nm处紫外吸收值每分钟增加0.1的酶量为酶的一个活力单位,U。试验中将最高的酶活性定义为100%,其余条件下的酶活力与最高酶活的比值为相对酶活。
2 结果与分析
2.1 弧菌HB161653产褐藻胶裂解酶培养基组成优化单因素试验
2.1.1 不同的碳源及最适碳源添加量对弧菌HB161653产酶的影响
由图1可知,以葡萄糖、可溶性淀粉和蔗糖为唯一碳源时菌株产酶能力较弱,以海藻酸钠为唯一碳源时酶活最高。因此,选择海藻酸钠作为弧菌HB161653生长的唯一碳源。

图1 不同碳源对弧菌HB161653产酶的影响Fig.1 Effect of different carbon sources on enzyme production by Vibrio sp.HB161653
由图2可知,海藻酸钠添加量较低时酶活随着海藻酸钠含量增加而提高,当海藻酸钠添加量为5 g/L时,菌株产酶能力最强;继续增加海藻酸钠添加量,菌株的产酶能力出现下降趋势。这可能是由于海藻酸钠添加量较低时,不能满足菌体正常生长代谢所需导致产酶能力较低;添加量较大时发酵液黏度高,不利于氧气融合和细胞生长。因此,选择发酵培养基的海藻酸钠添加量为5 g/L。

图2 不同海藻酸钠添加量对弧菌HB161653产酶的影响Fig.2 Effect of different sodium alginate addition on enzyme production by Vibrio sp.HB161653
2.1.2 不同的氮源及最适氮源添加量对弧菌HB161653产酶的影响
由图3可知,几种氮源都可以被菌株HB161653利用,以蛋白胨作为唯一氮源时,菌株的产酶能力最强,酵母粉、硫酸铵次之,尿素最差。因此,选择蛋白胨作为弧菌HB161653生长的唯一氮源。

图3 不同的氮源对弧菌HB161653产酶的影响Fig.3 Effect of different nitrogen sources on enzyme production by Vibrio sp.HB161653
由图4可知,菌株的产酶能力随着蛋白胨添加量的增加而增加,当蛋白胨添加量为10 g/L时达到最大值,之后出现下降趋势,蛋白胨添加量过高或太低时都会影响褐藻胶裂解酶的积累。这可能是由于蛋白胨添加量较低时,不能满足菌体正常生长代谢所需;含量较高时也不利于产酶。因此,选择蛋白胨最佳添加量为10 g/L。

图4 不同蛋白胨添加量对弧菌HB161653产酶的影响Fig.4 Effect of different peptone addition on enzyme production by Vibrio sp.HB161653
2.1.3 金属离子对弧菌HB161653产酶的影响
由图5可知,当NaCl添加量为25 g/L时产酶量达到最大值,这与海洋中的盐浓度较为接近。当NaCl添加量<25 g/L时,产酶能力呈上升趋势,当NaCl添加量>25 g/L时产酶能力逐渐下降。因此,选择最佳NaCl添加量为25 g/L。
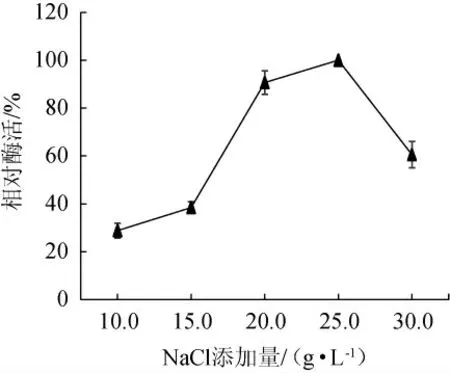
图5 不同NaCl添加量对弧菌HB161653产酶影响Fig.5 Effect of different NaCl addition on enzyme production by Vibrio sp.HB161653
研究表明,K2HPO4、MgSO4对菌株产酶有促进作用[23]。因而,进一步考察K2HPO4添加量和MgSO4添加量对菌株产酶的影响。由图6可知,当K2HPO4添加量达到0.2 g/L时菌株的产酶能力最强,当K2HPO4添加量>0.2 g/L时,该菌的产酶能力呈逐渐下降趋势;当MgSO4添加量达到0.15 g/L时该菌株的产酶能力最强,当MgSO4添加量>0.15 g/L时,该菌的产酶能力呈逐渐下降趋势。因此,最佳K2HPO4及MgSO4添加量分别为0.2 g/L、0.15 g/L。

图6 不同K2HPO4、MgSO4添加量对弧菌HB161653产酶影响Fig.6 Effect of different K2HPO4 and MgSO4 addition on enzyme production by Vibrio sp.HB161653
2.2 弧菌HB161653产褐藻胶裂解酶培养基组成优化正交试验
由表2可以看出,各因素对菌株产酶的影响大小为海藻酸钠>K2HPO4>MgSO4>NaCl>蛋白胨添加量,菌株HB161653产褐藻胶裂解酶的最适组合为A2B1C2D3E1,即发酵培养基组成为海藻酸钠5 g/L、蛋白胨7.5 g/L、NaCl 25 g/L、K2HPO40.2 g/L、MgSO40.1 g/L。在此条件下测得的酶活力为26.02 U/mL。
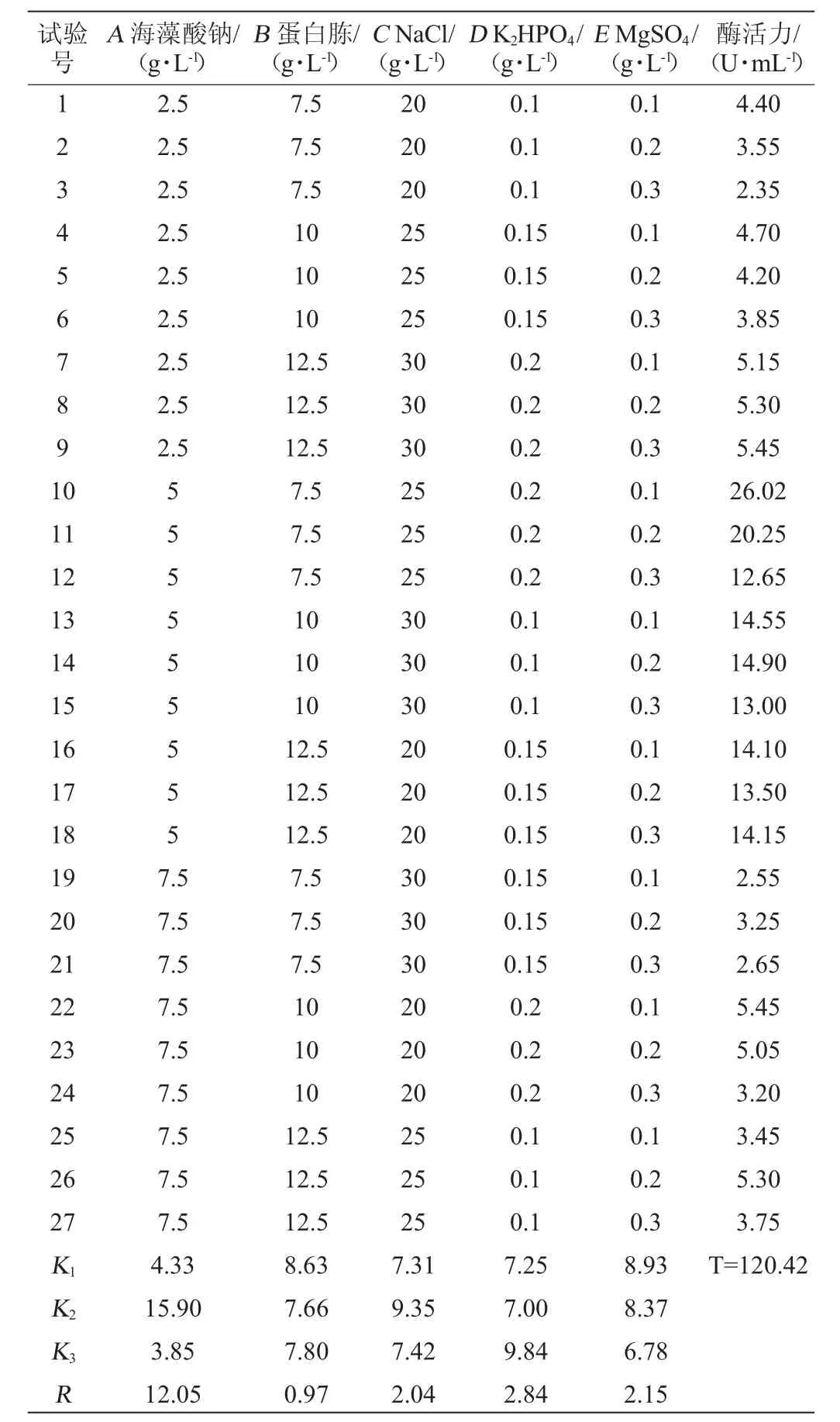
表2 弧菌HB161653产褐藻胶裂解酶培养基组成优化正交试验结果与分析Table 2 Results and analysis of orthogonal experiments for optimization of alginate lyase production medium composition of Vibrio sp.HB161653
2.3 弧菌HB161653产褐藻胶裂解酶发酵条件优化
2.3.1 接种量对弧菌HB161653产酶的影响
由图7可知,弧菌HB161653的产酶能力随着接种量的增加而增加,当接种量为1.5%时褐藻胶裂解酶活力最高。接种量超过1.5%,褐藻胶裂解酶活力逐渐下降,可能是由于菌株此时大量繁殖,培养基中营养物质被大量消耗,导致菌株的产酶量下降。因此,确定最佳接种量为1.5%。

图7 接种量对弧菌HB161653产酶的影响Fig.7 Effect of inoculum on enzyme production by Vibrio sp.HB161653
2.3.2 培养基初始pH值对弧菌HB161653产酶的影响
pH值影响着细胞膜的稳定性,进而影响细菌的产酶能力[24]。由图8可知,培养基初始pH值为5.0~9.0时,酶活先升高后降低。当培养基初始pH值为7.0时,酶活最高,中性的环境有利于该弧菌产褐藻胶裂解酶。因此,确定最佳培养基初始pH值为7.0。
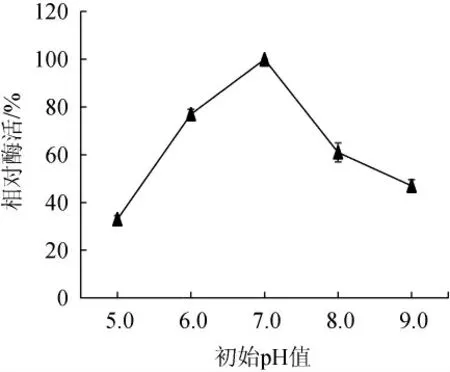
图8 培养基初始pH值对弧菌HB161653产酶的影响Fig.8 Effect of medium initial pH on enzyme production by Vibrio sp.HB161653
2.3.3 发酵温度对弧菌HB161653产酶的影响
温度对细菌产褐藻胶裂解酶的能力起至关重要的作用,在合适的温度下才能保证菌株产酶的顺利进行[25-26]。由图9可知,发酵温度为28 ℃时产酶最高,发酵温度高于28 ℃时,酶活出现大幅度下降。因此,确定最佳发酵温度为28 ℃。

图9 发酵温度对弧菌HB161653产酶的影响Fig.9 Effect of fermentation temperature on enzyme production by Vibrio sp.HB161653
2.3.4 弧菌HB161653生长及产酶曲线测定
由图10可知,在发酵初期(8~14 h),菌体处于对数生长期,消耗培养基中的营养成分进行生长繁殖,发酵时间为14 h时,菌体生物量达到最大值;发酵时间>14 h之后,菌体的生物量随着时间的延长逐渐下降。在发酵时间为8~12 h时,菌体的产酶能力随着发酵的进行呈快速上升趋势,在发酵时间为12 h时,褐藻胶裂解酶活力达到最高(42.1 U/mL),较优化前(26.0 U/mL)提高了62%。因此,最佳发酵时间为12 h。

图10 弧菌HB161653的生长及产酶曲线Fig.10 Growth and enzyme production curves of Vibrio sp.HB161653
3 结论
培养基为细菌的生长与繁殖提供必备的营养物质。本试验通过单因素和正交试验对弧菌HB161653的产酶条件进行优化。最佳产酶培养基组成为海藻酸钠5 g/L,蛋白胨7.5 g/L,NaCl 25 g/L,K2HPO40.2 g/L,MgSO40.1 g/L;最佳发酵条件为培养基初始pH 7.0,接种量1.5%,发酵温度28 ℃,发酵周期12 h。采用优化后的培养基和发酵条件进行产酶试验,褐藻胶裂解酶活力可达42.1 U/mL,较优化前(26.0 U/mL)提高了62%。本研究对产褐藻胶裂解酶弧菌HB161653的发酵培养基和工艺条件进行研究,以期为褐藻胶裂解酶的生产以及工业化应用提供理论依据。
