贻贝粘蛋白对痔病大鼠模型治疗作用的实验研究
2022-12-10田茂生高记华戚文月刘朝阳吴琳琳高策顾铭康瑞娟李利霞
田茂生 高记华 ∗戚文月刘朝阳吴琳琳高策顾铭康瑞娟李利霞
(1.河北中医学院,石家庄 050091;2.河北中医学院第一附属医院,石家庄 050011;3.河北省中西医结合胃肠病研究重点实验室,石家庄 050011;4.山西省人民医院,太原 030002;5.中国科学院过程工程研究所,北京 100190)
痔病是一种常见的肛肠疾病,是直肠肛垫组织的异常病理性肥大、移位[1-2],痔组织的肿胀脱垂、出血、疼痛、炎性刺激、排便困难等是痔病常见的临床症状,肛肠疾病患者中合并痔病症状的占比可达98.09%[3-5]。痔病治疗原则是治疗有症状的痔[3-6],由于该病的特殊性和高病发率,直肠局部用药成为I、II 度痔病患者的最佳治疗方式,同时也给直肠局部抗痔药物的药效学研究带来了更多的挑战[7-12]。目前痔病仍然没有绝对有效的药物治法,这是由于痔病症状是缓慢出现且是多因素的,涉及到肛垫微循环调节障碍、肛垫悬吊组织退行性病变等原因。
海洋生物贻贝的足丝腺分泌物提取的大分子蛋白——贻贝粘蛋白(MAP),已在临床中证明具有局部抗炎和促进愈合的作用[13-14]。一项针对体外生物活性研究的双盲对照临床试验显示,MAP 能够减少促炎因子(IL-1α,IL-6,COX-2) 表达,保护HaCaT 细胞免受UVB 诱导的细胞死亡和凋亡[15]。随着生物材料技术的发展,海洋生物贻贝的足丝腺经粉碎、提取、色谱纯化、浓缩等制备工艺,可得到高纯度的生物大分子蛋白,进一步加工合成新型凝胶制剂贻贝粘蛋白肛肠敷料[16]。本研究基于直肠局部用药要求建立巴豆油诱导的痔病大鼠模型,探究贻贝粘蛋白(MAP)的抗痔疗效和黏附性,并探讨其作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物
68 只6~8 周龄的SPF 级SD 大鼠,体重180~220 g,雌雄各半,由浙江维通利华实验动物技术有限公司提供【SCXK(浙)2020-0002】。进行实验期间,大鼠被饲养于菲诺克生物科技(上海)有限公司屏障设施实验室【SYXK(沪)2018-0023】,温度(22 ± 2)℃,湿度40%~70%,12 h 交替昼夜灯光,以标准的实验室饲料、正常饮用水喂养1 周,实验前12 h 禁食但不禁水。所有实验方案均经菲诺克生物科技实验动物福利伦理审查委员会批准(phenotek-sh008)。
1.1.2 主要试剂与仪器
吡啶(C10376055,上海麦克林生化技术有限公司),巴豆油(KD2HE-FH,东京化工股份有限公司),橄榄油(K1809057,上海阿拉丁生化技术有限公司),甲酰胺(C10541284,上海麦克林生化技术有限公司),伊文斯蓝染料(EBD,C10325619,上海麦克林生化技术有限公司),异硫氰酸荧光素(FITC,C11189816,上海麦克林生化技术有限公司),2%异氟烷(2017171101,深圳瑞沃德生命技术有限公司),复方醋酸地塞米松乳膏(1905001X,华润三九制药有限公司),贻贝粘蛋白肛肠敷料(MAP,江阴贝瑞森生化技术有限公司),蛋白提取液(MDL91201,MDL),蛋白酶抑制剂(MD912893,MDL),中等蛋白分子量 marker (ThermoFisher Scientific),重组 Anti-actin 抗体(MD6553,MDL),二抗(MD912565,MDL),重组 Anti-MUC2 抗体(ab133555,Abcam),重组 Anti-MUC4 抗体(ab194363,Abcam)。
多通道动物麻醉系统(深圳瑞沃德生命技术有限公司,中国),FA-N 电子天平(上海力辰邦西仪器科技有限公司,中国),Q24 型组织破碎匀浆仪(鼎昊源科技有限公司,中国),SH-1000Lab 全波长酶标仪(株式会社日立制造所,日本),D3024R 台式高速冷冻型离心机(大龙兴创实验仪器有限公司,中国),LeicaASP300S 型全自动脱水机(LEICA 公司,德国),Leica RM2245 型半自动切片机(LEICA 公司,中国),Leica TS5015 型全自动染色机(LEICA 公司,德国),Olympus BX45 型光学显微镜(Olympus 公司,日本),DP72 型图像分析系统(Olympus 公司,日本),MZX81 立体荧光显微镜(广州明美光电技术有限公司,中国),超低温冷冻存储箱(长虹美菱有限公司,中国),PVDF 膜(ISEQ00010,Millipore,美国),3 MM 滤纸(3030861,Whatman,英国),TS-100 脱色摇床(海门其林贝尔仪器制造公司),电泳仪(BGsubMIDI,北京百晶生物技术有限公司),SDSPAGE 电泳系统(Bio-Rad,美国),凝胶成像系统(GelDoc-It310,UVP,美国),化学发光成像系统(ChemiScope6100,上海勤翔科学仪器有限公司)。
1.2 方法
1.2.1 MAP 对痔病模型的药效学实验
(1)分组:将40 只SPF 级SD 大鼠按体重随机分为4 组,每组10 只,分别为对照组、模型组、地米组和贻贝组。
(2)造模和给药:在前期研究基础上采用优化方案造模[12],取直径合适的棉签浸泡于6%巴豆油混合液,缓慢置入大鼠肛门直肠至合适的深度后停留10 s,抽出棉签均匀涂在肛周皮肤。对照组用橄榄油替代巴豆油。造模后1 h,每组大鼠经肛门直肠进行局部治疗,疗程每天1 次,连续3 d,治疗时动物吸入2%异氟烷维持麻醉状态2 h。对照组未接受治疗,模型组给予空白凝胶基质,DXM 组给予复方醋酸地塞米松乳膏,MAP 组给予贻贝粘蛋白肛肠敷料。给药时采用1 mL 去针头注射器,将注射器插入大鼠肛门直肠至10 mm,注射推注药物每只200 μL。
(3)实验取材:造模后D4 解剖取材,处死前30 min 将1%的EBD(2 mL/kg)注入大鼠尾静脉。按优化方案取材,取材前动物吸入过量CO2安乐处死,处死后由同一操作者截取8 mm 直肠作为标本,部分标本取材迅速置于液氮中保存3 h,再移至-80℃低温冰箱保存备用。眼眶取血约1.5 mL,保存至无菌采血管,室温血液自然凝固30 mim,4℃条件离心10 min 左右(3000 r/min),仔细收集上清,置于-80℃低温冰箱保存备用。
(4)大体观察:D4 各组大鼠称重,观察粪便情况,肛周皮肤及肛门直肠黏膜有无水肿、黏液、分泌物渗出情况。
(5)黏膜肿胀抑制率:采用Image J 软件分析各组标本的照片,测算EBD 染色肿胀范围的面积,分析比较各组肿胀情况,肿胀抑制率(%)=(对照组肿胀面积-实验组肿胀面积)/对照组肿胀面积×100%。
(6)肛肠系数:按标准取材后对每组动物标本进行湿重称重,计算肛肠系数,肛肠系数(%)=标本湿重/动物体重×100%。
(7)血管通透性的定量检测:根据文献检测血管通透性的方法[17-18],标本置于含有甲酰胺(1 mL/100 mg)的试管中,在55℃的水浴中孵育24 h,在室温下离心15 min(5000 r/min),收集上清液。酶标仪测定620 nm 处吸光度,计算组织中EBD 渗出量,定量评估血管通透性。
(8)Western Blot 检测:蛋白提取,组织加液氮进行匀浆,4℃,12 000 rpm,15 min 离心,收集上清;BCA 蛋白定量法测定蛋白浓度,将各个标准品和待测样品在562 nm 处的吸光值减去空白标准品的平均吸光值。制备SDS-PAGE 凝胶,配制5%浓缩胶4 mL,凝胶板重新垂直放置,插入样品梳,玻璃夹板“凹”面贴紧电泳槽,两侧用夹子固定电泳槽。加入总蛋白样品与蛋白质凝胶电泳上样缓冲液混合,95℃变性10 min,电泳使染料至分离胶适当位置,将蛋白条带通过转移电泳方式转印至PVDF 膜。转膜时将样品胶与膜装入转膜夹板中,放入含有转膜缓冲液的转移电泳槽中,恒压状态下转膜2 h。抗体孵育:封闭:小心取出转移膜置于封闭液中,室温、摇床上缓慢摇动状态下封闭1 h;一抗反应:将一抗用封闭液稀释;将封闭后的膜分别加入对应的一抗工作液中,4℃反应过夜。洗膜:将反应膜放入平皿中,用1 × TBST 洗涤3 次,每次10 min,洗净未结合的一抗;二抗反应:将二抗用1 菌素× TBST 稀释300倍;将洗涤后的一抗反应膜放入二抗工作液中作用60 min;洗膜:用1×TBST 洗膜,洗去游离二抗。按1∶1(v/v)混合ECL 试剂盒中两种液体,将混合液均匀铺在PVDF 膜表面,室温作用4 min,抖掉膜上液体,放入成像系统成像,软件分析蛋白条带灰度值,计算样本组织蛋白相对含量。
(9)酶联免疫法检测:通过ELISA 法检测血清TNF-α、IL-6、MDA 的表达含量,严格按照ELISA 试剂盒说明书进行。
1.2.2 MAP 肠道黏附性的实验
制备FITC-MAP 溶液,MAP 与FITC 按100∶1比例混合,4℃反应24 h,避光保存待用。取28 只SPF 级SD 大鼠按体重随机分为3 组,分别为在体组12 只,离体组12 只,对照组4 只。在体组大鼠以2%异氟烷吸入诱导麻醉,每只大鼠灌肠予以FITCMAP 溶液(1 mg/mL,每只1 mL),燕尾夹关闭肛门,分别于灌肠后2、4、8、24 h 处死解剖取材,截取4 cm直肠作为标本,完成荧光成像观察。离体组大鼠麻醉后解剖,取直肠8 cm,剥离周围脂肪及内容物,生理盐水冲洗后置入加湿的培养皿,取4 cm 肠段处作标记,远端燕尾夹关闭肛门,近端灌注FITC-MAP 溶液(1 mg/mL,每只1 mL),标记处结扎,分别于灌注后0、0.5、1、2 h 取标记段直肠为标本,完成荧光成像观察。对照组大鼠未进行任何干预,方法同前,取材后0 h 对标本荧光成像观察。
1.3 统计学分析
采用SPSS 25.0 软件和GraphPad Prism 8.0 软件对实验数据进行统计分析。测量数据均以平均值 ± 标准差()表示,进行正态性检验,组间比较采用单因素方差分析或非参数检验,P<0.05 为差异具有显著性。
2 结果
2.1 MAP 对大鼠痔病模型的药效学实验结果
2.1.1 大体形态观察结果
各组动物取材后拍照记录,如图1A 所示,观察肛肠黏膜可见痔病模型大鼠的肛周皮肤及直肠黏膜呈现不同程度的肛周肿胀、黏膜水肿、黏液分泌和血性渗出物。地米组大鼠体重明显减少,较其他实验组差异具有显著性(图1B,P<0.05),其他组体重无统计学差异。提示地米组和贻贝组病灶区域的病变程度均低于模型组,说明MAP 可减轻肛门直肠粘膜肿胀,促进损伤黏膜愈合,但DXM 可引起体重下降。
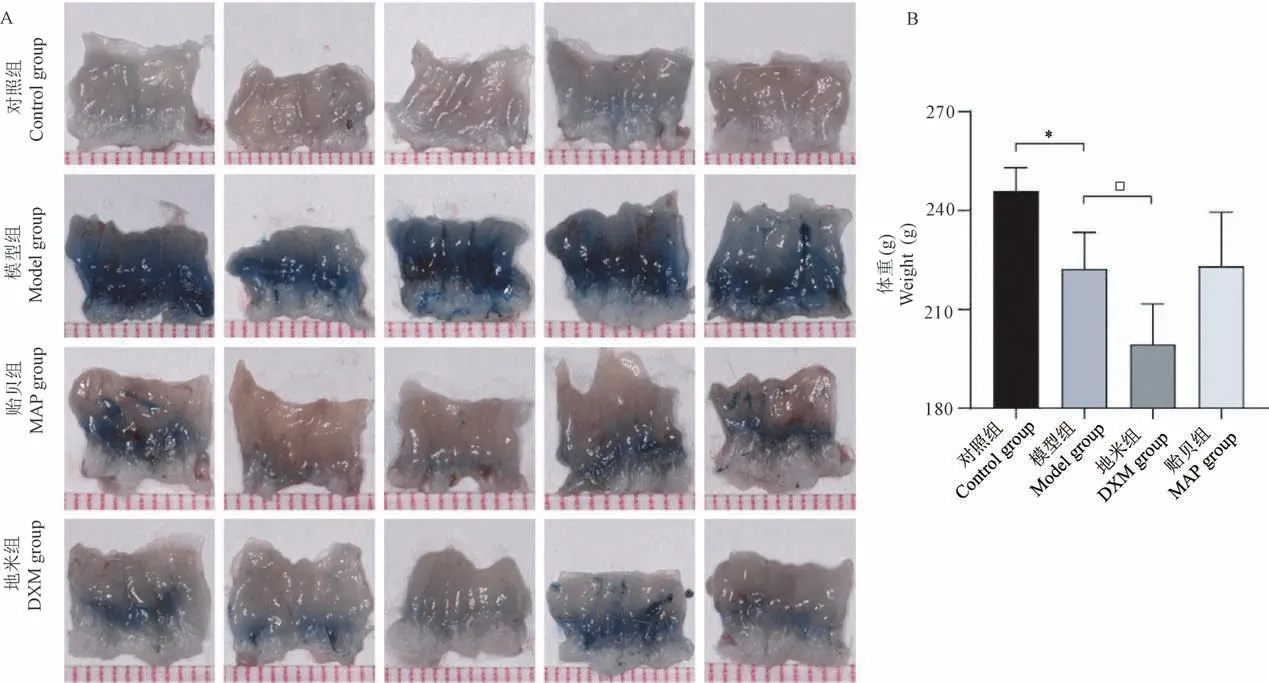
图1 大体形态观察结果Note.A.Observation of the grass morphology of anorectal mucosa in each group.B.Weight comparison of each group.Compared with control group,∗P <0.05.Compared with the model group,□P <0.05.(The same in the following figures)Figure 1 Observation on gross morphology
2.1.2 黏膜肿胀抑制率结果
通过Image J 软件分析标本照片,测算标本EBD 染色肿胀范围的面积,结果可知地米组和贻贝组黏膜肿胀范围较对照组明显减少,差异具有显著性(图2A,P<0.01),地米组肿胀抑制率53.09%,贻贝组肿胀抑制率36.08%,表明工具药DXM 与MAP 均能一定程度缓解巴豆油诱导的大鼠肛门直肠黏膜肿胀。
2.1.3 肛肠系数结果
各组肛肠系数的结果见图2B 所示,与对照组比,模型组的肛肠系数明显增大(P<0.01),表明模型组的肛门直肠黏膜的组织密度增加,黏膜水肿充血程度增加。与模型组比,地米组的肛肠系数显著降低(P<0.05),表明地米组的肛门直肠黏膜的组织密度降低,黏膜水肿充血程度降低,即动物模型差异具有显著性,模型建立成功。贻贝组的肛肠系数低于模型组,肛门直肠黏膜的水肿充血程度降低,说明MAP 可一定程度上缓解模型病变。
2.1.4 血管通透性的定量检测结果
通过对各组EBD 含量定量检测结果显示(图2C),地米组和贻贝组的EBD 含量均显著低于模型组(P<0.01),这说明经肛门直肠局部外用DXM和MAP 能显著降低模型病灶组织局部的血管通透性,且MAP 的效力与DXM 相当。
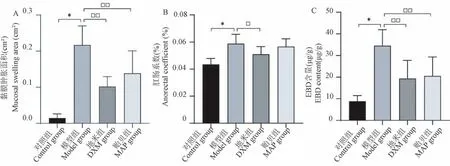
图2 各组数据比较结果Note.A.Comparison of mucosal swelling area.B.Comparison of anorectal coefficient.C.Comparison of EBD content.Compared with model group,□□P <0.01.(The same in the following figures)Figure 2 Comparison results of each group of data
2.1.5 Western Blot 检测结果
Western Blot 显示,与对照组相比,模型组蛋白相对表达量差异具有显著性,与模型组相比,贻贝组、地米组蛋白相对表达量差异具有显著性(图3,P<0.05),表明痔病模型大鼠局部治疗后,增加了黏蛋白Muc2、Muc4 的相对表达量。
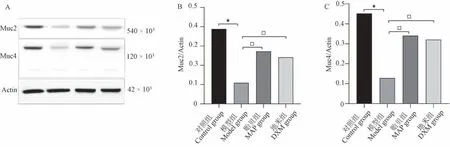
图3 各组Muc 2、Muc 4 蛋白相对表达量的比较Note.A.The expression of Muc2 and Muc4.B.The relative expression of Muc2.C.The relative expression of Muc4.Figure 3 Comparison of relative expression levels of Muc2 and Muc4 proteins in each group
2.1.6 酶联免疫法检测检测结果
ELISA 的检测结果显示,痔病模型模型组血清TNF-α、IL-6、MDA 表达量与对照组比差异具有显著性(图4,P<0.01),模型组高于对照组,局部药物干预后与模型组相比,贻贝、地米组表达量下降,差异具有显著性(图4,P<0.01),且与贻贝组相比,地米组TNF-α 表达量差异具有显著性(图4,P<0.01)。
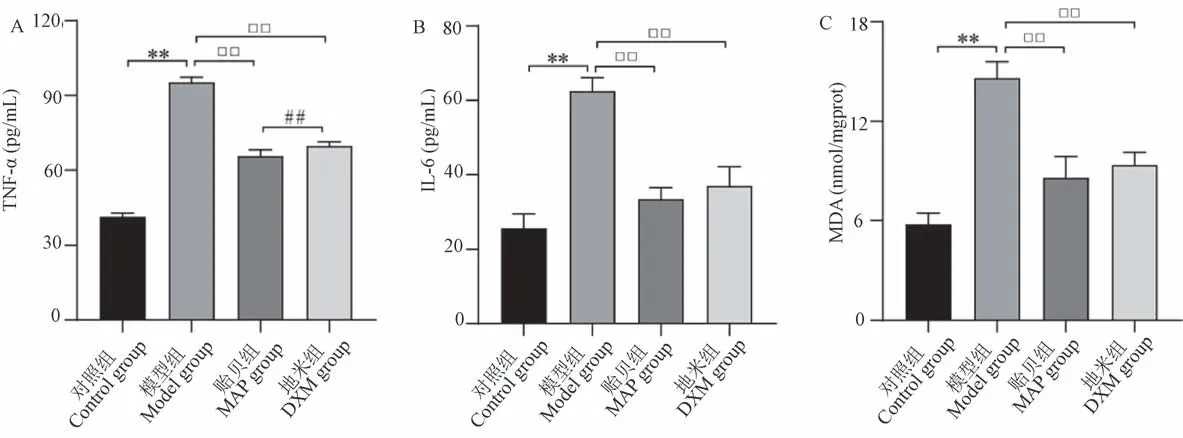
图4 各组血清TNF-α、IL-6、MDA 表达量的比较Note.A.The expression of TNF-α.B.The expression of IL-6.C.The expression of MDA.Compared with the control group,∗∗P <0.01.Compared with the MAP group,##P <0.01.Figure 4 Comparison of serum TNF-α,IL-6 and MDA expression levels in each group
2.2 MAP 肠道黏附性的评价结果
通过荧光显微镜观察FITC-MAP 溶液灌注于大鼠直肠腔内的情况,并获取不同时间点在体和离体大鼠直肠组织的荧光成像图像。FITC-MAP溶液在荧光显微镜下显示为绿色,可作为MAP 在直肠黏膜的黏附性和降解趋势的参考。在体组可见大鼠直肠的绿色荧光成像与时间呈正相关,提示MAP 在大鼠肠腔环境内能保持良好的黏附性,且经肛门直肠用药后与直肠黏膜的作用时间可达24 h(图5)。离体组大鼠的直肠组织荧光成像结果显示,MAP 在离体直肠中也具有良好的稳定性。但是,对照组大鼠的直肠组织荧光成像几乎找不到荧光颜色(图6)。
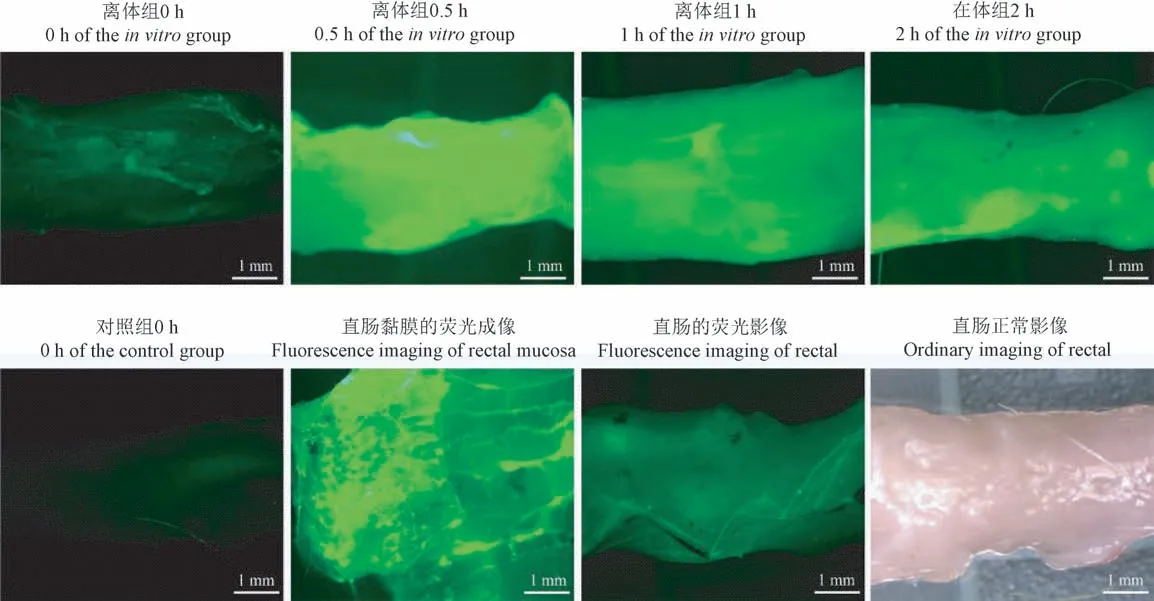
图6 离体组和对照组的荧光成像Figure 6 Fluorescence imaging in the in vitro group and control group
3 讨论
痔病的症状多表现为肛垫的充血、肿胀、糜烂、出血、分泌物增多等现象,痔病发生部位即肛垫黏膜区,黏膜上皮是包含多种功能的上皮细胞复合体,黏膜表层有大量分泌功能的黏液分泌细胞,如杯状细胞、柱状细胞等,可分泌黏蛋白、黏多糖、糖原等防御功能物质,共同构成黏液屏障,黏附有害物质,阻止微生物入侵。肛垫黏膜的细胞结构决定了其不仅有重要防御功能,当致痔因子突破肛垫黏膜屏障时会引起局部组织的神经激素内分泌调节障碍,痔血管出现扩张,毛细血管的通透性增加,肛垫黏膜水肿、充血、损伤,局部感染出现炎症,导致症状性痔出现。因此,肛垫黏膜屏障功能的完整与修护在痔病的防治中具有重要意义。
本研究采取巴豆油刺激大鼠肛门直肠黏膜产生炎症反应诱导大鼠痔病模型[19],损伤局部毛细血管壁,破坏血管内皮屏障,增加血管通透性,引起组织损伤血浆渗出,这一过程降低了血浆胶体渗透压,促进更多组织液滤出毛细血管,累积于间质间隙,发生组织水肿、黏膜充血,由此模型大鼠的肛门直肠黏膜组织呈明显肿胀[20]。因此,定量评估血管通透性的变化是该实验模型的关键。Azeemuddin等[19]报道了一种利用EBD 外渗技术定量检测血管通透性的方法[21],于巴豆油造模前30 min 尾静脉注射EBD,灌胃给药5 d 后处死动物,再评价组织中EBD 含量。笔者对EBD 的使用方法进行优化,选择治疗3 d 后动物处死前30 min 尾静脉注射EBD。定量检测结果更直接反映不同疗法对动物血管通透性变化的影响,同时规避造模及给药操作等人为因素对EBD 渗出的干扰,保障实验数据精准,为模型评价提供精确定量指标。局部给药时采取2%异氟烷吸入诱导麻醉,使动物维持一定时间麻醉静息状态,确保药物制剂经肛门直肠用药后在体内的有效及起效时间,降低排便频率差异对疗效评价的影响。目前还没有公认的阳性药物用于评价该模型的建立,巴豆油诱导的大鼠痔病模型具有炎症性模型特征,因此以经典抗炎药物DXM 为工具药,用于评价模型建立[22]。实验发现连续应用DXM 可引发大鼠体重明显下降,尽管其能够降低局部血管通透性,抗炎疗效明显,但糖皮质激素药物存在一定安全性问题,不适合长期应用。
脏器系数又称脏体比,是某器官的重量与体重的重量之比,脏器系数的增加表明该器官可能发生充血、水肿、增生肥大等病变[18]。在这项研究中,肛门直肠组织不是一个完整的器官,而是直肠末端的一部分,截取标本时操作误差可能对肛肠系数的精度产生一定影响,半定量评价指标肛肠系数可从一定程度反映疗效。黏膜上皮细胞分泌的黏液主要来自杯状细胞等分泌细胞,对维持黏膜屏障功能有重要作用,形成黏液的主要蛋白是 Muc2、Muc4[23-24],属于分泌型黏蛋白,能够促进上皮细胞的受损部位愈合,促进黏膜修复。机体内自由基作用于脂质发生过氧化反应,氧化终产物为MDA,其含量反映的是机体抗氧化潜在能力的重要参数,可以反映机体脂质过氧化速率和强度,间接反映组织过氧化损伤程度。
MAP 是一种基于海洋生物贻贝足丝腺黏附机制开发的仿生生物材料,已广泛应用外科、妇产科、烧伤整形科、皮肤科、激光美容等多个领域[13-14],表现出良好的局部抗炎和促进愈合功效[15,25]。本实验评价了MAP 对痔病大鼠模型的治疗效果及黏膜的修复情况,经大体观察、肛肠系数、血管通透性比较、Western Blot、ELISA 法检测发现MAP 在复杂的直肠环境中可保持长期黏附,不受排便等因素影响,保证了MAP 与肛肠黏膜有效接触面积和起效时间,局部外用可造成大鼠直肠黏膜中黏蛋白Muc2和Muc4 蛋白相对表达量增加,炎性因子TNF-α、IL-6,黏膜修复相关因子MDA 的表达量下降,MAP、DXM 均可一定程度改善模型大鼠的病变,缓解肛周肿胀、黏膜水肿充血,促进黏膜创面愈合。MAP 具有生物黏附剂给药系统的相似特性[26],在不稳定的直肠环境中发挥优势。MAP 含有20%的赖氨酸,使蛋白质具有较高的正电荷,并通过静电作用与细胞紧密快速结合。MAP 中含有的3,4 二羟基苯丙氨酸(DOPA)可被氧化生成邻二醌,与未氧化的多巴交联形成网状生物支架,促进细胞黏附和爬行,促进直肠黏膜组织再生和修复。交联的MAP 可通过静电相互作用与覆盖在肠上皮细胞表面的黏蛋白结合[27],黏蛋白、黏多糖是具有重要防御功能的物质,形成直肠黏膜屏障功能,可有效阻止微生物、微粒和大分子入侵。黏蛋白由高分子量丝状糖蛋白组成,与MAP 的化学结构和功能上有相似之处,MAP 可以取代受损黏蛋白修复结直肠上皮细胞,恢复细胞间的紧密连接[28],恢复直肠黏膜屏障功能的完整性,减少对黏膜上皮细胞的持续炎症刺激[29]。MAP 具有较强的抗氧化能力[30],可保护组织免受内部氧化应激的损伤,通过与硫化氢反应,保护黏蛋白的二硫键不被破坏,维持和恢复黏液层的完整性,中和各种氧自由基,起到抗炎修复作用。
综上所述,本研究评价了MAP 对大鼠痔病模型肛门直肠黏膜肿胀的治疗效果,研究结果表明,MAP 能够减轻大鼠肛门直肠黏膜肿胀、增加黏膜黏蛋白表达、抑制炎症、修复黏膜屏障、促进黏膜愈合、改善痔病大鼠模型症状,同时证实其在直肠复杂环境中的良好黏附性,为痔病药物的临床前药理药效研究提供可靠方法。
