多囊卵巢综合征大鼠子宫内膜中PI3K/AKT 通路相关蛋白表达异常与胰岛素抵抗的关系
2022-12-10尹丽红焦琳陈裕陈嘉欣杜斯琪王翰林赵舜滢殷春霞曹丽芬余万霖谢长才
尹丽红,焦琳,陈裕,陈嘉欣,杜斯琪,王翰林,赵舜滢,殷春霞,曹丽芬,余万霖,谢长才∗
(1.广州中医药大学第二临床医学院,广州 510006;2.广东省中医院,广州 510120;3.广州医科大学附属中医医院,广州 510130)
多囊卵巢综合征(polycystic ovarian syndrome,PCOS)是临床常见的妇科内分泌与生殖障碍并存的疾病[1]。随着生活方式和环境因素的改变,PCOS的发病率更是呈持续上升的趋势[2]。目前此病的发病机制虽尚不明确,但以胰岛素抵抗(insulin resistance,IR)为中心的代谢紊乱是PCOS 患者重要的病理生理改变之一[3]。据报道,临床约50%~70% 的 PCOS 患者存在胰岛素抵抗(insulin resistance,IR)[4]。PCOS 伴IR 引起外周组织对胰岛素的敏感性下降,血清胰岛素水平升高,升高的胰岛素导致高雄激素血症,过高的雄激素一方面可以作用于卵巢抑制卵泡发育,另一方面又会进一步加剧外周IR,两者形成恶性循环,最终造成育龄期PCOS 患者受孕困难,生育力低下[5]。随着研究的深入,在21 世纪初,Moran 等[6]、McGee 等[7]发现卵巢局部存在IR 现象,提出了卵巢IR 的概念。卵巢IR 不仅会改变卵巢的糖代谢情况,更重要的是可以使卵巢处于功能亢进的状态,对促性腺激素的反应性显著增加,甾体激素分泌异常,造成卵泡发育障碍。然而,随着近年来辅助生殖技术的发展,PCOS患者在体外受精-胚胎移植周期中仍然存在低种植率、高流产率的现象[8],因此有学者认为子宫IR 可能是PCOS 患者生育力低的重要原因[9]。
IR 临床诊断指标是基于空腹血糖和空腹胰岛素的HOMA-IR 指数,此外,新兴的IR 生物标记物也可作为诊断的参考指标[10];其主要信号调控途径包括胰岛素受体底物1(insulin receptor substrate 1,IRS1/磷脂酰肌醇3 激酶(phosphatidylinositol-3-kinase,PI3K)、丝氨酸-苏氨酸激酶(serine-threonine kinase,Akt)通路、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路及Smad3 通路等。IR 的机制主要为胰岛素与胰岛素受体结合缺陷及胰岛素信号传导异常。研究表明,胰岛素受体及PI3K表达降低,减少囊泡移位到细胞膜外,导致葡萄糖进入细胞内数量减少。胰岛素受体的丝氨酸磷酸化作用,降低胰岛素受体对PI3K 的激活作用,导致葡萄糖吸收和利用减少[11-12]。本研究拟初步筛选出PCOS 伴IR 大鼠,以动情周期紊乱、卵巢符合多囊卵巢表现且FBG、FINS、HOMA-IR 指数均高于对照组为模型筛选标准,最终通过检测子宫内膜中胰岛素抵抗相关蛋白及PI3K/AKT 通路相关蛋白的表达水平,观察子宫内膜是否存在胰岛素抵抗并探究其可能机制。拟深入PCOS 潜在病理生理改变——子宫内膜IR,为寻找治疗PCOS 的作用靶点提供新思路,为临床解决PCOS 患者妊娠率低、流产率高的问题提供新的治疗方向。
1 材料与方法
1.1 材料
1.1.1 实验动物
32 只SPF 级21 日龄SD 雌性大鼠,体重43~57 g,购于广州南方医大实验动物科技发展有限公司【SCXK(粤)2016-0041】。饲养期间各组大鼠自由饮水,高脂饲料由广东省医学实验动物中心【粤饲证(2019)05073】提供,其成分为蔗糖20%,猪油15%,胆固醇1.2%,胆酸钠0.2%,酪蛋白10%,磷酸氢钙0.6%,石粉0.4%,预混料0.4%及基础饲料52.2%。饲养环境:昼夜各半循环照明,湿度恒定,温度控制在23~26℃,实验室通气良好,清洁,大鼠可以自由饮水和进食,饲养于广东省中医院动物实验室【SYXK(粤)2018-0094】。所有操作均符合广东省中医院实验动物伦理学要求(审批号:2020077)。
1.1.2 实验药物
脱氢表雄酮(DHEA)(Sigma,批号252805),注射用玉米油(产自上海阿拉丁生化科技股份有限公司,批号C116025)。
1.1.3 主要试剂与仪器
胰岛素ELISA 检测试剂盒(Proteinch,批号KE20008),IRS1 抗体(Abclonal,批号A0245),PI3K抗体(Cell signaling technology,批号3358S),PI3K p110α 抗体(Cell signaling technology,批号4249),AKT抗体(Proteintech,批号 60203),p-AKT(Ser473)抗体(Cell signaling technology,批号4060),GLUT-4 抗体(Proteinch,批号66846),βactin 抗体(Cell signaling technology,批号4970S),二抗(Cell signaling technology,批号7074S、7076S),瑞氏染色液(碧云天,批号C0135),苏木素-伊红染液(碧云天,批号C0105S)。EonC 酶标仪(美国BioTek公司),血糖检测仪(德国拜耳公司),IX71 光学显微镜(日本奥林巴斯株式会社)。
1.2 方法
1.2.1 动物分组及实验干预
将SPF 雌性大鼠32 只随机分为2 组:模型组(n=24)和对照组(n=8)。模型组每天于颈背部皮下注射DHEA 6 mg/100 g 并以高脂饲料喂养,对照组于颈背部皮下注射同等体积的注射用玉米油并以正常饲料喂养。实验周期30 d 结束后,根据阴道涂片及卵巢组织染色结果从模型组中筛选出PCOS 模型成功的大鼠11 只,其次通过检测PCOS模型成功大鼠的FBG、FINS、HOMA-IR 指数筛选出PCOS-IR 组大鼠8 只。最后检测PCOS-IR 组与对照组IR 相关蛋白(IRS1、GLUT-4)及PI3K/AKT 通路相关蛋白(PI3K、PI3K p110α、p-AKT、AKT)表达结果。大鼠子宫IR 模型制备:照改良后的PCOS 大鼠动物模型造模方法[13],大鼠颈背部皮下注射DHEA 6 mg/100 g,并以高脂饲料喂养,每天1 次,连续30 d。
1.2.2 形态指标测试及取材
实验期间每3 d 记录1 次大鼠体重,造模后第30 天,大鼠20:00 禁食,次日晨采用2%戊巴比妥钠(0.2 mL/100 g)腹腔注射麻醉后,于腹主动脉取血5~8 mL,测定其空腹血糖(fasting blood glucose,FBG)、空腹胰岛素(fasting insulin,FINS)及计算胰岛素抵抗指数(insulin resistance index,HOMAIR)[14];小心剥离出大鼠子宫,记录重量。
1.2.3 阴道涂片瑞氏染色和卵巢组织HE 染色
(1)阴道涂片瑞氏染色:造模后第24~30 天,连续7 d 取阴道上皮细胞涂片,进行瑞氏染色,干燥后检验;(2)卵巢组织HE 染色:空腹采血后摘取大鼠双侧卵巢,固定包埋后以3.5 μm 的厚度切片,最后进行HE 染色分析,并在光学显微镜下观察组织涂片。
1.2.4 Western Blot
大鼠子宫内膜组织加裂解液冷冻匀浆后,离心(13 500 r/min,4℃)20 min,上清液经BCA 法检测蛋白浓度。上样量为20 μL,电泳条件110 V,100~120 min,湿法转膜,条件200 mA、120 min,其他方法步骤按常规Western Blot 进行,用Bio-Rad 公司的ECL 试剂盒在化学发光检测器中检测,用Image J进行分析。
1.3 统计学分析
采用SPSS 26.0 软件进行统计分析。正态数据以平均值 ± 标准差()标识,采用单因素方差分析(ANOVA)和t检验两两配对进行统计学分析。P<0.01 为差异具有统计学意义。
2 结果
2.1 大鼠体重和子宫质量比结果
实验过程中,每3 d 记录1 次大鼠体重,如图1A 所示,两组大鼠体重差异无统计学意义。实验结束后取各组大鼠子宫组织称重,结果表明两组子宫重量亦差异无统计学意义(图1B)。

图1 各组大鼠体重和子宫重量比较Figure 1 Comparison of body weight and terine weight in each group of rats
2.2 阴道涂片及卵巢组织HE 染色结果
连续7 d 观察各组大鼠阴道上皮细胞形态,如图2A 所示,观察到对照组大鼠规律动情,前期涂片以有核上皮细胞为主,发情期以角质化上皮细胞为主,发情后期涂片均见核上皮细胞、角质化上皮细胞与白细胞,发情间期主要见白细胞。而模型组大鼠阴道涂片长期停滞在发情间期或后期,动情周期紊乱。此外,如图2B 所示,对照组大鼠卵巢组织结构正常,具体可见各个时期卵泡和黄体,颗粒细胞排列整齐;相反模型组大鼠卵巢内偶见卵泡与黄体,排列松散,闭锁卵泡数量较多,且多呈囊性扩张,说明对照组大鼠卵巢基本正常,模型组大鼠卵巢符合多囊卵巢表现。

图2 阴道涂片与卵巢组织HE 染色Note.A.Vaginal smear in each group of rats.B.HE staining of ovarian tissue in each group of rats.Figure 2 Vaginal smear and HE staining of ovarian tissue
2.3 各组大鼠FBG、FINS 及HOMA-IR 指数比较
结果如图3 所示,对照组(n=8)与模型组(n=24)大鼠FBG 水平(图3A)分别为(4.12 ±0.42)mmol/L、(4.98 ± 0.49)mmol/L;FINS 水平(图3B)分别为(44.30 ± 5.29)mU/L、(51.28 ±6.81) mU/L;HOMA-IR指数(图3C) 分别为(7.78 ± 0.78)、(11.29 ± 1.60)。与对照组比较,模型组大鼠FBG、FINS 及HOMA-IR 指数均升高。其中,HOMA-IR 值差异具有统计学意义(P<0.01)。
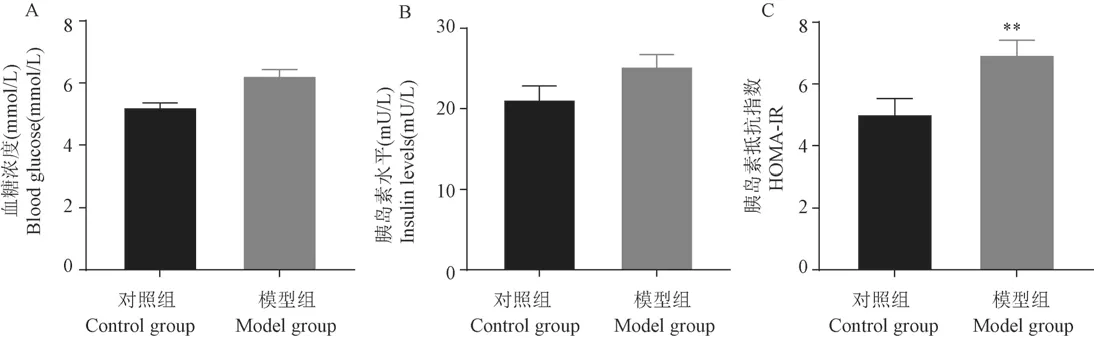
图3 各组大鼠FBG、FINS 及HOMA-IR 值比较Note.A.After 30 days of intervention,there was no significant difference in FBG between the two groups.B.After 30 days of intervention,there was no significant difference in FINS between the two groups.C.After 30 days of intervention.Compared with the control group,∗∗P <0.01.Figure 3 Comparison of FBG,FINS and HOMA-IR indexs in each group of rats
2.4 对照组与PCOS-IR 组蛋白相对表达水平
Western Blot 检测子宫内膜组织IR 及PI3K/AKT 通路相关蛋白结果中,与对照组蛋白表达条带模型相比,PCOS-IR 组的IRS1、GLUT-4 条带模型明显变窄、颜色变浅,其蛋白表达水平显著降低(P<0.01),提示子宫内膜存在IR 状态。且PI3K/AKT通路相关蛋白结果中,PCOS-IR 组的AKT 条带模型变化不明显,其表达水平降低(P>0.05),PI3K 条带模型变宽、颜色变深,其蛋白表达水平显著上升(P<0.05);PI3K p110α、p-AKT 条带模型变窄、颜色变浅,PI3K p110α、p-AKT 表达水平显著降低(P<0.01),提示PI3K/AKT 胰岛素信号通路下调。图4 所示为对照组与PCOS-IR 组蛋白相对表达结果。

图4 对照组与PCOS-IR 组蛋白相对表达结果Note.A.The red mark in the model group is the PCOS-IR group,and the rest are the PCOS-non-IR group.Compared with the control group,∗P <0.05,∗∗P <0.01.Figure 4 Expression results of the control group and the PCOS-IR group
3 讨论
研究显示PCOS 患者,不管是自然怀孕或通过辅助生殖技术怀孕后,流产率达到33%~50%,是正常孕妇的3 倍[15]。且有研究表明,胰岛素抵抗可以影响下丘脑-腺垂体-卵巢轴轴,增加雄激素的水平,并影响卵子的质量,对PCOS 患者的生殖功能障碍有重要影响[16]。但是,到目前为止,胰岛素抵抗如何影响多囊卵巢综合征患者的生殖功能,目前尚缺乏研究。本课题以PCOS 大鼠子宫内膜是否存在胰岛素抵抗的实验为切入点,通过构建可靠、简便、符合临床特征的动物模型,观察多囊卵巢综合征大鼠子宫内膜中PI3K/AKT 通路相关蛋白表达异常与胰岛素抵抗的关系,以期深入PCOS 潜在病理生理改变,为寻找治疗PCOS 的作用靶点提供新思路。
PCOS 模型建立以无排卵或偶发性排卵、性激素分泌紊乱、糖脂代谢异常、胰岛素抵抗、卵巢多囊性病理改变等为主要评价指标[17]。经DHEA 处理的大鼠表现出包括高雄激素血症、月经紊乱和多囊卵巢等PCOS 表现[18-22]。然而,此种方法建立的模型不全表现胰岛素抵抗。研究表明,增加HFDs 可通过PCOS 对胰岛素相关机制的反应加剧其内分泌和代谢功能障碍从而获得IR[23-24]。另外,Zhang等[13]研究也指出,DHEA+HFDs 诱导的PCOS 的不同表型,可用于研究该综合征的生殖和代谢特征。因此,本研究在DHEA 的基础上联合HFDs 构建大鼠PCOS-IR 模型。本研究结果显示,模型组建立的动物模型更接近PCOS 临床特征,出现显著增加的体重,紊乱的动情周期,明显的卵巢多囊样改变,伴显著的糖代谢改变(FBG、FINS 及HOMA-IR 指数均升高),表现出了IR 特征。本实验对子宫内膜组织IR 相关蛋白(IRS1、GLUT-4)的表达进行了检测,发现PCOS-IR 组IRS1、GLUT-4 表达水平较对照组显著降低,说明PCOS-IR 组大鼠子宫内膜组织胰岛素抵抗状态,这与吴峰等[25]用高脂饲料建立的胰岛素抵抗大鼠模型特征基本一致,其机制可能为IRS1 丝氨酸磷酸化干扰邻近磷酸化酪氨酸结合区段,阻碍正常的酪氨酸磷酸化,影响IRS1 与胰岛素受体的相互作用并削弱IRS1 酪氨酸磷酸化作用。
在多囊卵巢综合征的研究当中,脂肪组织、卵巢组织和肝组织中被发现存在胰岛素代谢通路异常[26],而子宫内膜组织中的胰岛素代谢通路鲜有研究。因此,本实验进一步对子宫内膜组织PI3K/Akt通路相关蛋白(PI3K、PI3K p110α、p-AKT、AKT)的表达进行了检测,发现PCOS-IR 组较对照组大鼠AKT 表达水平降低,PI3K p110α、p-AKT 表达水平显著降低,说明PCOS-IR 组大鼠子宫内膜组织出现胰岛素信号通路环节异常——下调,这将揭示子宫内膜组织局部的胰岛素抵抗发生机制的可能——子宫内膜中PI3K/AKT 通路相关蛋白表达异常。
综上所述,脱氢表雄酮联合高脂饮食构建了具有特征性的多囊卵巢组织、糖代谢异常的PCOS 伴IR 大鼠,其大鼠可能存在子宫内膜局部胰岛素抵抗,其可能与子宫内膜中PI3K/AKT 通路相关蛋白表达异常有关。子宫内膜局部IR 是PCOS 潜在的病理生理改变,这为寻找治疗PCOS 的作用靶点提供了新思路,即针对多囊卵巢综合征伴胰岛素抵抗靶器官——子宫内膜,基于子宫内膜胰岛素信号调控途径的中西医干预性研究将是今后的重要方向之一。
