基于低温沉积打印技术构建分级多孔脱细胞华通胶支架
2022-12-09殷瀚吴江严子能田广招张铁元马阳王越眭翔刘舒云郭全义
殷瀚,吴江,严子能,田广招,张铁元,马阳,王越,眭翔,刘舒云,郭全义
由于不含血管、神经和淋巴,因此关节软骨的损伤修复能力极其有限,这也成为了临床科学研究和再生医学中的主要挑战[1-2]。目前,临床上对于关节软骨损伤患者的治疗方法主要包括自体骨软骨移植、同种异体骨软骨移植、自体软骨细胞移植、合成或生物支架植入(组织工程技术)、微骨折、粉碎软骨修复、生物制剂辅助治疗以及其他治疗。其中近些年发展起来的组织工程技术为关节软骨损伤的再生修复提供了新的可能。支架、种子细胞和生长因子是组织工程技术的三大要素。理想的支架材料是组织工程发展的重点[3]。
天然生物材料由于具有优良的生物相容性,细胞毒性低,因此一直备受关注。软骨细胞外基质源性的支架,其成分和比例与天然的关节软骨相近。但因其来源有限、结构致密和脱细胞处理困难,因此限制了其作为组织工程技术的进一步发展与临床应用。
人脐带是连接母体和胎儿的组织,在胎儿分娩后即作为废弃物被丢弃掉。华通胶是脐带的主要组成成分,其富含透明质酸、硫酸化糖胺多糖及胶原等成分,这些成分和天然软骨的成分相似,并且华通胶无血管、神经支配和淋巴[4-10]。同时,华通胶能够保护脐带的血管,防止脐带血管受外力挤压,避免脐带缺血。华通胶的此功能与关节软骨缓冲外力,减少变形、损伤和摩擦的作用相似。同时其属于医疗废弃物,来源广泛,不存在伦理问题。基于以上华通胶的生物学特征,其被认为是软骨组织工程支架材料的理想来源[11-13]。近年来,3D 生物打印作为新兴的技术,能够精确地制造出具有复杂结构的支架[14]。低温沉积打印技术作为 3D 生物打印技术的一种类型,具有能够打印出分级多孔支架的功能。
为了更好地控制生物墨水的可打印浓度,制备出理想形状的支架,本实验前期将人脐带华通胶脱细胞处理,随后进行冷冻干燥,之后利用低温沉积3D 生物打印技术,制造出分级多孔的脱细胞华通胶细胞外基质支架,系统评价该支架的物理化学特性、生物相容性和对干细胞成软骨分化的影响,为体内软骨修复实验提供理论依据。
1 材料与方法
1.1 材料
1.1.1 人脐带 正常足月妊娠新生儿脐带由解放军总医院妇产科提供,已获得知情同意。SD 大鼠乳鼠 5 只,重 12~18 g,许可证号:SCXK(京)2019-0010;实验方案由中国人民解放军总医院动物实验伦理委员会批准。
1.1.2 实验用细胞、试剂及仪器 大鼠骨髓间充质干细胞由解放军总医院骨科研究所提供;DMEM/F-12 培养基、胎牛血清、青霉素-链霉素双抗购自美国 Gibco 公司;0.25% 胰蛋白酶购自美国 Sigma 公司;Actin 微丝绿色荧光探针购自上海碧云天生物技术有限公司;甲苯胺蓝染色试剂盒、苦味酸-天狼猩红染色试剂盒购自北京索莱宝科技有限公司;苏木精-伊红染色(HE)液购自北京瀚海拓新生物技术有限公司;CCK-8 试剂盒购自美国Abmole 公司;多聚甲醛购自天津市光复精细化工研究所;氢氧化钠(NaOH)和冰醋酸购自天津市福晨化学试剂有限公司;引物购自上海生工生物公司;OriCell 骨髓间充质干细胞成软骨诱导分化试剂盒购自赛业公司;ReverTra Ace qPCR RT Master Mix 购自德国 Toyobo 公司。
2 × 预混实时荧光定量快速 PCR 反应体系为加拿大 GenStar 公司产品;Sunp biomaker 生物打印机为上普博源生物科技有限公司产品;冷冻干燥机为北京博医康技术有限公司产品;CO2细胞培养箱为德国 Hereus 公司产品;脱水机为德国 Leica公司产品;倒置显微镜为日本 Olympus 公司产品;扫描电子显微镜为日本 Hitachi 公司产品;Take 3酶标仪为美国 BioTek 公司产品;激光共聚焦显微镜为日本 Nikon 公司产品。
1.2 方法
1.2.1 人脐带华通胶的组织学染色 人脐带华通胶经脱水、石蜡包埋后行石蜡切片(厚度约 7 μm),切片脱蜡后,4% 多聚甲醛固定 30 min,根据试剂盒说明书行 HE 染色、甲苯胺蓝染色、番红-O 染色、天狼猩红染色。
1.2.2 脱细胞人脐带华通胶的制备 无菌条件下,去除脐带内的动静脉,剥除脐带外面的膜,可获取胶冻样组织。把获得的华通胶置于 1 mol/L NaOH 溶液中,室温条件下脱细胞处理 4 h,冰醋酸调节 pH 值至 7.0 备用。
1.2.3 人脐带华通胶脱细胞前后的比较
1.2.3.1 大体观和微观结构:观察人脐带华通胶脱细胞前后大体形态,然后经过真空喷金处理之后,在扫描电镜下观察其微观形态并采集照片。
1.2.3.2 细胞核残留情况:人脐带华通胶脱细胞前后经脱水、石蜡包埋后行石蜡切片(厚度约7 μm),切片脱蜡后,4% 多聚甲醛固定 30 min,PBS 清洗 1 次后行 DAPI 染色,PBS 清洗 2 次,置于显微镜下观察细胞核残留情况。
1.2.4 脱细胞人脐带华通胶生物墨水的制备 将制备的脱细胞人脐带华通胶放到培养皿中,-20 ℃预冻 30 min,放入冷冻干燥机中进行冻干,48 h 后得到冷冻干燥后的脱细胞华通胶,用粉碎机将其打成粉末。取一定质量的上述粉末,溶解于 1% 的乙酸中,制备出 5%(m/V)的脱细胞华通胶溶液。
1.2.5 低温沉积 3D 生物打印脱细胞华通胶支架的制备 将脱细胞华通胶溶液转移到打印机的喷头内并且保持大约 4 ℃。底部接收盘的温度为-25~-30 ℃。打印之后,将冷冻的支架进行冷冻干燥,从而形成分级多孔的脱细胞华通胶支架。将支架置于 258 nm 波长紫外线照射下交联 8 h,再于含 20 mmol/L N-羟基琥珀酰亚胺和 50 mmol/L乙基-二甲基胺-丙基碳化二亚胺的 95%(V/V)乙醇溶液中 4 ℃ 下交联 24 h。无菌 PBS 漂洗浸泡2 h,三蒸水漂洗去除残余交联剂,再次冻干,密封袋保存,60Co 照射消毒,4 ℃ 条件下保存备用[15-16]。
1.2.6 低温沉积 3D 生物打印脱细胞华通胶支架的大体观和微观结构 取打印的脱细胞华通胶支架,观察其大体形态,然后经过真空喷金处理之后,在扫描电镜下观察其微观形态并采集照片。
1.2.7 鼠骨髓间充质干细胞的分离、培养和扩增 新生 48 h SD 乳鼠 5 只,雌雄不限,无菌条件下分离股骨和胫骨,无菌 PBS 清洗 2 遍,剪碎后转移至含体积分数 10% 胎牛血清的 DMEM/F12完全培养基重悬后接种至 25 cm2培养瓶,置于37 ℃、体积分数 5% CO2恒温培养箱中培养,每3 天更换一次培养基,待细胞融合至 80%~90% 以1∶2 比例传代扩增。取第 3 代细胞进行后续实验。
1.2.8 低温沉积打印支架的细胞毒性检测 制备支架浸提液:依据国家 ISO10993-12(2019)标准,计算脱细胞华通胶支架表面积,按 1.25 cm2/ml 计算出所需培养液(含 10% 胎牛血清的 DMEM/F12培养基),将无菌脱细胞华通胶支架浸泡于上述培养液中,37 ℃ 孵育 24 h 后收集浸提液。
CCK-8 实验:将 P4 代骨髓间充质干细胞按3000 个/孔接种于 96 孔板中,每孔 100 μl,细胞贴壁后弃去原培养基,分别更换为含 10% 胎牛血清的 DMEM/F12 培养基(阴性对照组)和脱细胞华通胶支架浸提液,体积均为 100 μl。培养 1、4、7 d 后弃去旧培养基,然后每孔加入 110 μl 的含有10 μl CCK-8 试剂和单纯 DMEM/F12 培养基,置于培养箱(37 ℃,体积分数 5% CO2)中孵育 2 h,最后在 450 nm 波长处检测吸光度值。每组重复3 次,结果取平均值。
1.2.9 细胞死/活染色 将 P3 代骨髓间充质干细胞接种于低温沉积 3D 生物打印脱细胞华通胶支架上,每个支架大约接种 5 × 105个细胞,置于体积分数 5% CO2、37 ℃ 培养箱中孵育 3 d,无菌PBS 清洗 2 次,避光条件下加入细胞死/活荧光染液(含 2 μmol/L 钙黄绿素 AM 和 4 μmol/L 同二聚乙胺-1 避光孵育 10 min,PBS 再次清洗 2 次,激光共聚焦显微镜下观察细胞活性。随机选取 5 个感兴趣区域,计算细胞平均存活率,细胞存活率=活细胞/(死细胞+活细胞)× 100%。
1.2.10 骨髓间充质干细胞在支架上的骨架染色 将数量 3 × 105个 P3 代大鼠骨髓间充质干细胞接种于支架上,置于 5% CO2、37 ℃ 细胞培养箱中培养 7 d 后,PBS 洗 1 遍,加入 4% 的多聚甲醛固定 15 min,含 0.1% Triton X-100 的 PBS 清洗 3 遍,加入鬼笔环肽染料,避光孵育 30 min,PBS清洗 3 遍。加入 DAPI 染液负染细胞核 10 min,PBS 清洗3 遍,共聚焦显微镜下观察细胞骨架情况。
1.2.11 qRT-PCR 法检测成软骨分化相关基因的表达水平 将 P3 代大鼠骨髓间充质干细胞分别接种于平板和支架上,加入成软骨诱导液,成软骨诱导 14 d 后,收齐两组的细胞,用 Trizol 法提取总 RNA。使用 Prime-ScriptTMRT Reagent Kit 将RNA 反转录为 cDNA。使用 SYBR PreMix EX TAQ 进行 qRT-PCR。通过 2-△△CT方法检测细胞内的 SOX9、ACAN、COLII、COLI 的表达水平,以 GAPDH 作为内参基因。相关的引物序列见表 1。
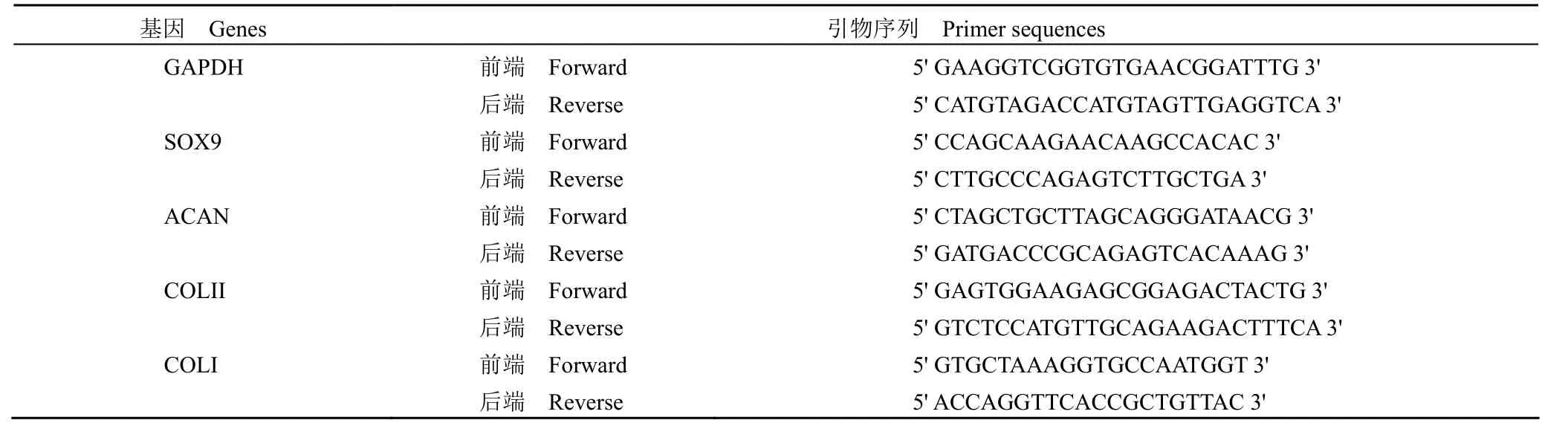
表1 qRT-PCR 的引物序列Table 1 Primer sequence for qRT-PCR
1.3 主要观察指标
人脐带华通胶的组织学染色;人脐带华通胶脱细胞前后大体观、细胞核残留情况、微观结构;低温沉积 3D 生物打印脱细胞华通胶支架大体观、微观结构,以及支架的细胞相容性及对细胞黏附的影响;支架对骨髓间充质干细胞成软骨分化的影响。
1.4 统计学处理
所有数据采用 SPSS 22.0 统计软件进行分析,定量数据用表示,应用独立样本t检验两组数据是否存在统计学差异,当P< 0.05 时表示组间差异有显著性意义。
2 结果
2.1 人脐带华通胶大体观察及组织学染色结果
图1A 显示的是人脐带和从脐带中分离的华通胶组织的大体观,可见脐带形状如绳索,表面光滑透明,由一层羊膜包被,内含结缔组织、1 根脐静脉和 2 根脐动脉。从脐带中分离的华通胶呈胶状形态,表面透明。图 1B1 为华通胶 HE 染色,可见华通胶富含细胞外基质成分;图 1B2、图 1B4分别为番红 O 和甲苯胺蓝染色,结果显示华通胶含有糖胺多糖;天狼猩红染色显示华通胶富含胶原成分(图 1B3)。天然软骨含有丰富的糖胺多糖、胶原成分等,以上结果表明华通胶在成分上与天然软骨相似。

图1 人脐带和华通胶大体观和组织学染色(A:人脐带及华通胶大体形态;B:苏木精-伊红染色、番红-O 染色、天狼猩红染色、甲苯胺蓝染色)Figure 1 Gross morphology and histomorphological evaluation of human umbilical cord and Wharton's jelly (A: Gross morphology of human umbilical cord and Wharton's jelly;B: HE staining,safranin-O staining,sirius red staining,toluidine blue staining)
2.2 华通胶脱细胞前后大体观比较
如图 2A 所示,分离出的华通胶组织呈现出白色胶冻状。经脱细胞处理后,华通胶组织大体形状基本保持不变,色泽变为透明色。
2.3 华通胶脱细胞前后 HE 染色及 DAPI 染色结果
如图 2B、图 2C 所示,华通胶脱细胞前可见大量的细胞核(蓝色荧光)。经过一系列脱细胞处理后,未见明显的细胞核结构,说明脱细胞方法行之有效。
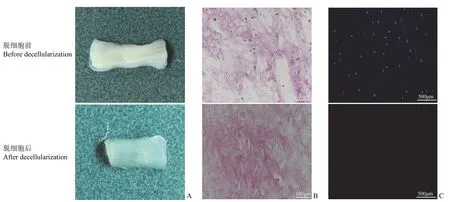
图2 人脐带华通胶脱细胞前后的大体观(A)、苏木精-伊红(B)及 DAPI 染色(C)比较Figure 2 Comparison of gross view (A)、HE staining (B) and DAPI staining (C) of Wharton's jelly before and after decellularization
2.4 华通胶脱细胞前后的微观结构变化
如图 3A 所示,通过扫描电镜观察华通胶脱细胞前的内部结构可以发现,华通胶富含大量胶原纤维,胶原纤维纵横交错排列。脱细胞后胶原纤维依然能够保持,见图 3B,说明脱细胞处理并未破坏华通胶内部的结构。

图3 扫描电镜观察华通胶脱细胞前后的微观结构(A:脱细胞前;B:脱细胞后)Figure 3 Microstructure of the Wharton's jelly before (A) and after (B) decellularization by scanning electron microscopy
2.5 低温沉积 3D 打印支架的大体观和微观结构观察
大体观可见支架纤维呈现十字交叉网格结构,纤维排列整齐均匀,如图 4A 所示。扫描电镜观察支架内部微观结构发现,打印的支架表现出分级多孔结构,并且具有均匀的大孔结构,同时观察到支架内存在大量相互连接的微孔结构,见图 4B、4C所示。
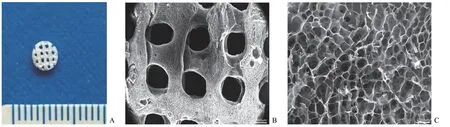
图4 低温沉积 3D 打印脱细胞华通胶支架的大体观和扫描电镜观察(A:大体观;B:扫描电镜低倍镜下支架结构;C:扫描电镜高倍镜下支架结构)Figure 4 Gross view and scanning electron microscopy of the 3D-printed scaffold by low-temperature deposition manufactureing(LDM) (A: Gross view;B: Microstructure of the 3D-printed scaffold at low magnify;C: Microstructure of the 3D-printed scaffold at high magnify)
2.6 打印支架的细胞毒性实验
CCK-8 细胞毒性实验结果显示,从支架中提取的浸提液与骨髓间充质干细胞共培养 1、4、7 d 后,实验组与对照组细胞数量明显增加,比较两组在不同时间点的吸光度值时发现两者无显著性差异(P> 0.05),见图 5,提示该支架无明显细胞毒性,具有良好的细胞相容性,为后期植入动物体内及将来的临床应用提供了有利的理论支撑。
图5 低温沉积 3D 打印支架的细胞毒性检测Figure 5 Cytotoxicity experiment of the 3D-printed scaffold by LDM
2.7 细胞活/死染色
如图 6 所示,大鼠骨髓间充质干细胞在支架上培养 7 d 后,活/死染色结果显示,支架上存在大量的活细胞(图 6A 绿色荧光),而死细胞(图 6B 红色荧光)的数量很少,表明骨髓间充质干细胞能够在支架上很好地存活,活性可达(96.0 ± 3.3)%,该支架具有良好的生物相容性。

图6 骨髓间充质干细胞-低温沉积技术打印的脱细胞华通胶支架复合物的细胞活/死染色(A:活细胞;B:死细胞;C:合并图像)Figure 6 Dead/live staining of bone marrow mesenchymal stem cell-scaffold printed by LDM complex (A: Live cells;B: Dead cells;C: Merged image)
2.8 细胞在支架上的黏附和形态观察
大鼠骨髓间充质干细胞在低温沉积 3D 打印支架上培养 7 d 后,鬼笔环肽/DAPI 染色显示如图 7,细胞核被染成蓝色荧光亮点(图 7A),绿色荧光微丝(图 7B)显示的是骨髓间充质干细胞在支架上的黏附形态,可见细胞在支架上很好地铺展开,表明低温沉积 3D 打印支架有利于骨髓间充质干细胞黏附和生长。

图7 骨髓间充质干细胞-低温沉积打印脱细胞华通胶支架复合物的肌动蛋白/DAPI 染色(A:细胞核 DAPI 染色;B:细胞骨架肌动蛋白染色;C:两种染色的合并图像)Figure 7 F-actin/DAPI staining of bone marrow mesenchymal stem cell-scaffold complex (A: DAPI staining of nucleus;B: F-actin;C: Merged image)
2.9 支架对骨髓间充质干细胞成软骨分化的影响
促进干细胞成软骨分化是软骨再生中十分重要的因素,因此本实验探究了支架对骨髓间充质干细胞成软骨分化的影响,并进行了成软骨相关基因表达的检测。如图 8 所示,与单纯在平板上培养相比,细胞在支架上培养 14 d 后,SOX9、ACAN、COLII 的表达明显高于在平板上培养的,而 COLI的表达无明显差异,上述结果表明,支架能够促进骨髓间充质干细胞的成软骨分化及胶原合成分泌。
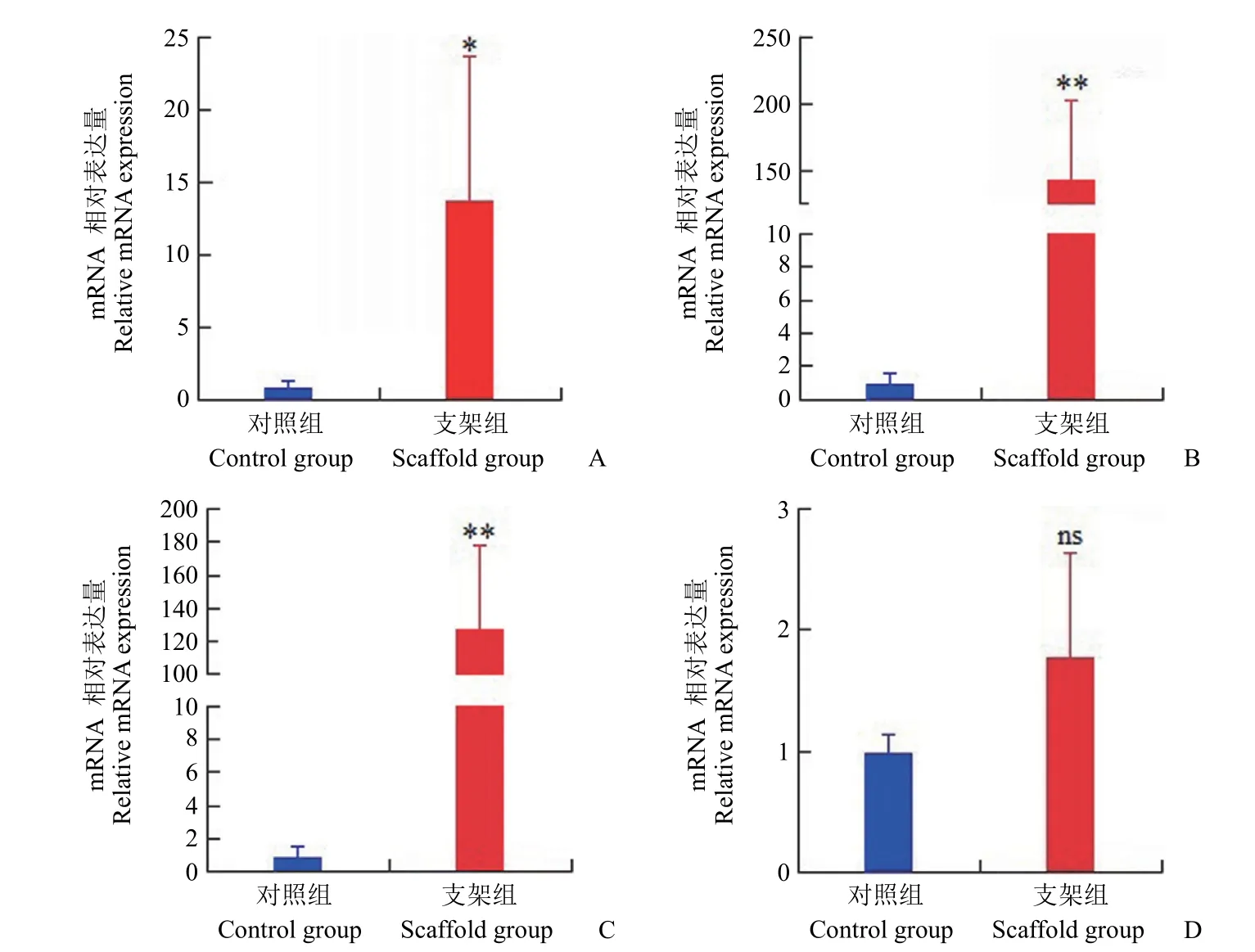
图8 骨髓间充质干细胞在支架中体外培养 14 d 的 SOX9(A)、ACAN(B)、COLII(C)、COLI(D)的 mRNA 表达水平(*P < 0.05,**P < 0.01,ns 代表没有统计学差异)Figure 8 SOX9 (A)、ACAN (B)、COLII (C)、COLI (D) mRNA expression levels of BMSCs seeded on the 3D-printed scaffolds for 14 d (*P < 0.05,**P < 0.01,ns means no significant difference)
3 讨论
关节软骨损伤的再生修复目前仍是困扰临床医生的难题之一,再生医学的迅猛发展为软骨损伤再生修复治疗提供了新的可能[17]。近年来,软骨组织工程技术的出现为软骨损伤的再生治疗提供了新的治疗方案。支架材料作为组织工程技术的三要素之一,其在组织损伤再生修复治疗过程中扮演着十分重要的角色[18-19]。制备组织工程支架的材料主要分为人工合成材料、天然生物材料。人工合成材料主要有聚羟基乙酸、聚羟基乙酸-聚乳酸复合物、聚乳酸、聚羟基丁酸酯及其共聚物等,它们虽然具有良好的物理机械性能、可控性强、可调节的微结构等优点,但其亲水性差、对细胞吸附力弱以及生物相容性不理想。天然生物材料主要有 I 型胶原、透明质酸、纤维蛋白、壳聚糖及海藻酸盐等,它们具有良好的生物相容性、易于细胞附着,但其成分与天然的关节软骨有较大差别。近年来,同种异体软骨脱细胞外基质支架被认为是理想的组织工程支架材料[20],但其来源有限,限制了其临床的推广应用。
人脐带华通胶在成分上与软骨十分相似,都富含糖胺多糖、胶原等,同时华通胶还含有许多生长因子,如转化生长因子 β、胰岛素生长因子等,并且其来源广泛,不用考虑伦理问题。本研究通过组织学染色发现,华通胶富含糖胺多糖、胶原及透明质酸,这与软骨组织成分相似。用化学试剂、冻干等方法制备脱细胞的华通胶支架,结果发现,该方法去除了大多数的细胞核 DNA,扫描电镜证实了脱细胞的华通胶依然保留了大量的胶原成分。
理想的组织工程支架应该具有能够影响细胞生物学行为的合适孔径大小和高的孔隙率[21]。3D生物打印技术能够精确地制造出具有复杂结构的支架[14]。然而,目前具有良好生物相容性的 3D 打印合成材料相对有限。常见的打印材料,如聚乳酸、聚乳酸-共乙醇酸和聚己内酯,通常需要高打印温度或有机溶剂。高温加工会破坏材料的化学结构,导致机械性能下降。此外,由于担心最终产品中的溶剂残留,有毒有机溶剂的引入可能阻碍进一步的生物医学应用。最近的研究发现,分级多孔的支架能够有利于营养交换、细胞内生长和进一步促进骨的快速生长和修复[22]。传统的 3D 打印技术(如熔融沉积)很难打印出具有分级多孔结构的支架[23-24]。然而,低温沉积技术能够克服传统 3D 打印技术的劣势,其能够制造出上述结构的支架。同时,对于天然生物材料而言,低温能够很好地保存其内部的成分。本研究通过将冻干的华通胶支架打成粉末,之后溶于乙酸中,成功制备出具有可打印性的生物墨水,结合低温沉积打印技术打印脱细胞华通胶支架,通过扫描电镜观察发现,脱细胞华通胶支架内部呈现分级多孔的结构,孔与孔之间相互紧密结合,孔的大小有利于细胞的迁移和黏附,这与文献[16]结论是一致的。本实验进一步评估了通过低温沉积技术打印的脱细胞华通胶支架的生物相容性,体外 CCK-8 细胞增殖实验发现该支架是无毒的,细胞活/死染色发现大量的细胞存活,表明打印的支架具有良好的生物相容性,能够维持细胞的活性以及利于细胞生长。细胞骨架染色显示细胞能够很好地在支架上伸展开,分布在支架的孔与孔之间,表明支架有利于细胞的黏附。同时,支架能够促进骨髓间充质干细胞的成软骨分化及胶原的合成分泌。
综上所述,通过低温沉积打印技术制造出的分级多孔脱细胞华通胶支架无细胞毒性,有利于细胞的黏附,并且能够促进骨髓间充质干细胞的成软骨分化及胶原合成分泌。同时,相比于其他类型的材料,脐带来源广泛,获取简单,表明脐带华通胶是制备软骨组织工程支架的理想材料,是一种有广泛应用前景的天然生物材料。但仍需进一步探讨比较其和同类型打印支架的优势以及体内原位软骨缺损修复的效果,完善软骨再生修复的理论。
