Ca2+/钙调蛋白依赖性蛋白激酶Ⅱ调节原肌球蛋白1对海洛因所致心肌细胞节律异常的影响
2022-12-07苏丽萍管雅玲肖锦玲蒲红伟
季 敏,苏丽萍,刘 丽,管雅玲,肖锦玲,蒲红伟
(新疆医科大学 1基础医学院病理学教研室,乌鲁木齐 830017;新疆医科大学第一附属医院 2病理科,3学科建设科,乌鲁木齐 830054)
海洛因学名二乙酰吗啡,可损害人体健康,影响社会,严重威胁着各国公共卫生安全。海洛因具有很强的生物毒性和成瘾性[1]。人体对海洛因依赖会导致其心血管系统的受损,最常见的临床表现为心律失常[2]。有研究表明,海洛因成瘾者心电图参数异常的发生率显著高于健康人群,其心律失常的发生率可达35.16%[3]。Ca2+作为心肌细胞内主要的第二信使对维持心肌细胞正常电生理功能具有重要作用。Ca2+/钙调蛋白依赖性蛋白激酶Ⅱ(Ca2+/calmodulin-dependent protein kinaseII,CaMKII)属于丝氨酸/苏氨酸蛋白激酶家族,受Ca2+/CaM复合物的调节[4],分为α、β、γ和δ四种亚型[5],在心肌细胞中主要为δ亚型[6]。CaMKII被认为是兴奋-收缩耦合过程的重要因子,可影响心肌细胞内Ca2+含量的变化,适度激活有益于心脏正常功能运行,但持续激活可能会导致心脏功能障碍[7]。原肌球蛋白1(Tropomyosin1,TPM1)是原肌球蛋白(Tropomyosin,TM)家族中的一员,是心肌收缩蛋白之一,其与肌钙蛋白根据胞质内Ca2+浓度共同调节心肌的收缩,然而心肌收缩蛋白的异常可影响心肌Ca2+的敏感性,甚至使心肌收缩功能发生异常[8-11]。本研究从海洛因及选择性CaMKII抑制剂KN-93[12]对心肌细胞内Ca2+变化及相关因子表达水平入手,探讨CaMKII、TPM1与海洛因导致心肌细胞节律频率异常间的关系,为临床中因海洛因导致的心律失常患者提供新的诊疗方向。
1 材料与方法
1.1 实验动物、试剂与仪器选取SPF级SD大鼠乳鼠60只,3日龄,雌雄不限。实验动物购自新疆医科大学实验动物中心[动物生产许可证号:SYXK(新)2018-0002;动物使用许可证号:SYXK(新)2018-0003],实验已通过新疆医科大学第一附属医院动物实验医学伦理委员会批准(IACUC201805-K1)。海洛因(由新疆维吾尔自治区缉毒总队提供);α-肌动蛋白(α-actin)抗体(ab37346)、β-tubulin抗体(ab6046)、p-CaMKIIδ(phospho T287)抗体(ab182647)均购自英国Abcam公司;Tropomyosin1/3抗体(美国Cell Signaling公司,3913S);CaMKIIδ抗体(美国Santa Cruz公司,SC-100362);胎牛血清、青链霉素、胰蛋白酶、Ⅱ型胶原酶购自美国Gibco公司;膜再生液、Fluo-4 AM钙荧光探针、D-Hanks液、4%多聚甲醛溶液购自北京Solarbio公司;5-溴-2’-脱氧尿苷(5-Brdu)(美国Sigma 公司);低温高速离心机(美国Hitiachi公司);激光共聚焦显微镜(德国Leica公司);37℃恒温培养箱(美国Themo science公司)。
1.2 原代心肌细胞分离和培养所有实验动物麻醉后在无菌条件下75%乙醇消毒,沿左锁骨中线剪开皮肤,取其心脏置于D-Hanks液中。眼科剪去除心房,将心尖分成7~8瓣,放入胰酶中,4℃摇床过夜,消化,弃上清;加入Ⅱ型胶原酶,37℃水浴震荡10 min,1000 r/min离心5 min,弃上清;加入含有5-Brdu的完全培养基,缓慢吹打混匀,移入细胞培养皿。差速贴壁后,置于37 ℃细胞培养箱备用。
1.3 免疫荧光法鉴定心肌细胞将培养好的原代心肌细胞铺至激光共聚焦皿中,置于培养箱48 h,PBS洗涤3次;4%多聚甲醛溶液室温固定30 min,PBS洗涤3次;室温封闭50 min,α-actin(1∶500)覆盖组织,4℃过夜。第二天复温后PBS洗涤3次,荧光二抗覆盖,室温避光2 h,细胞核染料染色8 min,PBS洗涤3次,置于激光共聚焦显微镜下观察细胞染色情况[13]。
1.4 实验分组与处理将培养好的原代心肌细胞分为对照组(Control组)常规条件未作任何处理;海洛因处理组(HE组)加入100 μmol/L 海洛因作用24 h[14];海洛因+KN-93组(HE+KN-93组)加入100 μmol/L海洛因+1μmol/L KN-93作用24 h。
1.5 各组心肌细胞自发搏动频率测定将密度为1×105个/mL原代心肌细胞接种于多聚赖氨酸预处理过的6孔板中,每孔液体量为2 mL,培养5~7 d。各组按照相应计量进行药物干预,每孔随机选取4个视野,同时由2名具有高级实验师资质的技术人员置于显微镜下观察,纪录1 min内细胞搏动次数,共重复4次。
1.6 Fluo-4 AM荧光探针检测细胞内Ca2+浓度取各组细胞,PBS洗涤后加入终浓度为5 μmol/L的Fluo-4 AM荧光探针,37℃孵育20 min,PBS洗涤3次,加入1 mL PBS,37℃孵育30 min。使用流式细胞仪检测各组细胞荧光强度,激发波长494 nm,发射波长516 nm,每组细胞计数共3 000个,采用刺激后平均荧光强度(mean-FITC-A)检测细胞内Ca2+浓度[15]。
1.7 串联质谱标记相对定量蛋白质组学筛选差异表达蛋白实验由上海中科新生命生物科技有限公司完成:取各组细胞,经蛋白质提取、定量、TMT标记、肽段分级后,使用液相色谱-串联质谱(LC-MS/MS)采集数据,以差异倍数≥1.2倍,P<0.05为标准,筛选出差异表达蛋白质,使用层次聚类算法对差异表达蛋白质进行聚类分析。
1.8 Western blotting法检测CaMKIIδ、p-CaMKII(T287)、TPM1蛋白表达水平收集各组细胞沉淀,RIPA裂解液提取总蛋白,BCA蛋白定量法检测蛋白浓度。蛋白上样量为40 μg,电泳后使用湿转法,转移至PVDF膜,封闭2 h,分别加入CaMKIIδ抗体(1∶200)、p-CaMKIIδ phospho T287抗体(1∶500)、Tropomyosin1/3抗体(1∶2 000)、β-tubulin抗体(1∶1 500),4℃摇床过夜。分别加入山羊抗小鼠IgG(1∶2 000)、山羊抗兔IgG(1∶2 000),室温摇床放置120 min,TBST洗膜,进行条带曝光。使用Image Lab软件测量各条带灰度值,目标蛋白与内参β-tubulin灰度值进行比较,获得目标蛋白相对表达量,并进行统计分析。

2 结果
2.1 心肌细胞的鉴定激光共聚焦显微镜下可见原代心肌细胞多为梭形或多边形,少数为圆形。其折光性强,有自发性搏动。在激光共聚焦显微镜下观察可见,细胞胞浆被α-actin特异性染色成绿色(图1-A),DAPI将细胞核染成蓝色(图1-B),证实为心肌细胞(图1-C);细胞胞浆未染色,细胞核染成蓝色,为非心肌细胞。细胞计数结果显示,心肌细胞纯度达95%以上,可用于后续实验。
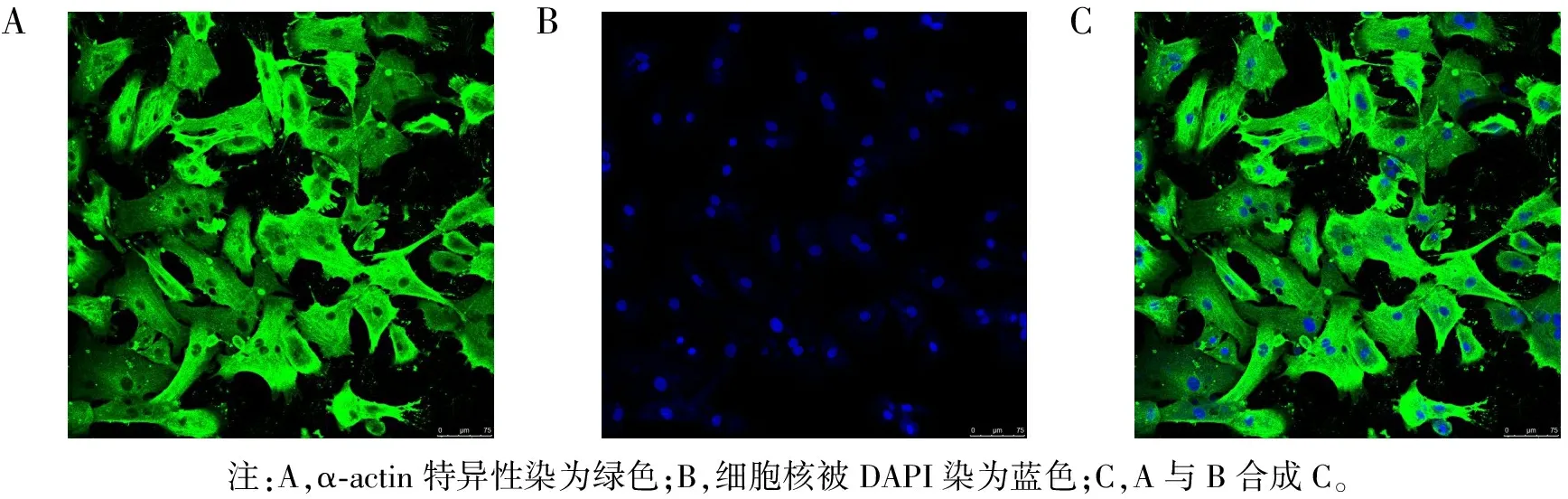
ABC注:A,α-actin特异性染为绿色;B,细胞核被DAPI染为蓝色;C,A与B合成C。
2.2 各组心肌细胞自发搏动频率的比较Control组心肌细胞平均自发搏动频率(126.33±1.52)次/min高于HE组(88.00±2.64)次/min,HE+KN-93组心肌细胞平均自发搏动频率(110.33±1.52)次/min高于HE组(88.00±2.64)次/min,差异均有统计学意义(P<0.05)。
2.3 各组心肌细胞内Ca2+浓度的比较与Control组比较,HE组心肌细胞内Ca2+浓度显著增加,差异有统计学意义(P<0.05);与HE组比较,HE+KN-93组细胞内Ca2+浓度显著下降,差异有统计学意义(P<0.05)(图2)。

ABCD 注:A,Control组流式图;B,HE组流式图;C,HE+KN-93组流式图;D,各组平均荧光强度统计图。与Control组比较,∗P<0.05;与HE组比较,#P<0.05。
2.4 各组心肌细胞内的差异表达蛋白结果串联质谱标记相对定量蛋白质组学共鉴定出5 884个差异表达蛋白;HE组与Control组共筛选出差异表达蛋白784个,其中上调差异表达蛋白质有442个,下调差异表达蛋白质有342个。HE组与HE+KN-93组共筛选出346个差异表达蛋白,其中上调差异表达蛋白质有169个,下调差异表达蛋白质有177个,前10个差异表达蛋白见表1、表2。与 Control组比较,HE组TPM1蛋白相对表达量显著升高,差异有统计学意义(P=0.000);与HE+KN-93组比较,HE组TPM1蛋白相对表达量显著降低,差异有统计学意义(P=0.043);3组CaMKIIδ蛋白质相对表达量无明显变化,差异无统计学意义(P=0.732)(表3)。
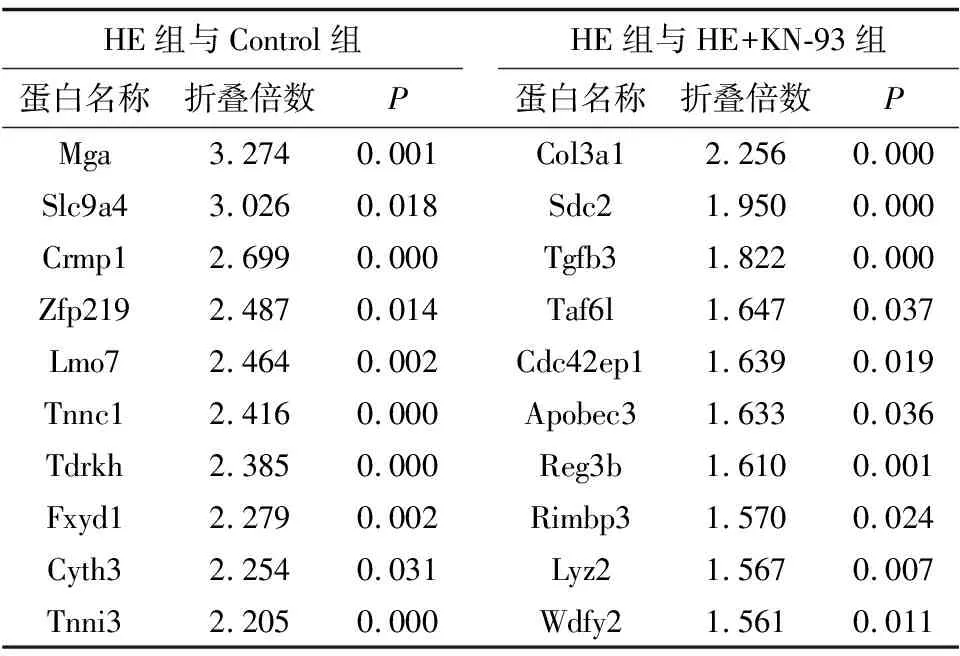
表1 各组心肌细胞前10个上调差异表达蛋白
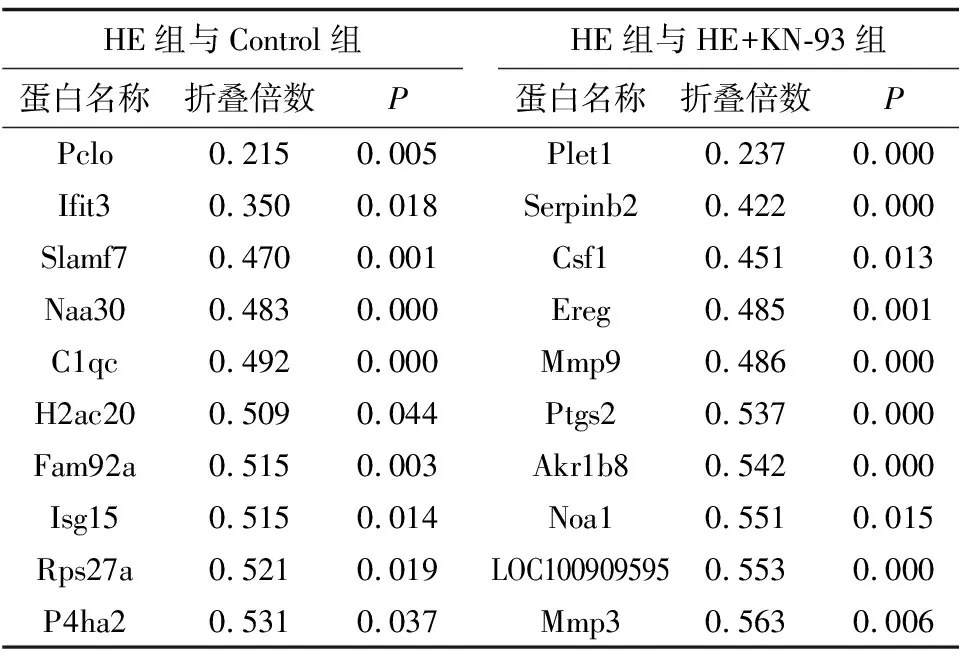
表2 各组心肌细胞前10个下调差异表达蛋白

表3 各组中CaMKIIδ与TPM1蛋白相对表达量
2.5 各组心肌细胞内CaMKIIδ、p-CaMKII(T287)和TPM1蛋白的表达与Control组比较,HE组p-CaMKII(T287)、TPM1蛋白相对表达量显著增加,差异均有统计学意义(P<0.05);与HE组比较,HE+KN-93组p-CaMKII(T287)、TPM1蛋白相对表达量降低,差异均有统计学意义(P<0.05);3组CaMKIIδ蛋白相对表达量均无统计学意义(P>0.05)(图3)。

AB 注:A,各组CaMKIIδ、p-CaMKII(T287)、TPM1的蛋白电泳图;B,各组CaMKIIδ、p-CaMKII(T287)、TPM1的蛋白相对表达量;与Control组比较,∗P<0.05;与HE组比较,#P<0.05。
3 讨论
近年来海洛因滥用对心血管损伤的作用机制已成为研究热点,有学者发现海洛因成瘾和滥用可使大鼠心电图出现不同程度的变化,可引起心肌细胞自发搏动频率的改变[16],但其具体机制有待进一步研究。心肌属于横纹肌,而肌动蛋白是心肌细胞重要的骨架蛋白,因此本研究选用α-肌动蛋白(Sarcomeric-α-actin)抗体进行免疫荧光染色鉴定心肌细胞,结果显示心肌细胞纯度达95%以上,可用于后续实验。通过检测海洛因及CaMKII抑制剂KN-93对心肌细胞内Ca2+变化及相关蛋白表达水平,分析探讨CaMKII、TPM1与海洛因导致心肌细胞频率异常的相关性。实验结果发现,HE组心肌细胞自发搏动频率下降,心肌细胞胞质内Ca2+浓度升高,这提示海洛因在一定程度上可造成心肌细胞内Ca2+异常改变,进而诱发心肌细胞节律异常改变。Ca2+是心肌细胞内重要的第二信使,可调节多种信号传导通路。CaMKII对正常的Ca2+稳态至关重要[7]。有研究结果显示,与正常对照组大鼠心肌组织相比,代谢综合征模型大鼠心肌细胞CaMKII T287位点表达水平显著上调,导致舒张期肌质网Ca2+异常泄露,增加心律失常发生频率[17]。本研究中,HE组心肌细胞中CaMKII(T287)表达水平与胞质内Ca2+浓度均显著高于Control组。通过串联质谱标记相对定量蛋白质组学技术对3组细胞研究发现,海洛因可影响心肌细胞Cardiac muscle contraction信号通路(rno04260)中TPM1、慢肌肌钙蛋白 C(TNNC1)、心肌肌钙蛋白I(TNNI3)、心肌肌钙蛋白T(TNNT2)、组氨酸丰富钙结合蛋白(HRC)等蛋白质的改变,而并不影响心肌细胞内CaMKII蛋白表达,但通过Western blotting检测发现,海洛因可影响CaMKII(T287)表达水平,这与Zhao[12]等研究结果一致。通过进一步研究发现,海洛因可上调心肌细胞内CaMKII(T287)表达水平及TPM1蛋白表达水平,而使用CaMKII特异性抑制剂KN-93抑制CaMKII(T287)磷酸化后,TPM1蛋白相对表达量降低。研究者发现,TPM突变可引起心律失常,其机制可能与肌丝对Ca2+浓度的敏感性发生改变有关,正常生理条件下TPM可将信号从肌动蛋白单体传递至肌动蛋白丝内其他肌动蛋白单体,通过结合肌动蛋白表面不同位点,精确调节激活的肌动蛋白单体数量,引起肌肉收缩[18]。CaMKII与TPM1的作用可能由胞质内Ca2+介导而产生。
综上所述,海洛因可在一定程度上引起心肌细胞节律及Ca2+浓度的异常,可能是通过激活CaMKII蛋白,调节下游因子TPM1的表达,诱发心律失常,可为研究CaMKII参与海洛因致心律失常的作用机制和因海洛因致心律失常患者探寻新的药物靶点提供理论依据。
