涝渍胁迫对土壤无机氮及氨氧化微生物的短期效应
2022-12-07邱虎森刘杰云甄博牛庆林李会贞周新国王钰
邱虎森,刘杰云*,甄博,牛庆林,李会贞,周新国,王钰
涝渍胁迫对土壤无机氮及氨氧化微生物的短期效应
邱虎森1,刘杰云1*,甄博2,牛庆林2,李会贞2,周新国2,王钰1
(1.宿州学院 环境与测绘工程学院,安徽 宿州 234100;2.中国农业科学院 农田灌溉研究所,河南 新乡 453002)
【目的】明确涝渍排水过程对小麦花期根际与非根际土壤无机氮分配及氨氧化微生物的影响。【方法】在小麦花期进行涝渍胁迫试验,涝胁迫历时分别设置0、3、5 d;降渍胁迫历时设2 d,并在规定的降渍时间内将地下水位降到60 cm以下。【结果】通过对比涝胁迫结束、渍胁迫结束和渍后恢复2 d土壤无机氮量及参与氨氧化功能微生物拷贝数发现,与对照(CK)相比,涝胁迫时间的延长促进小麦根际与非根际土壤铵态氮的积累;涝胁迫降低根际与非根际土壤硝态氮量(<0.05)。与CK相比,涝胁迫5 d显著降低根际土壤氨氧化古菌(AOA-)基因拷贝数,并限制了渍胁迫及渍后恢复过程中氨氧化古菌生物量的恢复。与CK相比,涝胁迫处理显著提高根际土壤氨氧化细菌(AOB-)基因拷贝数,却在渍胁迫及渍后恢复过程中显著降低AOB-基因拷贝数(<0.05)。冗余分析发现,在非根际土壤中,铵态氮和pH值显著影响氨氧化微生物群落(<0.05)。逐步回归模型分析发现(<0.05),在涝渍胁迫及渍后恢复过程中,非根际土壤铵态氮和硝态氮均受氨氧化古菌的调控。但是,根际土壤含水率的降低不利于铵态氮的积累,却提高了硝态氮量。有效磷量的升高促进根际土壤铵态氮量的积累。【结论】短时间涝胁迫结束后,土壤无机氮量能很快恢复,追加磷肥可能有利于提高根际土壤可利用无机氮量。
涝渍胁迫;铵态氮;硝态氮;氨氧化作用
0 引言
【研究意义】氮素作为影响作物生长及产量的必须大量元素,其形态和有效性受到环境和生物因子共同作用。其中土壤水分则通过影响土壤通气性、底物扩散、关键功能微生物种群结构等进而影响土壤氮素的转化[1]。适当的土壤含水量有利于土壤氮素的迁移和转化,提高氮素有效性。而水分过高或过低都可能会引起不同形态氮素含量及生态系统负面效应[2-3]。因此,研究氮素形态对水分变化的响应特征对于评估土壤氮素有效性具有重要意义。【研究进展】江汉平原作为湖北省小麦主产区之一,由于受气候和地理环境因素的影响,长期涝渍成为影响当地冬小麦稳产和高产的限制因子[4-5]。长期涝渍不仅影响小麦正常的生理生化过程,同时也会通过改变无机氮的形态和迁移过程影响小麦对氮素的吸收。譬如,长期淹水会将硝态氮淋洗冲刷到土壤深层,无法被作物吸收利用。另外,淹水条件下反硝化作用将硝态氮转化为不能被作物利用的氮气或氮氧化物,导致作物因缺氮而减产[6]。目前,排出地下水是减轻或者避免小麦减产的重要工程手段[5,7]。但是,排水方式的差异会对耕层土壤氮素形态及含量产生不同影响。自然地下排水会加速耕层土壤无机氮的流失[8];而控制性排水可以促进土壤有机质分解转化,提高耕层土壤无机氮量[9]。那么,涝渍过程中耕层土壤无机氮的时间变化特征及其机理如何仍需探究。
硝化作用是连接固氮作用和反硝化作用过程的中间环节,决定着氮素对植物的有效性,也是土壤氮素循环的关键环节。氨氧化微生物(氨氧化古菌-AOA和氨氧化细菌-AOB)可通过编码氨单加氧酶的基因(如基因)实现对铵态氮的氧化过程[10]。而养分的有效性、土壤微环境(如:通气性、电导率、pH值等)均会影响参与硝化作用的氨氧化微生物的数量、群落结构及活性。在酸性或养分含量低的环境中,AOA占主导地位;相反,在中性、碱性或富氮环境中,AOB成为氨氧化作用的主要承担者[11-13]。那么,涝渍排水过程中氨氧化微生物数量如何变化仍需探究。根际土壤作为作物与土壤环境之间物质和能量交换剧烈的区域,其土壤微环境受作物和环境因素的双重调控,与非根际土壤环境存在差异[14]。在发生涝渍胁迫时,作物会通过调节自身的生理生化功能抵御外界环境的改变以维持自身的活力,作物的生理生化过程的改变可能会影响从根系释放出来的有机和无机物质形态和含量,以及根系的形态和分布[15-16],这些变化无疑会影响根际土壤微环境和微生物活性及数量,进而影响到微生物对土壤氮素的调控[17-19]。【切入点】在涝渍胁迫及恢复过程中,根际和非根际土壤与参与氨氧化微生物对涝渍胁迫的响应过程有待深入研究。【拟解决的关键问题】基于以上问题,本研究系统对比了在涝渍相随及恢复阶段小麦花期根际与非根际土壤无机氮及参与氨氧化微生物的变化和差异,通过构建无机氮、土壤理化因子及微生物关系,明晰根际与非根际土壤影响无机氮的关键因子。
1 材料与方法
1.1 研究区及试验地概况
试验在长江大学科研基地内的有底混凝土测坑(1 m深)中开展,小区面积为1.5×1.5 m。研究基地地处江汉平原,属于亚热带季风湿润区,年平均气温16.5 ℃,年平均降水约为1 100 mm,其中4—8月降雨约占全年降雨量的70%。受地质地貌条件、本区特殊气象和水文变化以及区域农业经营活动的盲目性导致该区易发生涝渍灾害[20]。测坑中耕层土壤基本理化性质如表1所示。

表1 土壤基本理化性质
1.2 试验设计
在小麦开花期进行不同程度的涝渍胁迫试验。在涝胁迫期间控制淹水深度为5 cm,涝胁迫历时分别设置3、5 d;降渍胁迫历时设2 d,并在规定的降渍时间内将地下水位降到60 cm 以下。试验采用完全随机设计,每个处理设置3次重复,同时设置对照(CK)不做水分处理。为保证采样时间的一致性,淹水5 d处理比淹水3 d处理提前2 d开始淹水。整个试验期间,在测坑的上方设置透明防雨棚防止降雨的影响,在非降雨期收起防雨棚。小麦供试品种为郑麦9023,整个生育期纯氮施肥量为240 kg/hm2、纯磷为120 kg/hm2、纯钾为120 kg/hm2,其中磷肥、钾肥和60%氮肥作为基肥,40%氮肥作为拔节孕穗肥。
1.3 样品采集与测定
在涝胁迫结束后0 d(0),渍胁迫结束后0 d(2),以及渍后恢复2 d(4),采集0~20 cm小麦根际与非根际土样。每个测坑均按照五点取样法,采集非根际和根际土样。其中根际土样采用抖落法,非根际土样用土钻采集。分别将根际与非根际土样混合均匀,去除土壤中可见动植物残体,然后按照四分法取一部分经过液氮速冻处理后,保存在-80 ℃冰箱,用于AOA-和AOB-基因定量PCR分析。一部分新鲜土样用于测定土壤水分、铵态氮和硝态氮量,剩余土样风干测定相关理化指标。采用Fast DNA®SPIN试剂盒(Qbiogene Inc.,USA)提取土壤总DNA,DNA浓度和纯度利用NanoDrop2 000进行检测,利用1%琼脂糖凝胶电泳检测DNA提取质量[21]。相关功能基因实时定量PCR扩增引物如表2所示。扩增体系均为20 μL,16.5 μL 2×ChamQ SYBR Color qPCR Master Mix,0.8 μL引物F(5 μmol/L),0.8 μL引物R(5 μmol/L);2 μL DNA模板。其中AOA、AOB的基因扩增条件为:95 ℃预变性3 min,95 ℃变性5 s,55 ℃退火30 s,72 ℃延伸1 min,40个循环(ABI 7300型荧光定量PCR仪)。

表2 功能基因引物
基于土壤农化分析方法[22],称取新鲜土样,按照水土比5∶1,采用2 mol/L KCl浸提,连续流动分析仪(Tecator FIA Star 5 000 Analyzer,Foss Tecator,Sweden)测定铵态氮和硝态氮量。有效磷采用碳酸氢钠浸提-钼锑抗比色法。速效钾采用醋酸铵浸提-火焰光度计法。土壤含水率采用105 ℃烘干称质量法测定。土壤pH值按照水土比2.5∶1混匀静置30 min后Metro-pH320计测定上清液。土壤电导率按照水土比5∶1震荡3 min,静置澄清后取上清液,用雷磁DDSJ-308A型电导仪测定。
1.4 数据分析
数据统计在Excel 2007中完成。基于SPSS 16.0单因素方差分析及配对检验研究处理间或同一处理根际与非根际间土壤理化性质、氨氧化微生物基因拷贝数等的差异。基于Canoco 4.5中的冗余分析研究根际或非根际土壤理化性质与氨氧化功能微生物之间的关系;基于SPSS 16.0逐步回归分析研究无机氮与环境因子及氨氧化功能微生物丰度的关系,基于Origin 8.5作图。
2 结果与分析
2.1 涝渍胁迫对土壤理化指标的影响
图1为涝渍胁迫后各处理土壤理化指标,图1中CK,3和5分别代表对照、涝胁迫3 d和5 d处理;0、2、4分别代表在涝胁迫结束后0 d、渍胁迫结束后0 d和渍后恢复2 d;红色小写字母代表同一时间不同处理间差异,黑色字母代表同一处理不同时间的差异,下同。由图1可知,与CK相比,涝胁迫显著提高根际与非根际土壤含水率(<0.05)。渍胁迫结束后,胁迫处理小麦根际土壤含水率显著高于CK(<0.05)。涝渍胁迫及恢复过程对小麦根际与非根际土壤pH值无影响。与非根际土壤相比,涝渍胁迫及恢复过程显著提高根际土壤电导率(<0.05)。与CK相比,涝胁迫显著提高根际土壤速效磷量(<0.05),却降低了根际土壤速效钾量。与CK相比,在渍后恢复2 d后,非根际土壤速效磷量显著降低(<0.05)。
涝胁迫时间的延长有利于小麦根际与非根际土壤铵态氮的积累,且涝胁迫5 d处理显著高于CK(<0.05)。降渍结束后,处理间小麦根际土壤铵态氮量无差异,胁迫处理的非根际土壤铵态氮量显著低于CK(<0.05)。与CK相比,涝胁迫显著降低根际与非根际土壤硝态氮量(<0.05),但随着降渍结束与渍后恢复,涝胁迫处理根际与非根际土壤硝态氮量均出现不同程度的升高。
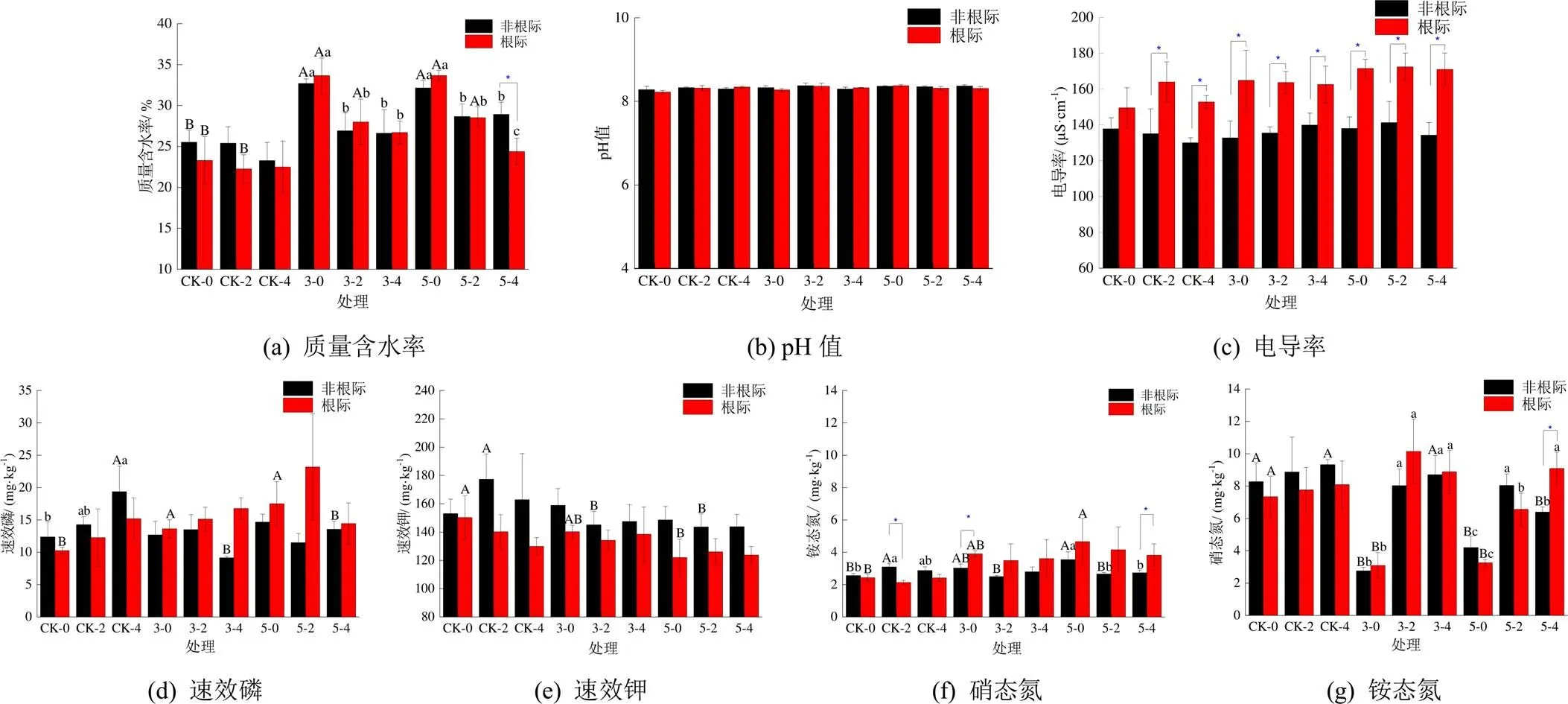
图1 土壤理化指标的变化特征
2.2 土壤氨氧化功能微生物变化特征
如图2所示,与CK相比,涝胁迫显著降低非根际土壤AOA-基因拷贝数(<0.05)。在渍后恢复2 d后,小麦根际土壤AOA-基因拷贝数显著高于非根际土壤(<0.05);涝胁迫5 d处理中,小麦根际与非根际土壤各时期AOA-基因拷贝数显著低于其他处理(<0.05)。说明涝胁迫时间的延长不利于土壤AOB-基因细菌生物量的恢复。除CK-0,其余各处理各时间点,根际土壤AOB-基因拷贝数均显著高于非根际土壤(<0.05)。
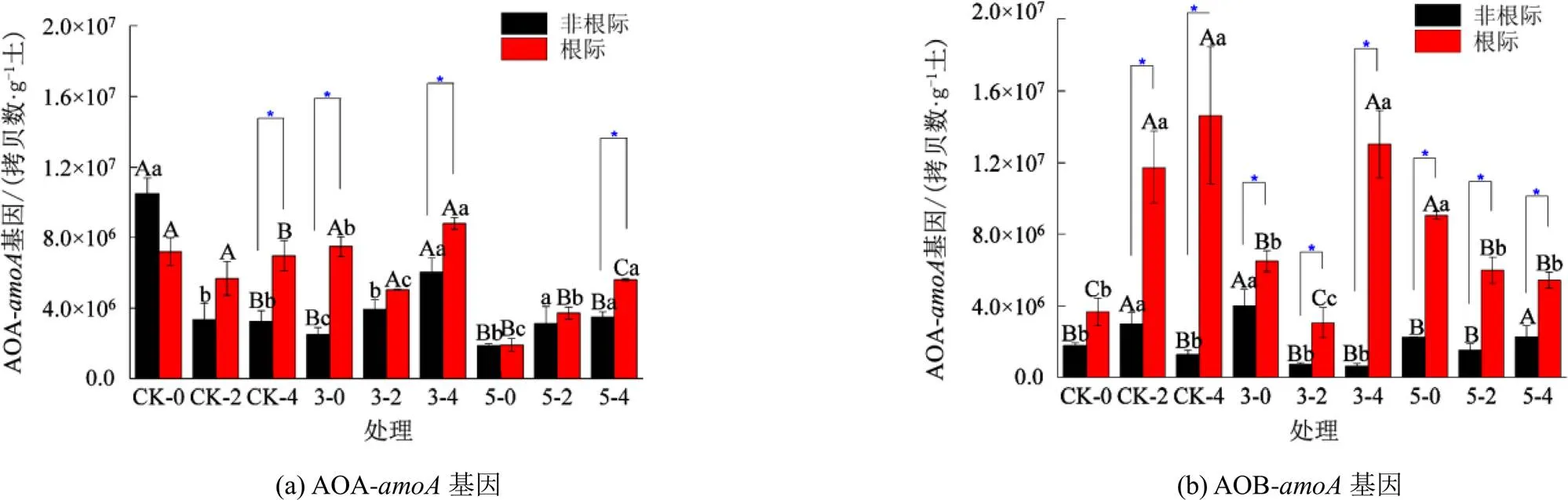
图2 氨氧化微生物的amoA基因拷贝数
2.3 无机氮、氨氧化微生物及环境因子的关系
冗余分析发现(图3),铵态氮和pH值是影响参与非根际土壤氨氧化微生物组成的关键环境因子(<0.05),环境因子对参与非根际土壤氨氧化微生物的解释率为57.3%;在根际土壤中,所选土壤环境因子并未对氨氧化微生物产生显著影响,解释率仅有27.9%。

图3 环境因子对非根际与根际氨氧化微生物的影响
基于逐步回归模型(表3),在非根际土壤中铵态氮量与AOA基因拷贝数呈显著负相关(<0.01);硝态氮量与土壤含水率(<0.01)及AOB基因拷贝数(<0.05)显著负相关,与电导率显著正相关(<0.05)。在根际土壤中铵态氮量与土壤含水率(<0.01)及有效磷量(<0.05)显著正相关。硝态氮量与土壤含水率显著负相关(<0.01)。

表3 根际与非根际土壤无机氮与环境因子及功能微生物的回归模型
3 讨论
3.1 涝渍胁迫对非根际与根际土壤无机氮的影响
涝胁迫时间的延长有利于小麦根际与非根际土壤铵态氮的积累,且涝胁迫5 d处理显著高于CK(<0.05)。降渍结束后,处理间小麦根际土壤铵态氮量无差异,胁迫处理的非根际土壤铵态氮量显著低于CK(<0.05)。涝胁迫的延长会加速土壤氧气消耗,进而削弱硝化作用,为铵态氮的积累创造条件[23];同时削弱微生物对氨的同化作用,促进铵态氮的释放[11]。而当降渍和恢复后,土壤通气量增加,将促进硝化过程的进行,在不同程度上降低铵态氮量[24]。与CK相比,在整个涝渍胁迫及渍后恢复过程中,根际土壤铵态氮量高于非根际土壤,尤其是在涝胁迫3 d和涝胁迫5 d及渍后恢复2 d,这种差异更为明显(图1)。说明根际与非根际土壤氨态氮量所受的调控因子存在差异。这种差异可能是由于土壤水分过饱和引起的土壤理化因子和生物因子的改变造成的对铵态氮量影响的改变。基于逐步回归分析(表3),在非根际土壤中AOA基因拷贝数的升高抑制铵态氮的积累调控,可能是由于更多的铵态氮被氧化参与硝化过程,从而导致土壤铵态氮量降低。而在根际土壤中有效磷和水分的升高有利于铵态氮的积累磷作为微生物生长繁殖的必须元素,其含量的高低可能会通过影响参与有机氮矿化及硝化作用功能微生物的数量[23,25],进而影响微生物对土壤铵态氮的周转及含量。而土壤含水率影响根系活力和根区微生物活性受厌氧胁迫的程度,进而影响根系对氮素的吸收以及微生物在土壤铵态氮转化和积累的贡献[26-27]。
与CK相比,涝胁迫显著降低根际与非根际土壤硝态氮量。主要是由于土壤含水率升高加速硝态氮的反硝化过程。随着渍胁迫和恢复过程的结束,土壤水分的降低提高了土壤通气性,进而促进了氨氧化过程和硝化过程,有利于硝态氮的积累,从而使根际与非根际土壤硝态氮量逐渐恢复到CK水平。另外,在渍胁迫和恢复过程中,土壤环境仍可能存在厌氧区,土壤中二价铁离子可直接替代厌氧氨氧化反应电子受体来实现电子的传递,促进厌氧氨氧化反应进程,从而加速铵态氮向硝态氮的转化[28]。逐步回归模型发现(表3),在根际与非根际土壤中硝态氮量与土壤含水率均呈显著负相关,主要是由于土壤含水率的降低有利于改善土壤通气性降低土壤硝态氮的还原速度,有利于硝态氮的积累[29]。与蔡久茂等[30]的研究结果相似,在非根际土壤中电导率与硝态氮量呈正比,可能是由于电导率的升高意味着土壤浸出液中各种阳离子的增加,为硝酸根离子提供更多的吸附位点,从而促进硝态氮的积累。AOB-基因拷贝数与硝态氮量呈反比,可能是由于氨氧化细菌数量的增加可能会增加其对铵态氮的同化过程,导致氨氧化过程的削弱和亚硝态氮量的减少,从而限制硝态氮的形成。
3.2 涝渍胁迫对氨氧化微生物的影响
本研究发现,与CK相比,涝胁迫时间的延长显著降低根际土壤AOA-基因拷贝数(<0.05),并降低其与非根际土壤的差异(图2),说明涝胁迫时间过长不利于AOA-的生长,该结果可能与涝胁迫时间的延长会加速微生物对土壤氧气与营养物质的消耗有关[21]。涝渍胁迫及恢复对土壤AOB-基因拷贝数影响各异,但除CK-0,其余各处理各时间点,根际土壤AOB-基因拷贝数均显著高于非根际土壤(<0.05)。说明涝胁迫时间的长短并未影响根际土壤氨氧化细菌的优势,这可能由于根际分泌物及根际通气性能在短时间内弥补了由于涝渍带来的养分流失和氧气消耗。在低氮及酸性环境中,AOA功能菌群是土壤硝化过程的驱动者,而高氮和中性或碱性环境中,AOB功能菌群是硝化作用的驱动者[11]。说明可利用土壤含氮量及土壤酸碱性影响氨氧化微生物功能群。另外,微生物在利用硝态氮作为同化物质时,其消耗的能量远大于利用铵态氮消耗的能量,因此,微生物对铵态氮的选择利用性成为限制硝化功能菌群的重要原因[27]。本研究基于冗余分析结果发现,只有在非根际土壤参与氨氧化微生物组成受铵态氮量和pH值的显著影响。可能是由于涝渍胁迫及恢复促进了根系对氮素的吸收过程引起氮素从非根际土壤向根际土壤迁移,保证了根际铵态氮量;另外,根系分泌物可能通过调节氮素形态和含量及土壤酸碱性稳定土壤氨氧化微生物群落组成。
4 结论
1)涝渍胁迫有利于小麦根际土壤铵态氮的积累,但加速了土壤根际与非根际硝态氮的损失
2)涝渍胁迫及恢复过程中,有效磷量的升高促进了小麦根际土壤铵态氮积累。
3)非根际土壤中,铵态氮成为调控土壤氨氧化功能微生物群落结构的显著因子;氨氧化古菌影响铵态氮量,氨氧化细菌对硝态氮的影响显著;根际土壤中氨氧化微生物对无机氮的影响不明显。
[1] 但小倩, 陈招兄, 程谊, 等. 红壤氮转化对土壤水分变化的响应[J]. 浙江农林大学学报, 2021, 38(5): 896-905.
DAN Xiaoqian, CHEN Zhaoxiong, CHENG Yi, et al. Response of nitrogen transformations to moisture changing in red soil[J]. Journal of Zhejiang A & F University, 2021, 38(5): 896-905.
[2] 吴现兵, 白美健, 李益农, 等. 水肥耦合对膜下滴灌甘蓝根系生长和土壤水氮分布的影响[J]. 农业工程学报, 2019, 35(17): 110-119.
WU Xianbing, BAI Meijian, LI Yinong, et al. Effect of water and fertilizer coupling on root growth, soil water and nitrogen distribution of cabbage with drip irrigation under mulch[J]. Transactions of the Chinese Society of Agricultural Engineering, 2019, 35(17): 110-119.
[3] 王瑾瑜, 程文龙, 槐圣昌, 等. 深翻、有机无机肥配施对稻田水分渗漏和氮素淋溶的影响[J]. 中国农业科学, 2021, 54(20): 4 385-4 395.
WANG Jinyu, CHENG Wenlong, HUAI Shengchang, et al. Effects of deep plowing and organic-inorganic fertilization on soil water and nitrogen leaching in rice field[J]. Scientia Agricultura Sinica, 2021, 54(20): 4 385-4 395.
[4] SAN Celedonio R P, ABELEDO L G, MIRALLES D J. Identifying the critical period for waterlogging on yield and its components in wheat and barley[J]. Plant and Soil, 2014, 378(1/2): 265-277.
[5] 吴启侠, 朱建强, 程伦国, 等. 基于地下水埋深的江汉平原冬小麦防涝渍排水指标确定[J]. 农业工程学报, 2017, 33(3): 121-127.
WU Qixia, ZHU Jianqiang, CHENG Lunguo, et al. Determination of groundwater depth-based drainage index against waterlogging and submergence for winter wheat in Jianghan Plain[J]. Transactions of the Chinese Society of Agricultural Engineering, 2017, 33(3): 121-127.
[6] 崔荣阳, 雷宝坤, 张丹, 等. 浅层地下水升降对菜地土壤剖面硝化/反硝化微生物丰度的影响[J]. 环境科学学报, 2019, 39(9): 3 099-3 106.
CUI Rongyang, LEI Baokun, ZHANG Dan, et al. Effects of shallow groundwater fluctuations on the abundances of nitrification and denitrification microbes in the soil profile of vegetable field[J]. Acta Scientiae Circumstantiae, 2019, 39(9): 3 099-3 106.
[7] 吴启侠, 朱建强, 杨威, 等. 小麦对渍涝的响应及排水指标确定[J]. 农业工程学报, 2014, 30(16): 91-98.
WU Qixia, ZHU Jianqiang, YANG Wei, et al. Response of wheat to waterlogging and determination of drainage index[J]. Transactions of the Chinese Society of Agricultural Engineering, 2014, 30(16): 91-98.
[8] WESSTRÖM I, MESSING I. Effects of controlled drainage on N and P losses and N dynamics in a loamy sand with spring crops[J]. Agricultural Water Management, 2007, 87(3): 229-240.
[9] 侯毛毛, 陈竞楠, 杨祁, 等. 暗管排水和有机肥施用下滨海设施土壤氮素行为特征[J]. 农业机械学报, 2019, 50(11): 259-266.
HOU Maomao, CHEN Jingnan, YANG Qi, et al. Behavior of coastal greenhouse soil nitrogen as influenced by subsurface drainage and organic fertilizer[J]. Transactions of the Chinese Society for Agricultural Machinery, 2019, 50(11): 259-266.
[10] 安丽荣, 卞文新, 刘宝华, 等. 环境胁迫对氨氧化菌群的影响研究进展[J]. 应用与环境生物学报, 2021, 27(3): 808-815.
AN Lirong, BIAN Wenxin, LIU Baohua, et al. Advances in the effects of environmental stress on ammonia-oxidizing communities[J]. Chinese Journal of Applied and Environmental Biology, 2021, 27(3): 808-815.
[11] PAJARES Silvia, BOHANNAN Brendan J M. Ecology of nitrogen fixing, nitrifying, and denitrifying microorganisms in tropical forest soils[J]. Frontiers in Microbiology, 2016(7): 1 045.
[12] JU X T, ZHANG C. Nitrogen cycling and environmental impacts in upland agricultural soils in North China: A review[J]. Journal of Integrative Agriculture, 2017, 16(12): 2 848-2 862.
[13] KUYPERS M M M, MARCHANT H K, KARTAL B. The microbial nitrogen-cycling network[J]. Nature Reviews Microbiology, 2018, 16(5): 263-276.
[14] KUZYAKOV Y, RAZAVI B S. Rhizosphere size and shape: Temporal dynamics and spatial stationarity[J]. Soil Biology and Biochemistry, 2019, 135: 343-360.
[15] WU X L, TANG Y L, LI C S, et al. Individual and combined effects of soil waterlogging and compaction on physiological characteristics of wheat in southwestern China[J]. Field Crops Research, 2018, 215: 163-172.
[16] YAMAUCHI T, COLMER T D, PEDERSEN O, et al. Regulation of root traits for internal aeration and tolerance to soil waterlogging-flooding stress[J]. Plant Physiology, 2017, 176(2): 1 118-1 130.
[17] FISK L M, BARTON L, JONES D L, et al. Root exudate carbon mitigates nitrogen loss in a semi-arid soil[J]. Soil Biology and Biochemistry, 2015, 88: 380-389.
[18] PÉREZ-JARAMILLO J E, MENDES R, RAAIJMAKERS J M. Impact of plant domestication on rhizosphere microbiome assembly and functions[J]. Plant Molecular Biology, 2016, 90(6): 635-644.
[19] ZHOU S M, ZHANG M, ZHANG K K, et al. Effects of reduced nitrogen and suitable soil moisture on wheat (L.) rhizosphere soil microbiological, biochemical properties and yield in the Huanghuai Plain, China[J]. Journal of Integrative Agriculture, 2020, 19(1): 234-250.
[20] 刘章勇, 刘百韬, 李必华, 等. 江汉平原涝渍地的成因、演替与分异规律研究[J]. 农业现代化研究, 2003, 24(1): 24-28.
LIU Zhangyong, LIU Baitao, LI Bihua, et al. Forming reason, succession and variation regularity of waterlogging land in Jianhan plain[J]. Research of Agricultural Modernization, 2003, 24(1): 24-28.
[21] LEVY-BOOTH D J, PRESCOTT C E, GRAYSTON S J. Microbial functional genes involved in nitrogen fixation, nitrification and denitrification in forest ecosystems[J]. Soil Biology and Biochemistry, 2014, 75: 11-25.
[22] 鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社, 2000.
BAO Shidan. Soil and Agricultural Chemistry Analysis[M]. Beijing: Chinese Agriculture Press, 2000.
[23] 秦红灵, 陈安磊, 盛荣, 等. 稻田生态系统氧化亚氮(N2O)排放微生物调控机制研究进展及展望[J]. 农业现代化研究, 2018, 39(6): 922-929.
QIN Hongling, CHEN Anlei, SHENG Rong, et al. A review on the microbial regulation mechanism of N2O production and emission of rice paddy ecosystems[J]. Research of Agricultural Modernization, 2018, 39(6): 922-929.
[24] 贺纪正, 张丽梅. 土壤氮素转化的关键微生物过程及机制[J]. 微生物学通报, 2013, 40(1): 98-108.
HE Jizheng, ZHANG Limei. Key processes and microbial mechanisms of soil nitrogen transformation[J]. Microbiology China, 2013, 40(1): 98-108.
[25] 杨亚东, 宋润科, 马俊永, 等. 长期氮磷不同施用量对土壤细菌、硝化与反硝化微生物数量的影响[J]. 中国农业大学学报, 2018, 23(9): 81-88.
YANG Yadong, SONG Runke, MA Junyong, et al. Effects of long-term different N and P fertilization rates on the abundance of bacteria nitrifying and denitrifying microorganisms in soil[J]. Journal of China Agricultural University, 2018, 23(9): 81-88.
[26] 宋海星, 李生秀. 根系的吸收作用及土壤水分对硝态氮、铵态氮分布的影响[J]. 中国农业科学, 2005, 38(1): 96-101.
SONG Haixing, LI Shengxiu. Effects of root uptake function and soil water on NO3--N and NH4+-N distribution[J]. Scientia Agricultura Sinica, 2005, 38(1): 96-101.
[27] GONZALEZ-DUGO V, DURAND J L, GASTAL F. Water deficit and nitrogen nutrition of crops. A review[J]. Agronomy for Sustainable Development, 2010, 30(3): 529-544.
[28] 谢丽, 何莹莹, 陆熙, 等. 铁对厌氧氨氧化过程及其微生物群落的影响[J]. 同济大学学报(自然科学版), 2020, 48(8): 1 169-1 178.
XIE Li, HE Yingying, LU Xi, et al. Effect of iron on anammox process and microbial community: A review[J]. Journal of Tongji University (Natural Science), 2020, 48(8): 1 169-1 178.
[29] HUANG P, ZHANG J B, ZHU A N, et al. Nitrate accumulation and leaching potential reduced by coupled water and nitrogen management in the Huang-Huai-Hai Plain[J]. Science of the Total Environment, 2018, 610/611: 1 020-1 028.
[30] 蔡九茂, 刘杰云, 邱虎森, 等. 滴灌方式和生物质炭对温室土壤矿质态氮及其微生物调控的影响[J]. 环境科学, 2020, 41(8): 3 836-3 845.
CAI Jiumao, LIU Jieyun, QIU Husen, et al. Effects of drip irrigation patterns and biochar addition on soil mineral nitrogen and microbial regulation of greenhouse[J]. Environmental Science, 2020, 41(8): 3 836-3 845.
Short-term Effect of Waterlogging on Mineral Nitrogen and Ammonia-oxidizing Microorganisms in Soil
QIU Husen1, LIU Jieyun1*, ZHEN Bo2, NIU Qinglin2, LI Huizhen2, ZHOU Xinguo2, WANG Yu1
(1. School of Environment and Surveying Engineering, Suzhou University, Suzhou 234100, China;2. Farmland Irrigation Research Institute, Chinese Academy of Agricultural Sciences, Xinxiang 453002, China)
【Objective】Waterlogging is a common abiotic stress affecting crop growth and soil functions. The purpose of this paper is to experimentally investigate short-term effect of waterlogging on mineral nitrogen and ammonia-oxidizing microorganisms in the rhizosphere and bulk soil of winter wheat. 【Method】Waterlogging was imposed at the anthesis stage, and lasted 0 days, 3 days and 5 days, respectively. In each treatment, we measured the mineral nitrogen and the copy numbers of ammonia oxidizing microorganisms in the soil at the end of surface waterlogging, the end of subsurface waterlogging, as well as two days after the waterlogging completely eased.【Result】Compared with the control (without waterlogging), prolonged surface waterlogging promoted ammonium nitrogen and reduced nitrate nitrogen in both the rhizosphere and the bulk soil (<0.05). Surface waterlogging lasting for 5 days significantly reduced the copy numbers of ammonia-oxidizing archaea (AOA-) gene in the rhizosphere but reduced the ammonia-oxidizing bacteria biomass after the waterlogging eased. Redundancy analysis showed that the ammonium nitrogen and pH significantly affected the community of the ammonia oxidizing microorganisms in the bulk soil. Stepwise regression analysis showed that the contents of ammonium and nitrate nitrogen were both regulated by the ammonia-oxidizing archaea in the bulk soil during and after the waterlogging. In contrast, a decrease in water content in the rhizosphere did not show significant influence on ammonium nitrogen, but increased nitrate nitrogen. The increase in available phosphorus may accelerate the accumulation of ammonium nitrogen. 【Conclusion】Mineral nitrogen content in soil recovered quickly after short-term waterlogging, and applying phosphate fertilizer can improve mineral nitrogen in the rhizosphere of winter wheat.
waterlogging stress; ammonium nitrogen; nitrate nitrogen; ammonium oxidation
邱虎森, 刘杰云, 甄博, 等. 涝渍胁迫对土壤无机氮及氨氧化微生物的短期效应[J]. 灌溉排水学报, 2022, 41(11): 30-36.
QIU Husen, LIU Jieyun, ZHEN Bo, et al. Short-term Effect of Waterlogging on Mineral Nitrogen and Ammonia-oxidizing Microorganisms in Soil[J]. Journal of Irrigation and Drainage, 2022, 41(11): 30-36.
1672 - 3317(2022)11 - 0030 - 07
S154.3
A
10.13522/j.cnki.ggps.2021459
2021-09-25
国家重点研发计划项目(2018YFC1508301-2);中国农业科学院基本科研业务费专项(FIRI2019-02-01);博士科研启动基金项目(2020BS022);校级质量工程重点项目(szxy2020szky03);河南省科技攻关项目(22210210339);横向项目(2022xhx052,2022xhx167)
邱虎森(1987-),男。助理研究员,博士,主要从事土壤元素循环及微生物作用机制研究。E-mail: qiuhusen2008@163.com
刘杰云(1985-),女。讲师,主要从事农田土壤温室气体排放研究。E-mail: liujieyun66@163.com
责任编辑:白芳芳
