葡萄糖与甘氨酸反应产物对碳钢的缓蚀效果
2022-12-07任品桥王秀梅叶天爱邓紫嫣王泌颖
任品桥,王秀梅,万 晔,叶天爱,邓紫嫣,王泌颖
(沈阳建筑大学材料科学与工程学院,辽宁 沈阳 110168)
0 前 言
金属腐蚀是全球范围内的重大问题,每年会带来巨大的经济损失。国内外金属腐蚀防护领域的科学家及企业的技术人员开发出了许多防腐措施,其中,缓蚀剂法以其添加剂量小、成本低、操作简单、无需改变设备和工艺等被广泛用于金属腐蚀防护中。常用的缓蚀剂有无机盐类如铬酸盐、钼酸盐、磷酸盐等,以及一些含P、O、N、S等杂原子和π键、芳环、杂环的有机化合物等[1-4]。
尽管这些缓蚀剂具有诸多优势,但在实际的使用过程中多会导致环境污染等问题。目前,人们的环保意识日益增强,相关法律规定也日益完备,所以研发高效、绿色环保的缓蚀剂具有十分重大的意义。一些研究人员报告了在多种腐蚀性介质中成功地使用天然存在的物质(动物、植物提取物,包括小分子和高分子聚合物等)作为金属材料的绿色缓蚀剂[5-7]。氨基酸是绿色环保、水溶性好的一类物质,科学家们对氨基酸及其衍生物进行了金属防腐蚀的研究工作,并取得了一定效果。Ismail[8]利用电化学方法研究了半胱氨酸对铜在0.6 mol/L NaCl和1.0 mol/L HCl中的缓蚀效果,其很好的抑制了铜在酸性和中性溶液中的腐蚀,主要影响铜腐蚀的阴极过程;Zhang[9]等以S - 苄基 - L - 半胱氨酸和L - 半胱氨酸为原料,分别与异硫氰酸苯酯反应制得2种半胱氨酸的衍生物5 - [(苄基硫)甲基] - 3 - 苯基 - 2 - 硫氧基咪唑烷 - 4 - 酮(BPT)和5 - (巯基甲基) - 3 - 苯基 - 2 - 硫氧基咪唑烷 - 4 - 酮(MPT),并通过电化学和表面分析法研究了它们对N80碳钢在CO2饱和地层水中的缓蚀性能。研究发现,MPT和BPT均表现出了很好的缓蚀效果(最高缓蚀率分别为MPT 99.26%、BPT 99.44%)。但葡萄糖与氨基酸反应产物作为缓蚀剂却未见报道。氨基酸与葡萄糖在一定条件下反应,产生了多种带有气味的大分子、小分子的化合物,氨基酸不同时,产物结构当中不同程度的含有N、O、S等电负性原子[10],缓蚀剂常常需要多种组分复配以增强协同缓蚀效果,葡萄糖与氨基酸反应产物是多种组分的混合物,且各组分间互补,理论上可望对金属产生很好的缓蚀效果。为此,本工作以葡萄糖和甘氨酸反应的产物(PGG)为缓蚀剂,采用腐蚀失重法、动电位极化曲线法、电化学阻抗谱(EIS)和扫描电子显微镜(SEM)观察等方法研究其对碳钢在1 mol/L HCl溶液中的缓蚀作用。
1 试 验
1.1 缓蚀剂(PGG)的合成
在100 mL三口瓶中,一次性加入18 mL去离子水、10.8 g葡萄糖(0.06 mol)、4.5 g甘氨酸(0.06 mol),边加热边搅拌,在约30 min内升温到100 ℃,并在105 ℃恒温条件下反应5 h。反应产物在50 ℃的干燥箱中干燥,得到深棕色产物(PGG),产物不作进一步提纯,直接用作缓蚀剂研究。主反应方程式和主要产物N - 葡萄糖基甘氨酸如图1所示。

图1 缓蚀剂合成路线
1.2 碳钢试样和腐蚀介质
用于腐蚀失重、电化学、扫描电子显微镜观察等试验的金属试样为购置的Q235碳钢。腐蚀介质为1 mol/L HCl溶液,其由去离子水稀释分析纯37%(质量分数)盐酸制得。
1.3 腐蚀失重试验
腐蚀失重试验的碳钢试样规格为30 mm×30 mm×15 mm。试样表面用100、200、400、600和800号砂纸逐级打磨,去离子水洗涤,超声波清洗并在无水乙醇中脱脂,在干燥器中干燥24 h。试验前,用分析天平称重,精度为±0.1 mg;用游标卡尺依次测量每个碳钢试样的长、宽、高,精度为±0.1 mm,以计算暴露在腐蚀性介质中的碳钢试样的总表面积。
将碳钢试样悬挂浸泡于空白和添加不同浓度的PGG的1 mol/L HC1溶液中,通过恒温水浴控制的试验温度为303 K(研究温度影响时,温度范围303~323 K),1 mol/L HCl溶液体积为200 mL,浸泡时间为5 h。取出碳钢试样,流水冲洗,刷子清洁表面腐蚀产物,去离子水洗涤,在无水乙醇中脱水,N2干燥,干燥器中干燥24 h。为了获得有关失重结果的可靠数据,将3个平行的碳钢样品悬挂在1 mol/L HCl溶液中,并获得平均腐蚀速率。用公式(1)、(2)和(3)计算腐蚀速率(v)、缓蚀效率(ηW)和表面覆盖度(θ):
(1)
式中:v为碳钢试样腐蚀速率,g/(m2·h);t为碳钢试样腐蚀时间,h;ΔW为碳钢试样腐蚀失重量,g;S为碳钢试样表面积,m2。
(2)
式中:ηW为PGG对碳钢的缓蚀效率,%;v0为未加PGG,碳钢的腐蚀速率,g/(m2·h);vinh为加有PGG,碳钢的腐蚀速率,g/(m2·h)。
(3)
式中:θ为PGG表面覆盖度,v0和vinh分别为碳钢试样在空白和添加不同浓度PGG 1 mol/L HCl溶液中的腐蚀速率,g/(m2·h)。
1.4 电化学试验
电化学试验的碳钢电极尺寸为10 mm×10 mm×10 mm的立方体, 除1个工作表面(10 mm×10 mm)暴露于腐蚀介质外,电极的其他表面均用环氧树脂包封,并用100,200,400,600,800号砂纸逐步抛光工作面。去离子水洗涤,超声波清洗器清洗,并用丙酮为工作面脱脂,在干燥器中干燥。采用PARSTAT2273型电化学工作站进行电化学测试,碳钢电极、饱和甘汞电极(SCE)和大片铂电极分别作为工作电极、参比电极和对电极。
电化学试验中测得的电位均以SCE为参比。在不同腐蚀介质中,碳钢电极的开路电位(OCP)在1 800 s内达到稳定。动电位极化曲线的扫描范围:相对于自腐蚀电位-0.15~0.25 V,扫描速率为0.005 V/s,得到的数据通过Powersuite软件进行拟合分析。拟合得到腐蚀电流密度J用来计算缓蚀效率ηJ,如式(4)所示[11]:
(4)
式中:J0和Jinh分别为碳钢电极在空白和添加不同浓度PGG的1 mol/L HCl介质中的腐蚀电流密度, A/cm2。
在稳态开路电位(OCP)下测定碳钢电极的电化学阻抗谱EIS,频率范围1.0×(10-2~105) Hz,振幅为10 mV,使用Zsimpwin进行EIS数据分析。由Nyquist曲线拟合得到的电荷转移电阻Rct用来计算缓蚀效率ηR,公式如下[12]:
(5)
1.5 扫描电子显微镜(SEM)观察
用于腐蚀表面形貌观察的碳钢试样的规格尺寸和试样的抛光、清洗、腐蚀浸泡、后处理均与腐蚀失重试验一致。通过Hitachi S - 4800扫描电子显微镜分析碳钢试样分别在空白和添加250 mg/L PGG的1 mol/L HCl溶液中腐蚀后的表面形态,加速电压为15 kV。
2 结果与讨论
2.1 腐蚀失重结果
2.1.1 缓蚀剂浓度的影响
碳钢试样在空白和添加不同浓度PGG的1 mol/L HCl溶液的腐蚀失重量、腐蚀速率及计算得到的缓蚀效率列于表1,表1中ρPGG为缓蚀剂PGG的质量浓度。从表1可以看出,添加PGG后,腐蚀失重量明显减少,腐蚀速率大大降低,缓蚀效率随PGG浓度的增加而增加,这一趋势归因于PGG取代了水分子而大量吸附到碳钢表面,提高了缓蚀剂在碳钢表面的覆盖度,极大程度地降低了腐蚀介质与碳钢的接触机会,很好的抑制了碳钢腐蚀。从表1还可以看出,当缓蚀浓度为200 mg/L 时缓蚀率达到94.5%,而浓度增大到250 mg/L 时,缓蚀效率仅略提高到94.7%,表明当PGG添加量增大到一定的数值后,此剂量能够保证PGG在碳钢表面形成连续、完整的吸附膜,吸附量不再变化,缓蚀效率趋于稳定,再增加缓蚀剂浓度对缓蚀效率的影响不大。
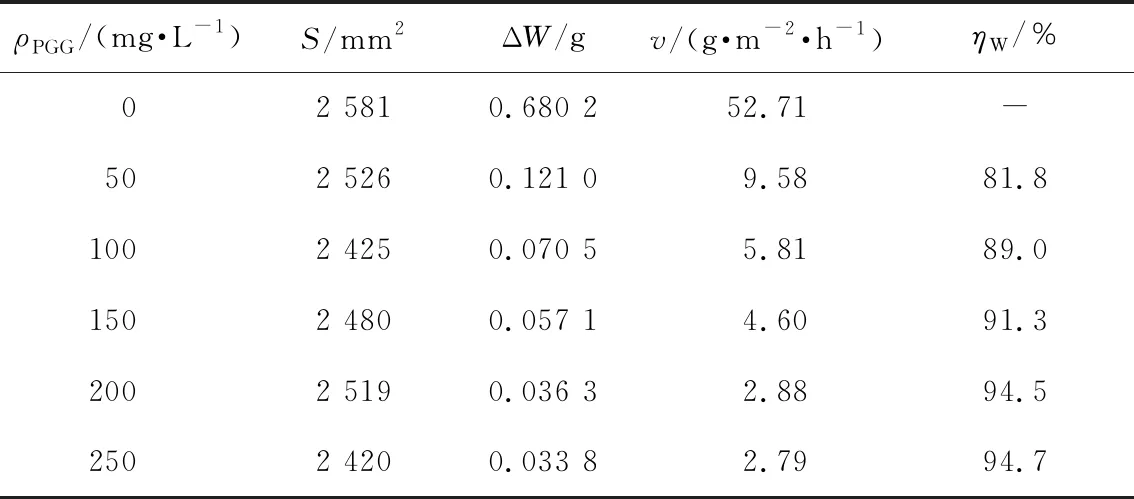
表1 303 K时,碳钢在1 mol/L HCl溶液中的腐蚀失重量、腐蚀速率和添加不同浓度PGG的缓蚀效率
2.1.2 温度的影响
303~323 K下,碳钢在空白及含有200 mg/L PGG的1 mol/L HCl溶液的重量损失量、腐蚀速率及计算得到的缓蚀效率列于表2,表2中ρPGG为缓蚀剂PGG的质量浓度。从表2可以看出,碳钢在空白和添加PGG的1 mol/L HCl溶液中的腐蚀失重量、腐蚀速率均随温度的升高而增加,这归因于温度升高,分子的热运动加速,铁原子的溶解加速,PGG在碳钢表面的吸脱附平衡向脱附方向移动,碳钢表面暴露面积增大。

表2 303~323 K时,碳钢在1 mol/L HCl溶液中的腐蚀失重量、腐蚀速率和添加200 mg/L PGG的缓蚀效率
PGG对碳钢的缓蚀效率随温度升高而降低,表明碳钢在添加PGG的腐蚀介质中的腐蚀速率增加比例大于在空白溶液中的增加比例。腐蚀反应活化能由式(6)进行计算:
(6)
v为303~323 K下,碳钢试样在空白和含有200 mg/L PGG 1 mol/L HCl 腐蚀介质中的腐蚀速率,g/(m2·h);Ea为碳钢腐蚀反应的活化能,kJ/mol;R为摩尔气体常数,其值等于8.314 J/(mol·K);T为绝对温度,K;A为指前因子,g/(m2·h)。
碳钢在空白和添加200 mg/L PGG的1 mol/L HCl溶液中腐蚀反应的活化能Ea由Arrhenius曲线拟合的斜率求得(图2),列于表3,表3中ρPGG为缓蚀剂PGG的质量浓度。在空白溶液中,Ea值仅为22.0 kJ/mol,而在含有PGG的溶液中,Ea值为98.6 kJ/mol,活化能的增加表明,PGG分子在碳钢-腐蚀溶液界面形成了保护膜,因此形成更高的腐蚀反应能垒。碳钢只有获得大于Ea的能量才能变成活化状态,进而越过能垒发生腐蚀,因此,在含有PGG的溶液中,碳钢的腐蚀变得更加困难,PGG有效地抑制了碳钢腐蚀[13]。
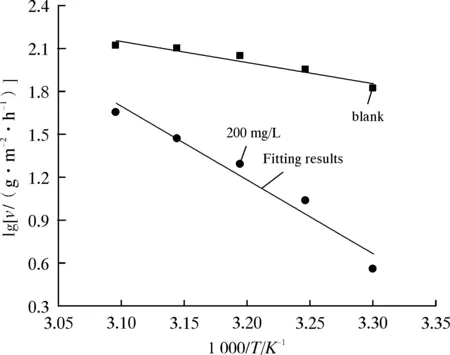
图2 碳钢在1 mol/L HCl溶液中的阿仑尼乌斯曲线

表3 阿仑尼乌斯曲线拟合参数
2.2 电化学结果
2.2.1 极化曲线结果
图3是303 K下碳钢电极在空白和添加不同浓度PGG溶液中稳定1 800 s后测得的动电位极化曲线。

图3 碳钢在空白和添加不同浓度PGG的1 mol/L HCl溶液中的动电位极化曲线
由图3可知,相对于空白溶液,添加PGG后,碳钢电极的阴极、阳极极化电流密度均呈现减小趋势,且PGG浓度越大,腐蚀电流密度越小,表明PGG同时抑制了阴极还原反应和阳极氧化反应;PGG添加浓度增大,腐蚀抑制作用增强,这是因为PGG在碳钢表面吸附量增加,形成了更为致密、完整的缓蚀性保护膜,切断了腐蚀介质接触碳钢电极的路径。
随着缓蚀剂浓度的增加,阴极极化曲线几乎互相平行,而阴极腐蚀电流密度急剧下降。对于阳极极化曲线,在极化初期阶段,极化电位逐渐增大,腐蚀电流密度增加缓慢,这表明PGG在碳钢表面的吸附速率大于其脱附速率,吸附过程主导阳极反应。但是,当极化电位正移到-0.3 V(vs SCE)以上时,表现出明显的缓蚀剂脱附特征,并且与初始阳极极化相比,腐蚀电流密度快速增大,该电位称为脱附电位。该现象可能是由于碳钢电极在高极化电位下,大量的铁原子氧化为亚铁离子进入到溶液中,促使吸附的PGG大量脱附,此时PGG大量从碳钢表面脱附下来,脱附速率远远大于吸附速率。电位继续增加到一定值,极化曲线表现出与空白溶液中相似的曲线特征,表明PGG完全从碳钢表面脱附下来,表面覆盖度接近于零,几乎丧失缓蚀作用。
自腐蚀电位Ecorr、腐蚀电流密度J、极化曲线的阴、阳极斜率βc和βa等电化学参数以及根据公式(4)计算的缓蚀效率(ηJ)列于表4。由表4可见,随PGG添加浓度的增大,碳钢的自腐蚀电位略有起伏,但变化的最大绝对差值为0.008 V,小于0.085 V,说明PGG是混合型缓蚀剂[14]。βa、βc均未发生显著变化,说明PGG吸附到碳钢表面,仅通过减少碳钢表面活性点来阻滞碳钢腐蚀,并没有改变碳钢的阴阳极腐蚀反应机理[15]。随PGG添加量的增加,碳钢电极的腐蚀电流密度逐渐降低,而缓蚀效率与腐蚀电流密度呈相反变化趋势,表明更多的PGG吸附在碳钢表面,增加了其在碳钢表面的覆盖面积,相应的,碳钢表面供发生腐蚀反应的活性点位数目减少,腐蚀反应受到抑制,缓蚀效果增强。

表4 碳钢在空白和添加不同浓度PGG的1 mol/L HCl溶液中极化曲线拟合参数
2.2.2 电化学阻抗谱
图4是碳钢电极在空白和添加不同浓度PGG 1 mol/L HCl溶液中浸泡1 800 s后测得的Nyquist谱。从图4明显可见,Nyquist谱表现为1个时间常数的下偏半圆容抗弧,表明电荷转移过程控制了碳钢电极在1 mol/L HCl溶液中的腐蚀[16]。相对于空白溶液,添加PGG后,碳钢电极的容抗弧半径增大;PGG浓度增加,容抗弧半径大幅增加,此现象归因于在碳钢表面形成了缓蚀剂保护性薄膜,该膜作为腐蚀反应电荷转移的屏障,增加了碳钢腐蚀的阻力,降低了腐蚀速率[17]。碳钢电极不完整的半圆形容抗弧可能是由碳钢电极表面的不均匀性、电场的不均匀分布以及碳钢表面上缓蚀剂分子吸附引起的。

图4 碳钢在1 mol/L HCl 溶液中的Nyquist曲线
为了更精确地拟合试验数据,等效电路中,用常相位角元件置换掉了纯电容,图5用来拟合所测得的Nyquist曲线,其中,Rs为溶液电阻,Rct为电荷转移电阻,用来表征碳钢腐蚀反应所受到的阻力;CPE即为常相位角元件,由2 个参数CPE和n描述,n为弥散系数,描述了缓蚀剂在碳钢表面的吸附特征[18]。通过拟合得到的相关参数及根据Rct计算的缓蚀效率ηR列于表5。

图5 等效电路
从表5可以看出,添加缓蚀剂后,电荷转移电阻Rct值增加而CPE值降低,且随着缓蚀剂浓度的增加,这种趋势继续改变,缓蚀效率升高。碳钢电极表面及腐蚀溶液中的过量电荷均排列在碳钢/溶液界面两侧,形成1个与电容器相似的双层结构。PGG的加入降低了电容值,是因为介电常数小的有机PGG分子取代了具有较大介电常数大的水分子和其他离子,形成PGG吸附膜[19]。PGG添加浓度越大,在碳钢表面吸附越多,排挤掉更多的水分子而形成连续保护膜,膜层更致密完整,电容值越低,电荷转移电阻值越大,电极难以与腐蚀介质进行电子交换,腐蚀反应进行得越慢,缓蚀效率越高,在浓度为250 mg/L 时最高为93.5%。
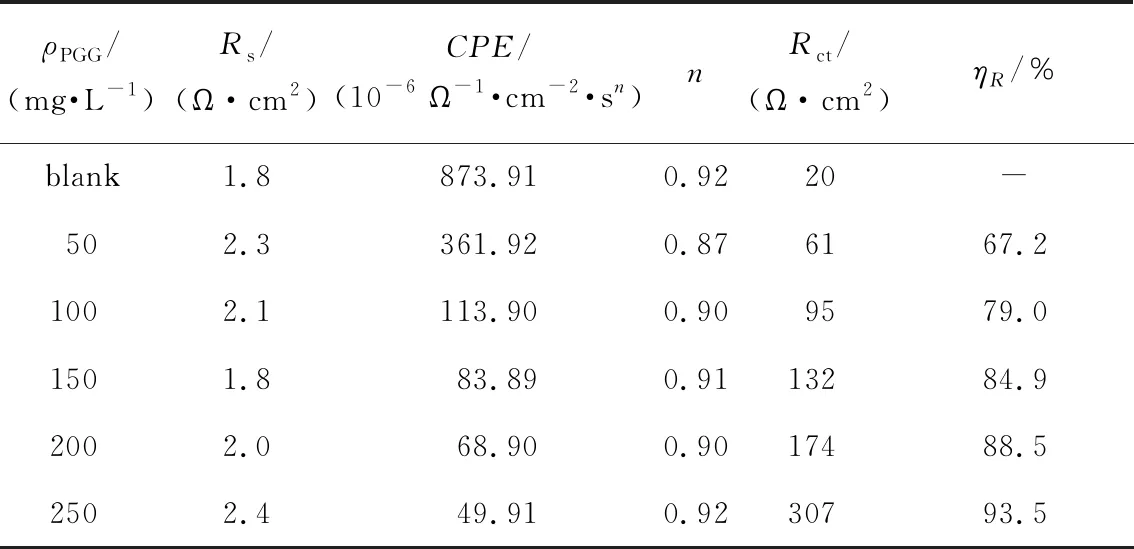
表5 碳钢在空白和添加不同浓度PGG的1 mol/L HCl溶液中Nyquist曲线拟合结果
2.3 表面形貌表征
碳钢在空白和添加250 mg/L PGG的1 mol/L HCl溶液中浸泡5 h后的SEM形貌如图6所示。由图6可以看出,碳钢在空白1 mol/L HCl溶液中腐蚀后的表面粗糙不平,说明发生了严重腐蚀;碳钢在添加250 mg/L PGG的1 mol/L HCl溶液中表面更为平整,说明PGG的加入对碳钢起到了一定的保护作用,可能是由于PGG吸附在碳钢表面,进而形成了保护性膜,从而抑制了碳钢腐蚀反应的发生。

图6 碳钢在空白和添加250 mg/L PGG的1 mol/L HCl溶液中的SEM形貌
2.4 吸附热力学
一般的,有机类缓蚀剂分子通过吸附在金属表面上而发挥腐蚀抑制作用[20],其2种吸附模式分别为物理吸附(静电引力)和化学吸附(电荷转移和共享)。吸附等温模型常用来描述缓蚀剂的吸附过程,有Langmuir等温模型、Frumkin等温模型、Temkin等温模型和Freundluich等温模型。吸附等温模型可以为金属-缓蚀剂相互作用的性质提供重要线索。使用由公式(3)计算得到的覆盖度θ(由于PGG为混合型缓蚀剂,覆盖度值等于缓蚀效率)对不同的吸附模型进行拟合,结果发现,PGG的吸附很好地符合Langmuir等温模型,其表达式如下:
(7)
式中,ρinh是PGG的质量浓度,mg/L ;θ是表面覆盖度;Kads是吸附平衡常数,L/mg。
式(7)表明,ρinh/θ与ρinh应该是直线关系。ρinh/θ与ρinh的关系曲线如图7所示,并进行拟合回归,得到的参数列于表6。

图7 1 mol/L HCl溶液中,PGG在碳钢表面的Langmuir等温吸附曲线
从图7和表6可以看出,ρinh/θ与ρinh曲线斜率等于1.010 03,线性相关系数等于0.999 72,都非常接近于1,表明该缓蚀剂遵循Langmuir等温吸附模型在碳钢表面进行吸附。斜率与相关系数不完全等于1,可能是由吸附在碳钢表面的PGG各分子之间的相互吸引、排斥、缔合的作用所引起的。
由拟合得到的截距计算吸附平衡常数和由式(8)计算得到的吸附自由能也列于表6中。

表6 碳钢在1 mol/L HCl溶液中的热力学参数
(8)
式中:ΔG0为标准吸附自由能,kJ/mol;T为热力学温度,K;R为摩尔气体常数,8.314 J/(mol·K)。
3 结 论
本工作通过腐蚀失重法、动电位极化曲线、电化学阻抗谱、扫描电镜等方法,研究了葡萄糖与甘氨酸反应产物(PGG)在1 mol/L HCl溶液中对碳钢的缓蚀性能,得出结论如下:
(1)PGG是碳钢在1 mol/L HCl溶液中的优良缓蚀剂,在303 K的温度条件下,腐蚀失重法和电化学法得出了一致的规律:缓蚀效率随PGG添加浓度的增加而增加。同时,缓蚀效率也随着环境温度的升高而降低。
(2)PGG同时抑制了碳钢在1 mol/L HCl溶液中阴阳极反应过程,阴阳极电流密度均随PGG添加浓度增大而减小,且自腐蚀电位基本不变,PGG是混合型缓蚀剂。PGG分子吸附在碳钢/溶液界面,置换掉原来吸附在碳钢表面的水分子形成吸附膜而增加电荷转移阻力,降低双电层电容,有效阻滞了碳钢的腐蚀。
(3)PGG在碳钢表面的吸附遵循Langmuir等温吸附模型,是包含了物理和化学的双重吸附过程。
