特瑞普利单抗注射液联合长春瑞滨+顺铂化疗一线治疗晚期NSCLC的效果及对外周血淋巴细胞PD-1变化的影响
2022-12-06冉方兰张孝彬卢安静
冉方兰,张孝彬,卢安静,汪 陵
0 引言
非小细胞肺癌(Non-small-cell lung cancer,NSCLC)为肺癌常见类型,约占全部肺癌的75%~85%,发病率、病死率均较高。多数NSCLC患者初次就诊即已进展至中晚期,错失手术时机,而化疗为主的综合治疗是其延长生存期的主要手段[1-3]。长春瑞滨+顺铂(Vinorelbine combined with cisplatin,NP)化疗方案为临床治疗NSCLC的重要方式,可抑制肿瘤进展,但从临床经验得出此类患者生活质量并未显著改善[4]。近年来,随着免疫生物学研究深入,免疫疗法逐渐被应用于肿瘤治疗,程序性死亡受体1(Programmed death receptor-1,PD-1)、程序性死亡配体1(Programmed death-ligand,PD-L1)可通过介导肿瘤细胞免疫逃逸参与肿瘤的发生发展[5]。近年研究证实,以PD-1/PD-L1为免疫检查点抑制剂在恶性肿瘤的治疗中取得良好效果[6]。特瑞普利单抗为国产PD-1抑制剂,已于2018年获得国家食品药品监督管理局批准[7]。特瑞普利单抗通过阻断PD-1/PD-L1通路,从而破坏肿瘤免疫耐受性,激活淋巴细胞抗肿瘤活性,产生持续抗肿瘤效果。本研究探究特瑞普利单抗注射液联合NP化疗一线治疗晚期NSCLC患者的治疗效果及对PD-1的影响,现报道如下。
1 资料与方法
1.1 一般资料 本研究经我院医学伦理委员会审核通过(批号:210141),选择2021年1月至2022年1月我院收治的82例NSCLC患者作为研究对象,分为观察组、对照组,各41例。两组患者一般资料比较,差异无统计学意义(P>0.05),存在可比性,见表1。
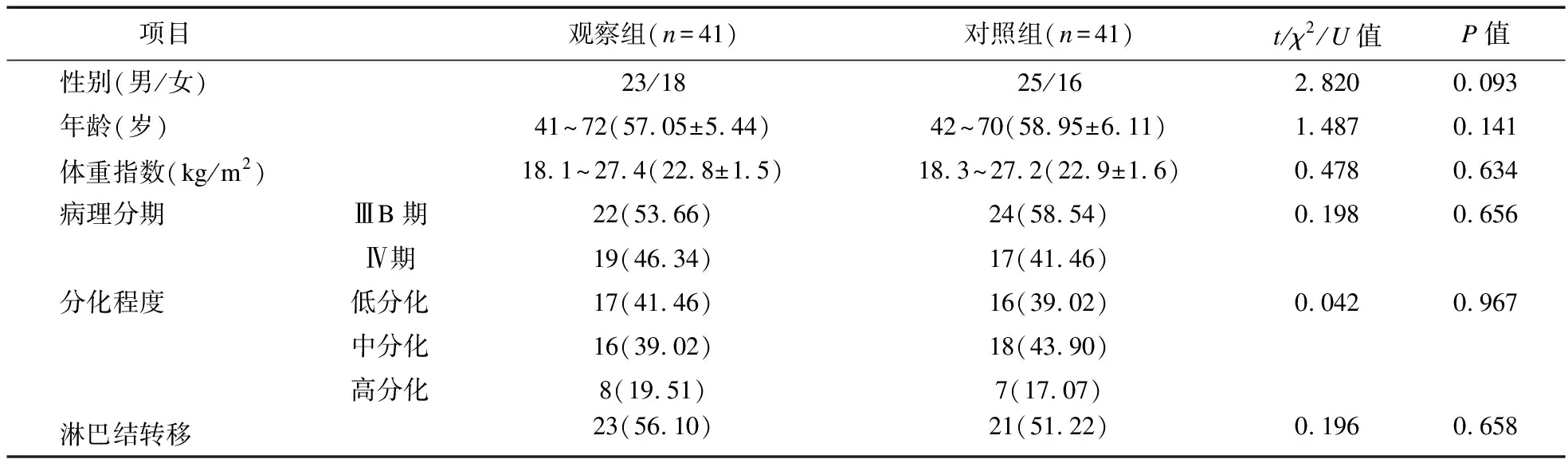
表1 两组患者一般资料比较
纳入标准:①均符合NSCLC诊断标准[8];②病理分期为ⅢB~Ⅳ期;③预计生存期≥3个月;④卡氏(KPS)评分>70分,可耐受化疗;⑤意识、精神正常,均完成相关治疗、检查;⑥治疗前血常规、心肝肾功能及骨髓造血功能正常。排除标准:①合并肺气肿、活动性肺结核、肺间质纤维化等肺部疾病;②血液、免疫系统疾病;③合并其他恶性肿瘤;④合并重要器官功能障碍;⑤既往放化疗治疗史;⑥对本研究所用药物存在使用禁忌证。
1.2 方法 对照组:接受NP方案化疗,第1、8天,静滴25 mg/m2长春瑞滨(海南通用康力制药有限公司,国药准字H20040477),第1~3天静滴25 mg/m2顺铂(齐鲁制药有限公司,国药准字H37021362),3周为1个周期。观察组:采用特瑞普利单抗注射液(苏州众合生物医药科技有限公司/上海君实生物医药科技股份有限公司,国药准字S20180015)联合NP化疗治疗,NP化疗同对照组,静脉滴注3 mg/kg特瑞普利单抗注射液,每3周1次,与化疗同步使用。治疗3个周期评估。
1.3 疗效评估 参照实体瘤疗效评估标准[9]:①完全缓解;②部分缓解;③病灶稳定;④病灶进展。前3项计入总临床获益率。
1.4 观察指标 ①疗效;②治疗前后取两组晨起空腹静脉血4 ml,离心(3 500转/min× 15 min),取血清,BS-220型全自动生化分析仪电化学发光法测定血清癌胚抗原(CEA)、细胞角蛋白19片段抗原21-1(CYFRA21-1)、糖类抗原125(CA125)、糖类抗原199(CA199);③以生活质量核心量表(QLQ-C30)进行评分,分值为28~112分,得分越低,生活质量越好;④两组治疗前后采用BD-FACBCalibu型流式细胞分析仪测定CD3+、CD4+、CD8+水平,计算CD4+/CD8+;⑤两组治疗前后取晨起空腹静脉血约3 ml,采用Ficoll密度梯度离心法将其制成外周血单核淋巴细胞,再以Trizol法提取总RNA,PCR法检测PD-1 mRNA、PD-L1 mRNA表达,以U6作为标准,检测基因相对表达量=2-△△Ct;⑥比较两组毒副反应发生率,根据CTCAE 4.0版[10]毒副反应评价标准进行评估。
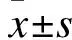
2 结果
2.1 两组患者疗效比较 观察组临床获益率、客观缓解率高于对照组(78.05%vs.56.10%,48.78%vs.26.83%,P<0.05),见表2。
2.2 两组患者肿瘤标志物水平比较 治疗前,两组患者血清CEA、CYFRA21-1、CA125、CA199水平比较,差异无统计学意义(P>0.05);治疗后,两组上述指标均降低,且观察组低于对照组(P<0.05),见表3。

表2 两组患者疗效比较[例(%)]

表3 两组患者肿瘤标志物水平比较
2.3 两组患者生活质量评分比较 治疗前,两组患者QLQ-C30评分比较,差异无统计学意义(P>0.05);治疗后,两组QLQ-C30评分降低,且观察组低于对照组(P<0.05),见表4。
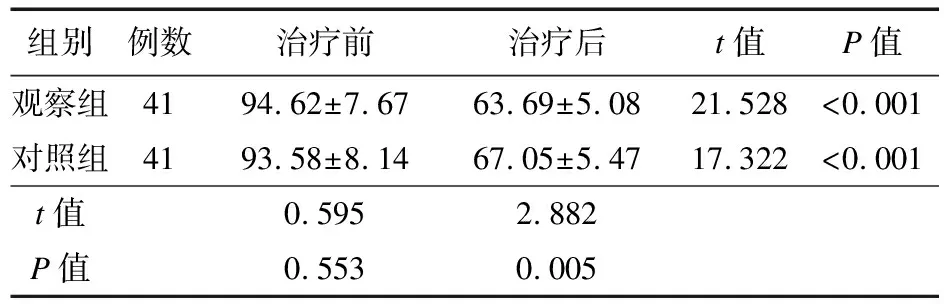
表4 两组患者QLQ-C30评分比较
2.4 两组患者免疫功能指标比较 治疗前,两组CD3+、CD4+、CD4+/CD8+水平比较,差异无统计学意义(P>0.05)。治疗后,观察组上述指标升高(P<0.05),且高于对照组(P<0.05);对照组治疗前后差异无统计学意义(P>0.05),见表5。
2.5 两组患者PD-1 mRNA、PD-L1 mRNA水平比较 治疗前,两组患者PD-1 mRNA、PD-L1 mRNA水平比较,差异无统计学意义(P>0.05);治疗后,两组上述指标水平降低,且观察组低于对照组(P<0.05),见表6。
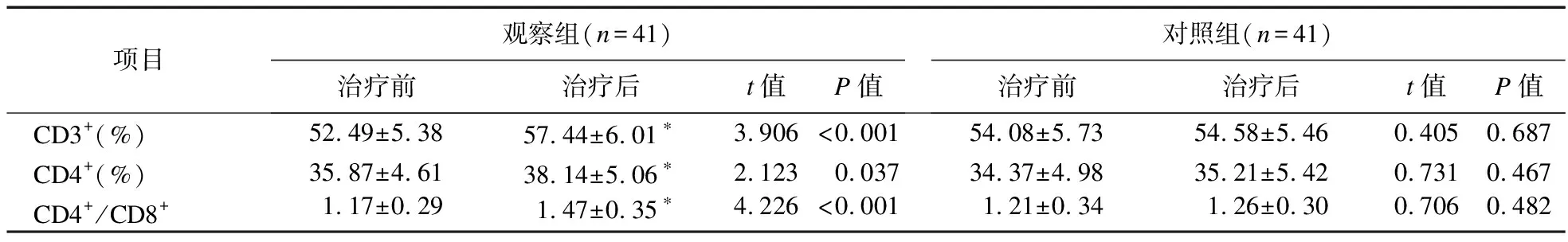
表5 两组患者免疫功能指标比较
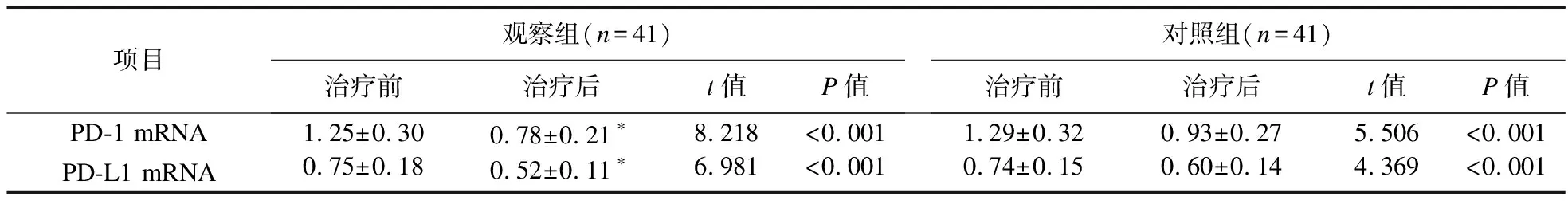
表6 两组患者PD-1 mRNA、PD-L1 mRNA水平比较
2.6 两组患者毒副反应发生情况比较 两组患者白细胞计数降低、恶心呕吐、肝功能异常、皮疹、乏力反应发生率比较,差异无统计学意义(P>0.05),见表7。
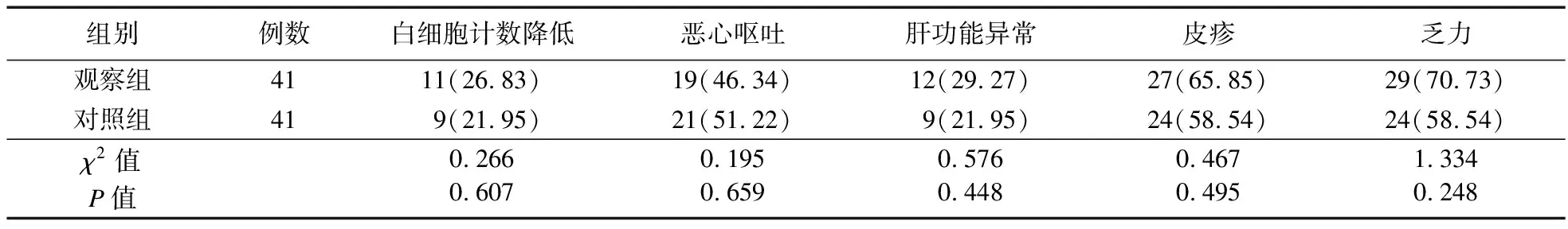
表7 两组患者毒副反应发生情况[例(%)]
3 讨论
NP方案为治疗中晚期NSCLC患者的常用方案,由顺铂、长春瑞滨组成,其中顺铂与DNA链碱基结合可干扰细胞周期各时相,抑制肿瘤细胞增殖,还可与蛋白交联,影响肿瘤细胞生理功能,从而发挥抗肿瘤效果,且与其他抗肿瘤药物联用不存在交叉耐药性;长春瑞滨在阻断肿瘤细胞微管形成中有高度特异性,干扰细胞正常有丝分裂过程,使有丝分裂停止于中期,从而阻止肿瘤细胞增殖[11-12]。赵景娟等[13]研究显示,采用NP化疗方案治疗晚期NSCLC患者客观缓解率为46.4%,不良反应可耐受,但仍有部分患者未受益,因此仍需优化治疗方案。
免疫逃逸为肺癌发生发展的重要机制[14]。PD-1/PD-L1介导肿瘤细胞免疫逃逸的机制在于通过阻断递呈抗原的树突细胞接触T细胞,从而阻止T细胞激活[15]。近年来,中晚期恶性肿瘤的治疗从化疗、靶向治疗逐渐迈入免疫治疗,其中PD-1/PD-L1信号通路抑制剂在免疫治疗中取得巨大进展,已进入晚期肺癌临床试验研究[16]。特瑞普利单抗由上海君实生物医药研发,是我国首个批准上市的国产PD-1抑制剂。目前,我国进行多项针对特瑞普利单抗的临床试验,用于治疗多种晚期恶性肿瘤[17]。李文娟等[18]研究指出,特瑞普利单抗单药或联合化疗治疗恶性黑色素瘤、肺癌、消化系统肿瘤等多种晚期恶性肿瘤,疗效显著,且安全性高,毒性可耐受。另有研究提出,肺癌患者PD-1、PD-L1呈高表达状态,PD-1、PD-L1可能参与肺癌的发生发展,可作为临床免疫治疗靶点[19]。基于此,本研究在NP化疗方案的基础上加用特瑞普利单抗治疗晚期NSCLC,发现可将临床获益率、客观缓解率分别提高至78.05%、48.78%,效果显著。治疗后,观察组患者PD-1 mRNA、PD-L1 mRNA水平降低,且未增加不良反应发生风险。分析原因主要是特瑞普利单抗可与T淋巴细胞表面PD-1特异性结合,从而阻断PD-1/PD-L1信号通路,恢复机体免疫功能,从而抑制肿瘤增殖、侵袭。另有研究显示,特瑞普利单抗亲和力较高,药效持久稳定,可诱导更强的抗肿瘤免疫应答,且其平衡解离常数约为3 nmol/L,可有效抑制PD-1与PD-L1结合[20]。上述研究说明特瑞普利单抗应用于中晚期NSCLC的治疗可通过阻断PD-1/PD-L1通路,促使机体免疫细胞功能得到修复,从而提高抗肿瘤效果。
此外,随着疾病发生发展,肿瘤患者生活质量逐渐降低,且可表现多种机体生物学异常。CEA、CYFRA21-1、CA125、CA199是NSCLC的常见肿瘤标志物,近年研究表明,上述因子水平变化与肿瘤发生及转归存在直接关联性,可应用于评估病情特征[21]。本研究中,联合治疗的患者CEA、CYFRA21-1、CA125、CA199水平降低更显著,进一步表明加用特瑞普利单抗治疗晚期NSCLC的效果确切。研究表明,特瑞普利单抗能阻断PD-1/PD-L1通路,提升肿瘤细胞免疫敏感性,增强免疫应答,恢复免疫功能对肿瘤细胞的杀伤能力[22]。本研究进一步分析特瑞普利单抗对患者免疫功能的影响,结果显示,治疗后CD3+、CD4+、CD4+/CD8+水平明显升高。主要是由于PD-1与PD-L1结合后可产生特殊分子信号,其作用于T淋巴细胞,抑制对应细胞的正常活化,而特瑞普利单抗与T淋巴细胞的PD-1蛋白特异性结合,继而阻断PD-1/PD-L1信号通路,确保T淋巴细胞维持正常活性。本研究首次对特瑞普利单抗注射液联合NP化疗一线治疗晚期NSCLC进行研究,但此方案的远期效果仍需进一步探讨。
综上所述,特瑞普利单抗注射液联合NP一线治疗晚期NSCLC是一种安全有效的方案,可调控PD-1、PD-L1表达改善机体细胞免疫功能,抑制肿瘤标志物表达,对提升患者生活质量有积极意义。
