PtrWRKY51基因的克隆及抗旱表达特性分析
2022-12-06黄安瀛夏德安那冬晨魏志刚
黄安瀛 夏德安 张 洋 那冬晨 燕 青 魏志刚
(1. 国家林业和草原局盐碱地研究中心,北京 100091;2. 国家林业和草原局桉树研究开发中心,湛江 524022;3. 东北林业大学林木遗传育种国家重点实验室,哈尔滨 150040;4. 山西师范大学生命科学学院,临汾 041000)
植物抗逆涉及多个不同调控水平间复杂的互作过程,包括生理生化代谢调节及基因表达动态调控[1],而基因表达调控需要转录因子(Transcrip⁃tion factor,TFs)的参与。转录因子作为信号转导过程中的重要调控因子,能与特定DNA序列结合,能够激活或抑制特定靶基因转录,对于基因表达调节具有至关重要的作用[2]。此外,顺式作用元件在转录时也发挥了重要作用,最终可以抑制或增强靶基因的转录来调控靶基因的转录效率[3]。
研究表明NAC、AP2/ERF和WRKY等转录因子家族均在植物应对胁迫时发挥作用[4]。WRKY作为一种常见转录因子,结构上来说,含有高度保守的WRKY 结构域——七肽WRKYGQK 和锌指基序[5-6]。通过家族成员包含WRKY 结构域个数以及锌指基序的不同类别,常被分为三类。第一类包含2 个WRKY 结构域与一个C2H2锌指结构,其他两类均只有一个WRKY 结构域,不同的是第二类的锌指结构域为C2H2而第三类是C2HC[7]。从作用方式而言,WRKY转录因子可与W-box 元件有效结合,激活或抑制下游靶基因的转录,也可以与其他作用元件结合形成蛋白质复合物,增强转录结合蛋白的活性。从功能角度而言,多项研究[8-10]证明该家族基因在冷热胁迫、旱涝胁迫、高盐胁迫等非生物胁迫中发挥重要作用。
作为研究最广泛的TFs 家族之一,WRKY家族在 毛 果 杨(Populus trichocarpa,104 个)[11]、黄 瓜(Cucumis sativus,55 个)[12]、拟 南 芥(Arabidopsis thaliana,74 个)[13]、水稻(Oryza sativa,102 个)[13]和番茄(Solanum lycopersicum,104 个)[14]等植物中均有报道。近年来,关于毛果杨WRKY转录因子的研究主要集中在生物胁迫和生长发育,对于非生物胁迫研究较少。 例如,PtrWRKY18和PtrWRKY35能促进毛果杨对生物营养病原菌大斑菌的抗性[15],PtrWRKY89能增强毛白杨对黑斑病胁迫的耐受能力[16],PtrWRKY73在对生物营养性病原菌的抗性中起着积极作用,对坏死性病原菌的抗性起着消极作用[17]。此外,PtrWRKY19参与了毛果杨次生壁形成的调控[18],PtrWRKY25可能在木质素合成中发挥作用[19]。
本研究通过从盐胁迫转录组测序文库中,获得盐胁迫响应基因PtrWRKY51,通过生物信息学分析其理化性质、酵母自激活活性检测其转录活性,研究其亚细胞定位,以及模拟干旱胁迫条件下定量PCR,对该基因抗逆性进行综合分析,为毛果杨WRKY家族基因的抗逆及功能进一步研究提供参考。
1 材料与方法
1.1 毛果杨RNA的提取及cDNA的合成
Nisqually-1 野生型毛果杨来自中国科学院分子植物科学卓越创新中心,采用组织培养方法扩繁后,在25 ℃、长日照(光照16 h 黑暗8 h)温室中培养3周后选择生长势相似的组培苗,取材后液氮中研磨。使用擎科生物科技有限公司的多糖多酚植物总RNA 提取试剂盒(货号:TSP412)提取毛果杨总RNA,TaKaRa 公司的PrimeScript™1st Strand cDNA Synthesis Kit(货号:6110A)反转录获得cD⁃NA,放置于冰箱内-20 ℃保存备用。
1.2 PtrWRKY51基因的克隆
在PtrWRKY51(Potri.007G079800.1)基因序列两端分别设计引物,由擎科生物科技有限公司合成引物PtrWRKY51-F/R(见表1)。利用东洋纺生物科技有限公司的KOD FX Neo 试剂盒克隆基因,使用OMEGA 的E.Z.N.A.®Gel Extraction Kit 试剂盒对PCR 扩增产物进行胶回收。回收产物连接至pClone007 Blunt Vector Kit 载体,热激法转化大肠杆菌并涂平板,次日挑取单克隆摇菌送至擎科测序,结果正确即使用E.Z.N.A.®Plasmid Maxi Kit OMEGA试剂盒提取质粒。

表1 PCR引物序列Table 1 PCR primer sequences
1.3 PtrWRKY51 转录激活活性检测与亚细胞定位分析
1.3.1 PtrWRKY51转录激活活性检测
利 用BioEdit 软 件,结 合pGBKT7 载 体,对PtrWRKY51的CDS 序列进行酶切位点分析,上游引物酶切位点选用EcoRⅠ,下游选用BamHⅠ,设计载体双酶切扩增引物pGBKT7-PtrWRKY51-F/R。以测序正确的PtrWRKY51阳性质粒为模板扩增pGBKT7-PtrWRKY51目的片段。利用Trelief™SoS⁃oo Cloning Kit Ver.2 试剂盒将双酶切成功的pGB⁃KT7 载体质粒与目的片段连接,热激法转化完成后将测序正确菌液过夜培养后提取质粒。
取保存于中国林业科学研究院天津林业科学研究所的Y2H 酵母菌株,参照Clontech 公司酵母双杂交手册进行酵母感受态细胞制备和质粒转化。转化完成后各取100 μL 菌液,均匀涂布在SD/-Trp 固体培养基中,30 ℃培养4 d。培养完成后挑取单克隆进行扩大培养,30 ℃、250 r·min-1直至OD600达到0.6~0.8;取1 mL 菌液高速离心,弃去上清后用去离子水将菌液重悬,浓缩至OD600=1.0;吸取2 μL 的pGBKT7-PtrWRKY51与pGBKT7 空载酵母菌液分别点在SD/-Trp和SD/-Trp/-His/-Ade/Xɑ-Gal 固体培养基上培养,恒温培养箱中30℃倒置培养3 d,观察菌落生长及颜色变化情况。
1.3.2 PtrWRKY51亚细胞定位
使用BioEdit 软件对PtrWRKY51的CDS 序列进行酶切位点分析,结合pBI121-GFP 载体,上下游均选用BamHⅠ酶切位点,设计载体单酶切扩增引物pBI121-GFP-PtrWRKY51-F/R。以测序正确的PtrWRKY51 阳性质粒为模板扩增PBI121-GFPPtrWRKY51目的片段,Trelief™SoSoo Cloning Kit Ver.2 试剂盒将单酶切成功的pBI121-GFP 载体与目的片段连接。热激法转化完成后送测序,测序正确后扩大培养提取质粒。
冻融法将pBI121-GFP-PtrWRKY51转入农杆菌GV3101,将重悬农杆菌液注射到本氏烟草叶片背面,培养箱培养2 d 后,使用1×PBS 稀释到终浓度为100 ng·mL-1的DAPI 室温染色10 min,采用激光共聚焦显微镜观察。
1.4 PtrWRKY51基因生物信息学分析
通 过NCBI 的ORF Finder(https://www.ncbi.nlm.nih.gov/orffinder/)分析PtrWRKY51的开放阅读框;利用NCBI中的CD-search(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)预测PtrWRKY51的保守结构域;使用ExPaSy 在线程序Protparam(https://web.expasy.org/cgi-bin/protparam/protparam)分析蛋白理化性质。采用SignalP(http://www.cbs.dtu.dk/services/SignalP)进行蛋白信号肽预测;通过TMHMM(http://www.cbs.dtu.dk/services/TMHMM/)进行蛋白跨膜结构域预测;使用在线程序SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/secpred sopma.pl)进行蛋白质二级结构分析;使用Plant-mPLoc(http://www.csbio.sjtu.edu.cn/bioinf/plant-multi/)在线软件进行亚细胞定位预测。通过MEGA6.0中的邻接法进行系统发育进化树构建;氨基酸多序列比对使用BioEdit进行。从Phytozome网站(https://phytozome.jgi.doe.gov)下载PtrWRKY51起始密码子前2 000 bp的序列作为启动子区域汇总,上传至Plant⁃care网站(http://bioinformatics.psb.ugent.be/webtools/plantcare/html)进行顺式作用元件在线分析。
利用在线软件STRING(https://string-db.org/)进行蛋白互作预测分析构建蛋白互作网络,将PtrWRKY51 蛋白序列导入网站,构建蛋白互作网络,探究PtrWRKY51蛋白在毛果杨中的互作关系。
1.5 PtrWRKY51基因表达模式分析
选取当年生生长势相似的同株系毛果杨组培苗为材料,采用8% PEG6000 水培模拟干旱胁迫,选择0、6、12、24、48、72 h 6 个时间点,每个时间点3 个生物学重复。以Ptr-Actin基因为内参[20],利用TransStart Top Green qPCR SuperMix(全式金)试剂盒配制qRT-PCR 反应液,在MJ MiniTMpersonal thermal cycler Real-time PCR 仪器上进行试验,反应程序为94 ℃/30 s;94 ℃/5 s,59 ℃/15 s,72 ℃/10 s,重复40个循环后反应结束。采用2-ΔΔCT的方法[21]计算相对表达量。定量引物DL-PtrWRKY51-F/R见表1。
2 结果与分析
2.1 PtrWRKY51基因的克隆
以当年生毛果杨为材料整株研磨提取总RNA。反转录成cDNA后,扩增该基因的CDS序列并测序,序列来源于(https://phytozome.jgi.doe.gov)数据库,得到扩增产物长度为579 bp(见图1),命名为PtrWRKY51。

图1 PtrWRKY51基因的克隆Fig.1 Cloning of the PtrWRKY51 gene of P.trichocarpa M.Marker
2.2 PtrWRKY51 转录激活活性检测与亚细胞定位分析
2.2.1 PtrWRKY51转录激活活性检测
以PtrWRKY51阳性质粒为模板,以PGBKT7-PtrWRKY51-F/R 为引物进行PCR 扩增,扩增产物与空载酶切产物连接后热激法转化大肠杆菌,使用Omega 质粒提取试剂盒提取质粒后进行菌液PCR 鉴定后送公司测序。测序结果表明,成功扩增到目的片段。
结果发现在SD/-Trp培养基中pGBKT7空载酵母与pGBKT7-PtrWRKY51均能正常生长出白色菌落,而在SD/-Trp/-His/-Ade/X-ɑ-Gal三缺培养基上只有pG⁃BKT7-PtrWRKY51菌落及正对照能够正常生长且变蓝(见图2)。表明PtrWRKY51具有转录自激活活性。

图2 PtrWRKY51的激活活性分析结果Fig.2 Analysis of activity test of PtrWRKY51
2.2.2 亚细胞定位分析
将PtrWRKY51构建到带有GFP 标签的植物表达载体中,得到含有pBI121-GFP-PtrWRKY51片段的质粒。质粒成功转化农杆菌后,注射本氏烟草,利用激光共聚焦显微镜观察绿色荧光在细胞内的分布。结果显示:pBI121-GFP 空载在细胞膜与细胞核均可看到绿色荧光;pBI121-GFP-PtrWRKY51只能在细胞核观察到绿色荧光,定位于细胞核中(见图3)。

图3 PtrWRKY51基因的亚细胞定位PBI121-GFP-PtrWRKY51.融合蛋白和GFP 蛋白在烟草叶片细胞中的定位情况;GFP.绿色荧光信号;DAPI. 4',6-二脒基-2-苯基吲哚,与DNA强力结合的一类荧光染料;Light.明场信号;Merge.叠加信号Fig.3 Subcellular Localization of PtrWRKY51 gene PBI121-GFP-PtrWRKY51.Localization of fusion proteins and GFP proteins in tobacco leaf cells;GFP.Green fluorescent signal;DAPI. 4',6-diami⁃dine-2-phenylindole,a class of fluorescent dyes strongly bound to DNA;Light.Bright field signal;Merge.Merges signals
2.3 PtrWRKY51基因生物信息学及进化树分析
2.3.1 PtrWRKY51基因理化信息
生物信息学分析结果表明PtrWRKY51 包括2 973 个原子,分子式为C947H1439N267O309S11,相对分子质量为21.86 kDa。编码氨基酸全长为192 aa,在307~477 bp 处含有WRKY 结构保守域,包含57个氨基酸(见图4)。组成蛋白的氨基酸中,丝氨酸(Ser)所占比例最高,为14.6%,色氨酸(Trp)所占比例最低,占1.6%,不含硒半胱氨酸(Sec)和吡咯赖氨酸(Pyl)。该蛋白等电点为7.63,不稳定系数为50.70,平均亲水系数为-1.006,脂肪指数为44.64,推测该蛋白为不稳定亲水的碱性蛋白。亚细胞定位预测显示基因定位于细胞核,与试验结果一致。

图4 PtrWRKY51基因序列及预测的保守域Fig.4 Sequence and predicted conserved domain of PtrWRKY51 gene
2.3.2 PtrWRKY51蛋白的二级结构及功能结构域预测
通过在线预测蛋白的二级结构(见图5),PtrWRKY51 蛋白的二级结构主要是由无规卷曲(69.79%)、延伸链(14.06%)、α-螺旋(11.46%)和β-折叠(4.69%)组成。对蛋白进行预测没有发现信号肽存在,是不存在典型的跨膜螺旋区的非跨膜蛋白。
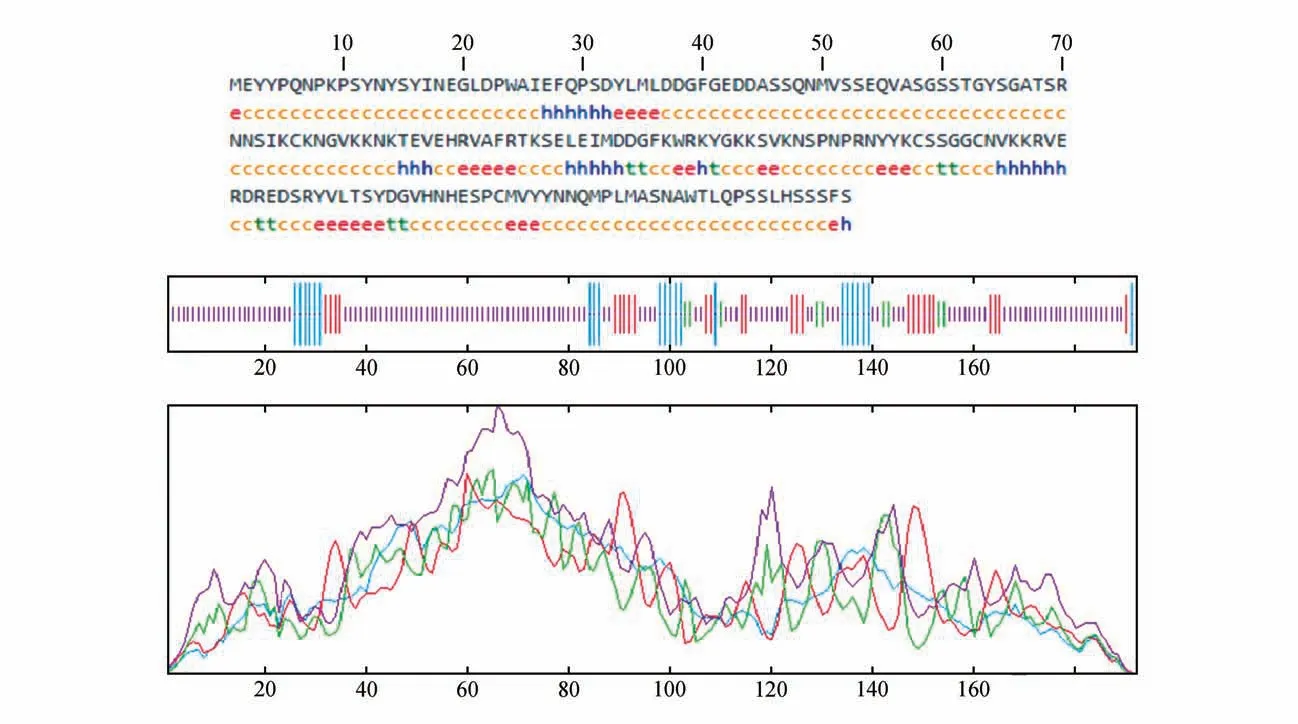
图5 PtrWRKY51蛋白二级结构预测Fig.5 Prediction of secondary structure of PtrWRKY51 protein
2.3.3 物种间进化关系比对
从NCBI检索与PtrWRKY51同源度高的同源基因,选取前11个构建系统发育进化树(见图6)。分析结果显示:WRKY51同源基因在草本植物和木本植物基因在进化中处于不同分支上,毛果杨与胡杨进化关系最近,与西葫芦和水稻最远。毛白杨、胡杨、毛果杨、乌苏里杨与加州白栎均含有6个基序,而陆地棉最少,只有1个基序。保守结构域与氨基酸序列分析结果显示这些基因含有一个共同的WRKY保守结构域(见图6~7),且木本植物与拟南芥中的同源基因保守区域内β1(WRKYGKK)、β2(PRNYYKC)和β3(KKRVE)序列是绝对保守的,推测这些基因可能在某些方面具有相似作用。

图6 同源基因蛋白系统发育进化树及基序比对Fig.6 Phylogenetic tree and motif alignment of homologous gene proteins
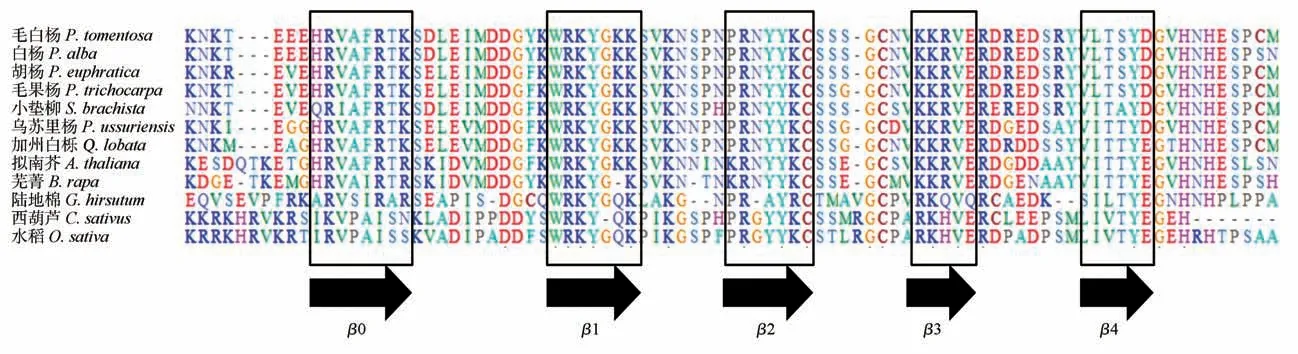
图7 同源基因氨基酸序列比对Fig.7 Alignment of amino acid sequence of homologous genes
2.3.4 启动子区顺式作用元件分析
为了解PtrWRKY51基因可能的生物学功能和调控特性,利用PlantCARE 对其进行启动子分析。结果表明:PtrWRKY51前2 000 bp启动子区域内除启动子的基本转录原件TATA-box、CAAT-box及光响应元件外,还有部分非生物胁迫响应元件与植物激素响应元件。
值得注意的是,PtrWRKY51启动子区域内包含的非生物胁迫响应元件与植物激素响应元件(见表2)数量由高到低分别为茉莉酸甲酯响应元件(CGTCA-motif 和TGACG-motif)、ABA 应答元件(ABRE)、抗病和胁迫诱导元件(TC-rich repeats)、水杨酸诱导元件(TCA-element)和厌氧诱导元件(ARE)。
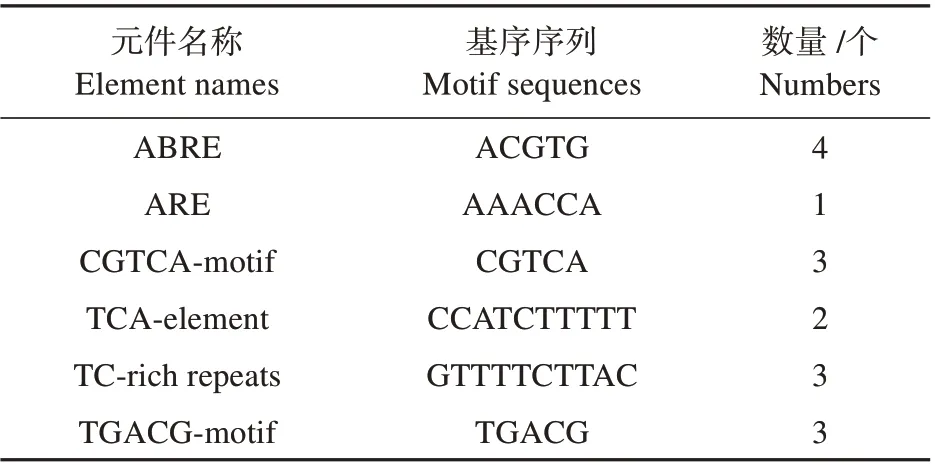
表2 PtrWRKY51基因启动子区域的各顺式作用元件Table 2 Analysis of cis acting elements in PtrWRKY51 genes promoter region
2.3.5 PtrWRKY51蛋白互作预测分析
蛋白互作预测结果显示(见图8),PtrWRKY51蛋白不但与WRKY 家族自身成员之间,如Potri.007G079800(PtrWRKY16)、Potri.013G090300(PtrWRKY77)等发生互作,还与Potri.001G086400(Dof36)、Potri.003G144500(Dof31)、Potri.005G131600(Dof34)、Potri.007G036400(Dof23)等Dof(DNAbinding One Zinc Finger)转录因子进行互作,预示PtrWRKY51 与这些蛋白在功能上可能有一定关联。

图8 PtrWRKY51蛋白互作预测Fig.8 Predict and analysis of the interacting protein of WRKY51 in P.trichocarpa
2.4 PtrWRKY51基因表达模式分析
以胁迫0 h 的PtrWRKY51在毛果杨根部中的表达量为1,分别检测8% PEG6000 胁迫后6 个时间段毛果杨在根、茎、叶中的PtrWRKY51基因表达量(见图9)。分析结果表明胁迫后PtrWRKY51基因在毛果杨根、茎、叶中的相对表达量总体呈先降低再升高后降低的趋势,茎部变化量最为明显,胁迫12 h 后茎部(37.0)与叶部(27.7)表达量达到最大值,而根部则在24 h达到最大值(8.1)。
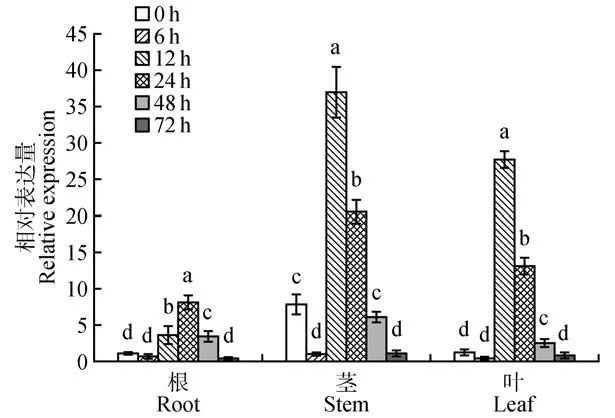
图9 8%PEG6000胁迫处理下不同时间段的组织特异性表达不同字母表示P<0.05水平显著Fig.9 Tissue specific expression in different time periods under 8%PEG6000 stress Different letter stand for significant differences at P<0.05
3 讨论
植物在生长中会不可避免受到各种生物胁迫与非生物胁迫,而植物本身无法移动,只能通过自身的防御机制来抵御外界胁迫。TFs 作为基因转录的开关,在这些机制中发挥重要的调控作用。近年来,已有多种转录因子被证实参与不同种类植物对生长发育、防御调控和胁迫反应的调控[22-23],WRKY 作为植物中最大的TFs 家族之一,也被证明在这些过程中发挥重要作用[7,24]。
本研究克隆获得PtrWRKY51基因,属Ⅱc 型WRKY转录因子,与胡杨(XM_011027286)进化关系最近。通过酵母自激活试验,证明PtrWRKY51转录因子具有自激活活性,亚细胞定位试验证明该基因位于细胞核中。启动子区顺式作用元件分析结果显示,区域内含有众多胁迫应答元件。植物遭受干旱时会导致脱落酸(ABA)快速积累,PtrWRKY51启动子区域内包含的4 个ABA 应答元件可能与其密切相关。此外,该基因还含有茉莉酸甲酯响应元件及水杨酸诱导元件,这些元件的存在表明毛果杨与拟南芥的WRKY51基因可能通过相似途径,即通过调控水杨酸和低油酸从而抑制茉莉酸产生,进而在植物抗逆方面发挥重要作用[25]。同时,番茄的SlWRKY51基因与油菜素(芸苔素)内酯的增加呈正相关;山新杨(Populus da⁃vidiana×P. albavar.pyramidlis)的PdPapWRKY51在各组织中均响应水杨酸的诱导,在不同生物及非生物因素诱导下各组织表达量呈现较大差异[26]。以上研究均说明WRKY51转录因子通过对植物各种激素,如赤霉素、茉莉酸、油菜素类固醇和乙烯等表达量的调控进而对其生长发育及抗逆方面进行调控,推测PtrWRKY51可能也通过对激素的调控从而进一步对胁迫进行反馈。
模拟干旱下基因表达量有明显变化,在茎与叶中被明显诱导上调,进一步表明PtrWRKY51可能参与了毛果杨在应对渗透胁迫时的信号传导。植物在面临各种非生物胁迫时会产生活性氧(ROS),从而阻碍植物的正常生长发育,为应对胁迫,植物会积累如脯氨酸、甘氨酸甜菜碱、多胺和糖等渗透剂来保护细胞,防止氧化应激引起的细胞损伤。渗透剂的积累受到植物激素如脱落酸、ABA、乙烯、茉莉酸和水杨酸的调节,这些激素之间互相有协同拮抗作用最终会抑制有害ROS的产生[25,27]。WRKY转录因子在许多植物中被证明参与了干旱胁迫的调控。转红薯(Ipomoea batatas)IbWRKY2基因的拟南芥在盐及干旱胁迫下通过激活ABA 途径及ROS 清除系统对胁迫进行调控[28];大豆(Glycine max)的GmWRKY16基因通ABA 介导途径增强转基因拟南芥的耐盐与耐干旱能力[29];小麦(Triticum aestivum)TaWRKY46通过ABA 依赖途径及ABA 不依赖途径共同提升耐旱性[30];玉米(Zea mays)ZmWRKY40基因通过提高过氧化物歧化酶(POD)和过氧化氢酶(CAT)活性降低转基因株系活性氧(ROS)含量进而对干旱胁迫进行调控[31];香蕉(Musa acuminata)的MaWRKY80调节NCEDs 表达来控制ABA 水平,通过调节抗氧化系统来调节ROS 的积累,从而起到抗干旱胁迫正向调节的作用[32]。这些研究均表明WRKY家族成员可以对ABA 及ROS 系统进行调控来应对干旱胁迫。根据已有研究,推测PtrWRKY51可能通过水杨酸、茉莉酸及ABA 之间的协同拮抗作用增强渗透剂的累积,从而降低或抑制ROS的生成,进而对干旱胁迫进行反馈。
本研究初步证明PtrWRKY51具有一定的抗旱能力,目前已成功构建过表达载体与抑制表达载体,后续将对该基因在杨树中发挥的作用与调控机制进行具体研究。研究不仅为毛果杨WRKY51基因在生物学及抗旱研究提供理论基础,同时也可为进一步揭开毛果杨抗逆分子机制提供更多的数据支撑。
