肋果沙棘和西藏沙棘转录因子bHLH94基因对海拔适应性分化的研究
2022-12-06张玉洁李雪丽
钱 婷 赵 凡 张玉洁 李雪丽 孙 坤 张 辉
(西北师范大学生命科学学院,兰州 730070)
碱性螺旋—环—螺旋(bHLH)转录因子是最大转录因子家族之一,其广泛存在于真核生物中[1]。bHLH 转录因子因含有bHLH 结构域而命名,其结构域主要由保守的60 个氨基酸残基组成[2]。根据功能的不同,bHLH 结构域可以分为两部分:碱性区域和HLH 区域。碱性区域分布在bHLH 保守结构域的N 末端,包含15~20 个与DNA结合相关的残基;HLH 结构域分布在bHLH 结构域的C 末端,由两个α螺旋组成,是bHLH 转录因子中同源或异源二聚体形成必不可少的结构[2]。根据系统发育研究,动物中的bHLH转录因子主要分为A~F六类[2]。根据结构域、表达模式及转录功能,前人将bHLH 转录因子分为Ⅰ~Ⅶ七类[3]。植物中的bHLH转录因子虽然还没有明确定义,但是越来越多植物bHLH亚家族基因已得到鉴定[1]。
在植物体内,bHLH 转录因子主要参与植物生长发育调控,如花形态发生、气孔细胞分化和保卫细胞形成等[2]。此外,研究表明,bHLH转录因子可与其他转录因子协同调控多种次级代谢产物的生物合成及诱导途径,主要包括萜类、生物碱、苯丙素、花青素等,这些次级代谢产物在调节植物对逆境胁迫的响应中起着至关重要的作用[4]。例如:苹果(Malus pumila)中MdbHLH3过表达,花青素积累增加,提高苹果耐寒性[5];龙血树(Dracaena cambodiana)中,DcbHLH5通过参与植物黄酮类化合物合成途径,减少辐射对DNA和蛋白质等大分子的损伤[6]。研究发现,bHLH 转录因子也可通过调控植物激素信号通路,响应植物逆境胁迫。例如:在拟南芥(Arabidop⁃sis thaliana)中,AtbHLH122在保卫细胞过表达,抑制脱落酸(ABA)的分解代谢,从而增强拟南芥的耐旱性,该基因通过调节脯氨酸的积累及丙二醛的降解提高拟南芥耐盐性[7];在水稻(Oryza sativa)中,OsbHLH148基因通过调节茉莉酸(JA)信号通路及OsJAZ蛋白的功能,提高水稻耐旱性[8]。
青藏高原伴随着强风、强紫外辐射、低氧和低温等极端的环境特征,分布在青藏高原的植物长期受低温和强紫外辐射等环境的影响,形态特征和生理生化方面发生了不可逆转的变化,这些变化也体现在基因层面上[9]。沙棘属(Hippophae)植物分为无皮组和有皮组,无皮组分布范围广泛,海拔在550~3 000 m;有皮组集中分布于青藏高原及边缘地区,海拔在3 000~5 200 m,在高山河谷、高原河漫滩地或高山草甸形成大片的沙棘灌丛[10]。肋果沙棘(H. neurocarpa)是青藏高原隆起过程中形成的适应寒冷环境的有皮组一员,其生长的海拔为2 700~4 300 m[10]。为适应高海拔极端环境,肋果沙棘演化出晴天爆发式集中开花机制、长距离风媒散粉机制[11]和增强抗氧化酶活性适应强辐射环境的生理特征[12]。西藏沙棘(H. tibetana)生长于海拔2 700~5 200 m 的河滩及高山草地,是青藏高原隆起之前就存在的最古老的有皮组一员。西藏沙棘具有高山植物形态上最典型的表型特征,即矮生性[13]。研究表明,相比于肋果沙棘,西藏沙棘在形态及生理等特征上更进化[13]。
目前,肋果沙棘和西藏沙棘适应高海拔环境的研究主要集中于表型分析[10,13],就基因层面阐述肋果沙棘和西藏沙棘海拔适应性的研究还有待深入。因此,对不同海拔梯度下的肋果沙棘和西藏沙棘进行转录组测序,筛选出受到正选择作用的转录因子bHLH94基因,基于bHLH94基因在肋果沙棘和西藏沙棘内基因表达量和功能两方面的研究分析其在2 种沙棘中的适应性分化及对海拔的响应机制。
1 材料与方法
1.1 试验材料
采集青海省不同海拔梯度下长势相同的肋果沙棘与西藏沙棘嫩叶作为研究材料,将沙棘嫩叶立即放入液氮进行冷冻。试验设置3 个生物学重复,采样具体信息见表1。

表1 沙棘属植物采集地信息Table 1 Collection information of Hippophae
1.2 数据来源
Phytozome 数 据 库(https://phytozome.jgj.doe.gov/pz/portal.html);NCBI 数据库(https://www.ncbi.nlm.nih.gov/);TAIR 数据库(https://www.arabidop⁃sis.org/index.jsp);Picea abies 数据库(https://conge⁃nie.org/)[9](见表2)。

表2 植物系统进化树关键节点物种蛋白质序列数据来源Table 2 Sources of protein sequence data from the key nodes of the phylogenetic tree of plants
1.2 方法
1.2.1 RNA-Seq测序数据及正选择基因的筛选
采用RNA plant Plus 试剂分别提取不同海拔梯度下的肋果沙棘和西藏沙棘新鲜嫩叶总RNA,基于二代测序技术中的Illumina 平台对不同海拔下的2 种沙棘进行转录组测序。筛选2 种沙棘中正选择作用基因:基于OrthoMCL 找出的直系同源基因对,用paml-codeml 计算Ka/Ks 值(即ω),ω>0.5 即受到正选择作用的基因[14],选择受正选择作用的转录因子bHLH94基因为目的基因。
1.2.2 2种沙棘bHLH94基因克隆
PCR 扩增目的基因:利用Prime ScriptTMⅡ1st Strand cDNA Synthesis Kit 反转录试剂盒对样品总RNA 进行反转录,得到cDNA 样品。PCR 反应总体 系25.0 μL:cDNA 为1.0 μL,2×EasyTaqPCR Master Mix 为12.5 μL,正 反 向 引 物 各1.0 μL,ddH2O 为9.5 μL。PCR 反应条件为:94 ℃预变性40 s;98 ℃变性10 s;50 ℃退火40 s;72 ℃延伸1 min,35 个循环,引物序列见表3。将扩增结果用Sanger 法测序并利用Chromas 软件分析测序结果并导出[9]。

表3 PCR和qRT-PCR所用引物Table 3 Primers used in PCR and qRT-PCR
1.2.3 荧光定量PCR验证基因表达量
根据所获得的肋果沙棘和西藏沙棘bHLH94基因序列,设计荧光定量专用引物,将反转录得到的所有样品cDNA 稀释为50 ng·μL-1,并以此为模板,按照TB Green Premix Ex TaqTMⅡ(Tli RNaseH Plus)荧光定量PCR 试剂盒进行荧光定量试验。反应总体系20.0 μL:cDNA 为2.0 μL,上下游引物各为0.8 μL,ddH2O 为6.0 μL,TB Green Premix ExTaqⅡ(Tli RNaseH Plus)为10.0 μL,ROX Refer⁃ence Dye 为0.4 μL。反应在ABI PRISM 7500 实时定量聚合酶链式反应(PCR)仪上进行,反应程序:95 ℃预变性30 s;95 ℃变性5 s;60 ℃退火34 s;40个循环。每个样本设置3 个生物学重复,并进行3次技术重复,采用2-ΔΔCT法计算HnbHLH94和Htb⁃HLH94基因的相对变量值,内参基因为鼠李沙棘actin基因[15]。肋果沙棘、西藏沙棘及内参基因ac⁃tin的荧光定量引物序列见表3。
1.2.4 生物信息学分析
蛋白质结构分析:选择同源性最高且e值最小的BLAST 结果,用DNAstar 软件中的Editseq 和Se⁃qbuilder 程序截取目的基因CDS 区并翻译为氨基酸序列[9]。利用ProtParam(http://www.expasy.org/tools/protparam.html)工具分析蛋白质的分子量、等电点、亲疏水性等基本理化性质。利用PSORT(https://psort.hgc.jp/)预测蛋白质的核定位信号。利用TMHMM sever 2.0(http://www.cbs.dtu.dk/ser⁃vices/TMHMM-2.0/)和SignalP 5.0(http://www.cbs.dtu.dk/services/SignalP/)预测蛋白质的跨膜结构域和信号肽。将氨基酸序列提交到Zhanglab 网站的I-TASSER(http://zhanglab.ccmb.med.umich.edu/ITASSER)进行三级结构预测,并用VMD 可视化软件分析蛋白质结构。
直系同源基因筛选:在Windows 系统下进行本地BLAST 抽提13 个位于植物系统进化树上的关键节点物种bHLH94转录因子同源蛋白序列,过滤条件为e<10-6。
2 结果与分析
2.1 RNA-Seq测序数据及正选择基因筛选
通过转录组测序共获得190.01 Gb 的clean bases,各样品的GC 含量均在41%以上,Q30碱基比例均大于91%,表明转录组测序数据量丰富、质量较高。数据组装后,共获得1 561 185 条unigene,其中长度在1 kb 以上的unigene 有133 402 条(见表4)。paml 计算沙棘属植物转录因子bHLH94基因ω值为0.75 679,表明2 种沙棘在适应高海拔环境的分化过程中,转录因子bHLH94基因受到正选择作用。

表4 2种沙棘unigenes组装结果统计Table 4 Statistics of the assembly results of unigenes of H.neurocarpa and H.tibetana
2.2 bHLH94基因在2种沙棘中的克隆
PCR 扩增HnbHLH94和HtbHLH94基因,利用Sanger 测序对二代测序结果进行验证,结果发现HnbHLH94基因Sanger 测序结果和二代测序结果在565~575 位点和第597、885 位点碱基存在差异,HtbHLH94基因Sanger测序结果和二代测序结果在第867 位点碱基存在差异。以Sanger 测序结果为准,利用DNAstar 软件中的Seqbuilder 与Editseq 程序获得HnbHLH94和HtbHLH94基因的CDS 区。HnbHLH94基因的CDS 区全长1 017 bp,共编码338个氨基酸。HtbHLH94基因的CDS区全长1 008 bp,共编码335个氨基酸。

图1 HnbHLH94和HtbHLH94基因二代测序序列和Sanger测序结果比对红色框为Sanger测序结果与二代测序结果的差异碱基位点Fig.1 HnbHLH94 and HtbHLH94 next-generation sequencing sequence was compared with the Sanger sequencing results The difference between the Sanger sequencing results and the next-generation sequencing results in red boxes
2.3 2种沙棘bHLH94蛋白及拟南芥同源蛋白序列比对
HnbHLH94 和HtbHLH94 蛋白序列比对,二者存在10 个非同义突变位点。利用NCBI 网站的BLASTX 程序查找HnbHLH94基因和HtbHLH94基因的同源蛋白质序列,发现二者均与Carya illinoi⁃nensis的假设蛋白序列相似性最高,E 值分别为2E-125、2E-123,序列覆盖度分别为76%、70%。Hnb⁃HLH94 和HtbHLH94 蛋白与鼠李科Ziziphus jujuba的bHLH94 蛋白相似度也很高,E 值分别为1E-69、1E-66,序列覆盖度分别为76%、70%。利用本地BLAST 检索拟南芥中与HnbHLH94、HtbHLH94 同源的蛋白序列,选择同源性最高且E值最小的ATb⁃HLH94和ATbHLH96蛋白,NCBI 和pfam 等网站预测HnbHLH94、HtbHLH94 及拟南芥ATbHLH94、ATbHLH96转录因子的功能结构域,发现该类转录因子转录激活域缺失,只有DNA 结合结构域。如图2所示,沙棘属HnbHLH94、HtbHLH94和拟南芥ATbHLH94、ATbHLH96转录因子DNA 结合结构域存在3 个氨基酸差异位点,其他位点均一致,说明bHLH94转录因子的DNA结合结构域非常保守。

图2 HnbHLH94、HtbHLH94及拟南芥的bHLH94、bHLH96蛋白氨基酸序列红色框为HnbHLH94与HtbHLH94蛋白氨基酸差异位点Fig.2 Amino acid sequence of bHLH94 and bHLH96 in Arabidopsis thaliana and HnbHLH94 and HtbHLH94 Differential amino acid sites of HnbHLH94 and HtbHLH94 in red boxes
2.4 HnbHLH94 和HtbHLH94 蛋白系统进化树分析
基于NCBI 和Phytozome 等网站,下载植物系统进化树关键节点的13 个陆生植物蛋白序列数据。本地BLAST结果显示,藻类植物Chlamydomo⁃nas reinhardtii和裸子植物Picea abies中没有bHLH94基因的同源蛋白质。将其他11 个物种中共得到13 条同源蛋白质序列与本研究中的Hnb⁃HLH94 和HtbHLH94 蛋白序列构建系统进化树。分析得到,该基因在物种进化过程中相对保守。

图3 最大似然法构建bHLH94蛋白的系统进化树该系统进化树中支持率小于50的均未显示Fig.3 Phylogenetic tree for bHLH94 proteins by Maximum likelihood method The support rate of less than 50 is not shown in this phylogenetic tree
2.5 HnbHLH94 和HtbHLH94 蛋白三维结构预测及理化性质分析
Zhanglab 网 站I-TASSER 进 行HnbHLH94 和HtbHLH94 蛋白质三级结构预测,并用VMD 软件分析HnbHLH94和HtbHLH94蛋白质三维结构,发现HnbHLH94 和HtbHLH94 蛋白的α螺旋、β折叠等空间结构特征基本相同,二者三级结构高度相似。ProtParam 网站分析HnbHLH94 和HtbHLH94理化性质,得到HnbHLH94和HtbHLH94的分子式分别为:C1677H2640N474O536S17,C1678H2633N475O533S16;分子质量分别为:38 563.28、38 502.19;等电点分别为:5.25、5.41;利用ProtScale 网站分析HnbHLH94 和HtbHLH94 蛋白的亲疏水性,二者均为亲水蛋白。PSORT 网站分析HnbHLH94 和HtbHLH94 在细胞中的定位,结果显示二者均位于细胞核内。TMHMM sever 2.0 和SignalP 5.0 分 析 发 现Hnb⁃HLH94 和HtbHLH94 没有跨膜结构域和信号肽,说明二者不属于分泌蛋白。
2.6 bHLH94基因在2种沙棘中的表达量分析

图4 bHLH94蛋白质三级结构预测绿色部分为DNA binding domain;A.HnbHLH94 蛋白三级结构Surf模型,B.HtbHLH94蛋白三级结构Surf模型Fig.4 Predicted results of the tertiary structure of bHLH94 protein The green part is DNA binding domain;A.Surf model of tertiary struc⁃ture of HnbHLH94 protein;B.Surf model of tertiary structure of Htb⁃HLH94 protein
FPKM 同时考虑了测序深度和基因长度对fragments 计数的影响,是目前最为常用的基因表达水平估算方法。在本研究中,通过二代测序,将readcount数进行FPKM 转换,以FPKM 值来表示基因的表达量水平[9]。bHLH94基因在肋果沙棘和西藏沙棘的FPKM 均值分别为1.780、9.493。用SPSS数据分析软件对HnbHLH94和HtbHLH94基因FP⁃KM 值进行单因素方差分析,二者FPKM 值差异显著(P<0.05)。以海拔为横坐标,FPKM 值为纵坐标对HnbHLH94和HtbHLH94基因FPKM 值作线性回归分析,结果显示,HnbHLH94基因的FPKM 值随着海拔的升高而减小,R2值为0.5027。Htb⁃HLH94基因的FPKM 值随着海拔的升高而增大,R2值为0.998 6。实时荧光定量PCR的结果表明,Hn⁃bHLH94基因表达量随着海拔的升高呈现下降趋势,HtbHLH94基因表达量随着海拔的升高呈现上升趋势,这与HnbHLH94和HtbHLH94基因FPKM值随海拔升高所表现的趋势一致。
3 讨论
3.1 bHLH94 基因在2 种沙棘中的序列结构及在陆生植物中的系统进化
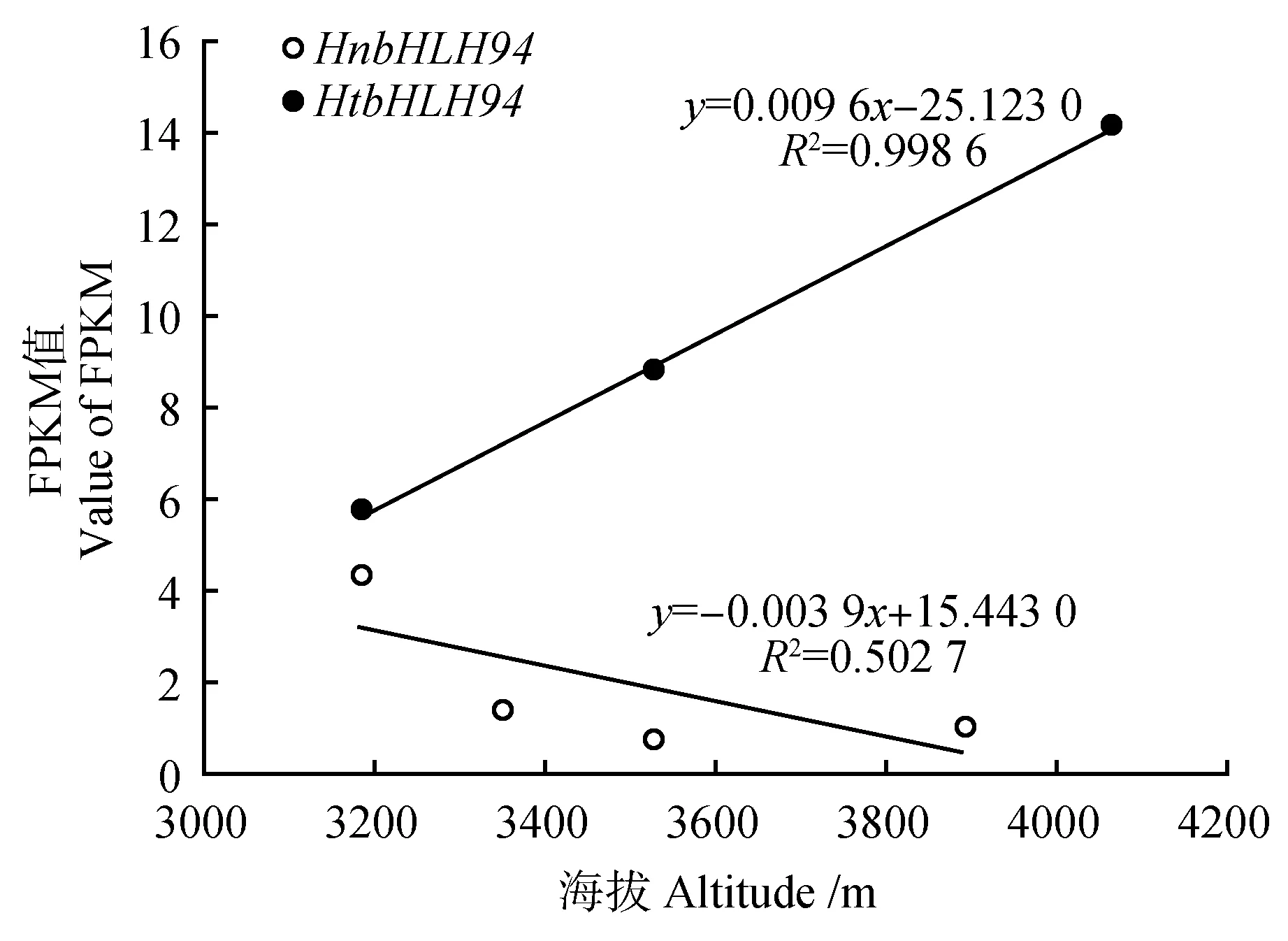
图5 HnbHLH94和HtbHLH94不同海拔下的FPKM 值Fig.5 FPKM values of HnbHLH94 and HtbHLH94 at different altitudes
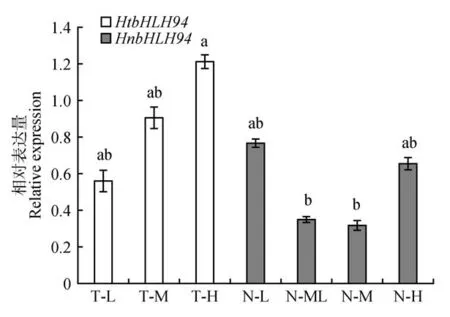
图6 基于qRT-PCR 技术检测HtbHLH94 和HnbHLH94在不同海拔下的基因表达量a,b 代表不同海拔下两个物种bHLH94 基因表达量的差异显著性(P<0.05)Fig.6 Gene expression at different altitudes of HnbHLH94 and HtbHLH94 based on the qRTPCR technology a,b represents the significant difference in bHLH94 gene expression between the two species at different altitude(sP<0.05)
植物为了适应高海拔低温、强辐射等极端环境,不仅在结构和生理功能上表现出独特的适应性,还基于一系列基因的进化来响应逆境胁迫[9]。本研究对肋果沙棘HnbHLH94基因和西藏沙棘Ht⁃bHLH94基因的碱基序列进行比对,发现有多个碱基突变位点,且二者DNA 结构域之外存在10 个非同义突变位点,推测这可能会造成HnbHLH94 和HtbHLH94蛋白二聚体存在差异,目前尚不清楚这10 个非同义突变位点对海拔的适应性有无贡献。生物信息学分析表明,HnbHLH94和HtbHLH94基因 分 别 编 码338 和335 个 氨 基 酸,HnbHLH94 和HtbHLH94 蛋白没有转录激活域,只有DNA 结合结构域。Murre等学者将bHLH转录因子根据结构域划分为Ⅰ~Ⅶ七类,其中第Ⅳ类为MAD和MAX,这类转录因子转录激活域缺失,只有DNA 结合结构域,可与MYC 二聚并调节其活性[3],这与本研究的HnbHLH94 和HtbHLH94 转录因子结构相似。虽然没有转录激活域,但是MAD/MAX能相互形成同源或异源二聚体,以不同的方式影响转录途径,促进细胞增殖及程序性死亡[16]。推测HnbHLH94和HtbHLH94 转录因子也有类似的二聚体形成途径。
进一步将HnbHLH94 和HtbHLH94 蛋白序列与植物系统进化树关键节点上的13个物种同源蛋白序列进行比对,其中在衣藻科的Chlamydomo⁃nas reinhardtii和欧洲云杉(Picea abies)中未发现bHLH94 的同源蛋白,将其他11 个陆生植物中找到的bHLH94 同源蛋白与HnbHLH94、HtbHLH94蛋白序列进行比对,发现该转录因子结构域五个氨基酸残基(His-5,Glu-9,Arg-10,Arg-12 和Arg-13)形成了碱性部位,且该碱性部位的亮氨酸(Leu-23)非常保守,表明该残基对促进bHLH 蛋白二聚体的形成非常重要,这与以往研究结果一致[1]。bHLH 转录因子通过其bHLH 结构域相互作用形成同源或异源二聚体,然后通过二聚体中的保守碱性区域与特定的DNA序列进行结合进而调控靶标基因的表达[17]。推测,本研究中,Hnb⁃HLH94 和HtbHLH94 蛋白形成二聚体后结合相同的DNA 序列从而调控靶基因的表达。研究表明,藻类中的bHLH 转录因子非常少,而大量的bHLH转录因子出现于苔藓和维管植物分化之前的陆生植物中,并推测bHLH蛋白多样化与植物登陆对干旱环境的适应有关[18]。本研究在颤藻属的Oscilla⁃toria acuminate、小球藻属的Chlorella variabilis和紫菜(Neoporphyra haitanensis)等藻类植物均未发现bHLH94 转录因子的同源蛋白序列。这与Pires等学者研究结果[18]一致。而在银杏(Ginkgo bi⁃loba)、买麻藤(Gnetum montanum)和苏铁(Cycas revoluta)等裸子植物中也未发现bHLH94 转录因子的同源蛋白序列。初步判断,bHLH94转录因子在裸子植物中丢失,且该蛋白响应干旱胁迫。
3.2 2 种沙棘中bHLH94 基因的表达对高海拔环境的响应机制
3.2.1 bHLH94 基因可能参与2 种沙棘干旱胁迫途径
HnbHLH94 和HtbHLH94 蛋白与拟南芥Atb⁃HLH94 和AtbHLH96 蛋白高度同源,可能与Atb⁃HLH94 和AtbHLH96 蛋白具有相似的生物学功能。研究发现AtbHLH94 和AtbHLH96 蛋白属于拟南芥bHLH 转录因子家族中的Ia 类,该类转录因子主要参与植物气孔发育机制[19]。bHLH94基因在肋果沙棘和西藏沙棘中参与气孔发育合成途径。研究表明,胡杨(Populus euphratica)中,Peb⁃HLH35基因通过调节气孔发育和光合作用提高其对干旱胁迫的耐受性[20]。苹果MdbHLH130基因通过维持活性氧(ROS)稳态和诱导气孔关闭提高植物耐旱性[21]。拟南芥保卫细胞中bHLH122基因过表达,抑制脱落酸(ABA)的分解代谢,从而提高植物对干旱胁迫的耐受性[7]。当气候变冷时,通常伴随大范围的干旱,只有冰雪融化时,才能给生长在我国西北干旱半干旱地区的沙棘属植物提供所需水分[22-23]。当青藏高原迎来阶段性干旱时,bHLH94基因可能参与肋果沙棘和西藏沙棘对干旱环境的胁迫响应途径。
3.2.2 bHLH94 基因可能在2 种沙棘耐冷机制中扮演重要角色
bHLH 转录因子在植物对寒冷胁迫的响应中起积极作用[24]。研究发现,水稻OsbHLH1基因参与植物冷胁迫信号通路,其过表达显著提高转基因拟南芥冷胁迫的耐受性[25]。烟草(Nicotiana tabacum)中,NtbHLH123基因过表达,降低了丙二醛含量、H2O2和活性氧(ROS)的积累,有助于缓解冷胁迫对转基因烟草细胞膜的氧化损伤[26]。山葡萄(Vitis amurensis)VabHLH1和葡萄(Vitis vinifera)VvbHLH1基因在转基因拟南芥中过表达,激活CBF(C-重复结合因子)冷信号通路,增强其对寒冷的耐受性[27]。生长在青藏高原的沙棘属植物常面临低温胁迫。研究发现,不同品种沙棘的抗寒能力具有差异,但抗寒响应机制相同[22]。推测bHLH94基因在肋果沙棘和西藏沙棘中可能参与低温胁迫响应途径。
3.2.3 bHLH94 基因可能参与2 种沙棘对辐射的响应途径
辐射是高原植物必须应对的胁迫之一,海拔越高辐射越强,强烈的辐射会造成植物DNA、RNA及蛋白质损伤。当高原植物受到紫外辐射后,体内积累大量的黄酮类化合物,以此来减少辐射对核酸、蛋白等大分子的破坏[28]。Wang 等研究表明bHLH 转录因子Ascl1基因过表达,激活基质金属蛋白酶-7(MMP-7)和甲基鸟嘌呤-DNA甲基转移酶(MGMT),增强DNA 的损伤修复水平[29]。Pablo 等学者研究表明UV-B 辐射可显著提高葡萄果皮黄酮醇的积累,并鉴定3 个响应UV 辐射的bHLH基因[30]。龙血树DcbHLH2、DcbHLH5和DcbHLH56基因参与类黄酮的生物合成,DcbHLH5和黄酮类合成相关基因在UV 辐射条件下共表达[6]。本研究中,肋果沙棘和西藏沙棘响应高海拔辐射胁迫时,bHLH94基因可能参与DNA 损伤修复机制,也可能与黄酮类化合物的合成机制有关。
3.2.4 2 种沙棘中bHLH94 基因对海拔的适应机制
大量研究表明,植物在应对干旱、低温及高辐射等极端环境时,bHLH基因发挥着重要作用。肋果沙棘和西藏沙棘在适应青藏高原极端多变的环境时,bHLH94基因可能参与高海拔伴随的干旱、低温及强辐射等胁迫途径。西藏沙棘海拔分布上限显著高于肋果沙棘。基于形态及生理等特征的研究,肋果沙棘较原始,西藏沙棘更进化,且二者适应海拔的机制不同[10,13]。本研究发现肋果沙棘HnbHLH94基因和西藏沙棘HtbHLH94基因的FP⁃KM 值差异显著(P<0.05),HnbHLH94基因FPKM值随着海拔的升高而减小,而HtbHLH94基因的FPKM 值随着海拔的升高而增大。可见,相比于肋果沙棘,西藏沙棘通过上调HtbHLH94基因来适应更高海拔伴随的干旱、冷冻及强辐射环境。
综上所述,本研究从序列结构和表达调控两个方面分析了受环境选择的转录因子bHLH94功能基因在肋果沙棘和西藏沙棘中对高海拔环境适应机制的异同,为沙棘属植物适应海拔的分化机制及逆境响应相关基因的开发提供数据基础。
