盐碱土壤冬枣根际微生物多样性分析
2022-12-05朱家瑞李新岗石国朝杨桂燕
朱家瑞,李新岗,石国朝,杨桂燕
(西北农林科技大学 林学院,陕西 杨凌 712100)
气候变化、过量使用化肥等因素使得土壤盐碱化逐年加剧[1]。据统计,世界上已有超过1.1×109hm²的盐碱土地,且此数据仍在逐年增加[2]。我国盐碱土地的总面积为3.7×107hm2,广泛分布于从滨海到内陆的多个地区,其在西北内陆地区的分布最为密集,该地区的盐碱土地面积占全国盐碱土地总面积的13%以上[3-4]。在人口增加和气候变化的背景下,我国土地资源面临短缺问题,如何更加合理高效地利用盐碱土地已成为人们关注的热点问题。
冬枣Ziziphus jujubaMill.cv.Dongzao 是原产于我国的优质耐盐碱果树,主要种植于黄河中下游的山东、陕西、河北、山西等沿河沿海盐碱地区[5-7]。陕西省大荔县冬枣产区有超过90%的设施冬枣园土壤为碱性土壤,具有较高的土壤盐分[8]。虽然枣树耐盐,但过高的盐分会使其生长发育受损,进而会影响其产量和品质[9-10]。
土壤微生物是土壤中最活跃的组分,植物根际土壤中的微生物与植物的关系最为密切[11],每种植物都有特定的根际微生物组群[12-13]。有关研究结果表明,微生物能够通过多种途径减轻土壤盐分对植物的负面影响[14-15]。微生物在土壤养分保持(包括盐保护在内)、植物养分获取和植物病原防御等方面都扮演着重要角色[16-17]。土壤微生物群落中不同的微生物之间具有复杂的互作关系,这种互作关系可以影响整体群落对各种胁迫的响应,微生物共现性网络(Co-occurrence network)常被用来表征群落中微生物之间的互作关系[18]。
近年来,我国学者对不同植物根际微生物[19-20]和不同地区盐碱土壤中的微生物[21-22]进行了大量研究。然而,关于冬枣根际土壤中微生物的研究多集中在根际促生菌及其应用方面[23-25],而对盐碱土壤中冬枣根际微生物群落的研究报道并不多见。为此,本研究以不同土壤盐分条件下的冬枣根际土壤为研究对象,利用Illumina-MiSeq 高通量测序技术研究冬枣根际土壤中细菌及真菌的多样性,预测微生物群落的功能,构建微生物共现性网络,以期了解盐碱条件下冬枣根际微生物的群落结构特征,揭示盐碱条件下冬枣根际不同微生物之间的互作关系,从而为盐碱地冬枣优质高效栽培、盐碱土壤改良和利用奠定基础。
1 材料与方法
1.1 材 料
试验地设在陕西省大荔县设施冬枣产区,其地理位置为北纬34°36′~35°02′,东经109°43′~110°19′。大荔县地处陕西中东部黄河沿岸,属暖温带季风气候,年均温14.4 ℃,年降水量514 mm,年无霜期214 d。根据2018—2020年大荔县土壤养分的检测结果[8],选取栽培管理措施一致、经营状况良好、土壤肥力状况相似而土壤盐分条件不同的冬枣园21 个,根据土壤盐分含量等级,又将21 个冬枣园细分为低盐(7 个)、中盐(8 个)、高盐(6 个)3 类。
1.2 土壤样品的采集与处理
2021年4月于选取的冬枣园中采集土壤样品。在每个枣园中按照五点取样法各选取5株长势一致、生长状况良好且无病虫害的冬枣样树。分别在每株样树周围的三侧取深度为0 ~20 cm 的根际土壤样品,然后将5 株样树的根际土壤样品混合为该枣园的土壤样本,带回实验室。将土壤样品又分为2 份:1 份用作提取土壤DNA 的样品,将此份样品立即存放入-80 ℃的冰箱中,用于高通量测序;另一份样品,在测定其含水量之后风干过筛,用于测定土壤基本理化性质。将采集的21 个冬枣园的所有土壤样本分为3 个组,即低盐组、中盐组、高盐组。
1.3 土壤理化性质的测定与DNA 测序
使用pH 计(PHS-3C,雷磁)测定土壤pH 值,利用电导率仪(DDBJ-350,雷磁)测定电导率(浸提液∶土壤样品=5∶1);采用凯氏定氮法测定全氮含量;采用外加热重铬酸钾容量法测定有机质含量;利用氯化钾浸提-连续流动分析仪测定硝态氮和铵态氮的含量;利用0.5 mol/L 的NaHCO3浸提-流动分析仪测定有效磷含量;采用1.0 mol/L的NH4OAc 浸提-火焰光度法测定速效钾含量。采用CTAB(溴代十六烷基三甲胺)法提取土壤总DNA,经凝胶电泳检测后进行PCR 扩增,然后在Illumina NovaSeq PE250 平台上进行测序。
1.4 数据分析与制图
使用FLASH(V1.2.7)和QIIME(V1.9.1)软件,将测序得到的下机数据进行数据拼接和质控处理,运用UCHIME 算法进行嵌合体过滤,得到有效数据。对所有样本进行OTU(Operational Taxonomic Units,可操作分类单元)聚类(一致性97%)分析,然后对OTU 进行注释。采用QIIME 软件分析土壤样本的序列数据,计算各样本的Alpha 多样性指数和Beta 多样性指数;采用PICRUSt 和FunGuild软件进行功能预测分析。
采用SPSS25 软件进行差异显著性分析;采用R(V4.1.2)软件制图;采用Cytoscape(V3.8.2)软件进行共现性网络(Co-occurrence Network)可视化操作。
1.5 序列数据的上传
冬枣根际土壤微生物测试序列数据已上传于国家微生物科学数据中心(National Microbiology Data Center,NMDC),其正式编号为NMDC10017986。
2 结果与分析
2.1 土壤理化性质分析
3 组冬枣根际土壤样本理化性质的测定结果见表1。表1表明,不同组别的冬枣根际土壤样本间电导率的差异显著(P<0.05)。低盐组土壤的电导率平均为260.86 μS/cm,说明此类枣园土壤属轻度偏低盐化土壤;中盐组土壤的电导率平均为475.08 μS/cm,说明此类枣园土壤属轻度偏高盐化土壤;高盐组土壤的电导率平均为730 μS/cm,说明此类枣园土壤属中度偏高盐化土壤。3 组土壤样品的pH 值为8.09 ~9.46,说明所调查的3 类枣园的土壤分别属碱性及强碱性土壤。其中,中盐组土壤有效磷的含量均值为331.42 mg/kg,高于低盐组的211.84 mg/kg 及高盐组的231.95 mg/kg,但其差异不显著。不同类别枣园间土壤样品中全氮、有机质、速效钾及硝态氮、铵态氮的含量均无显著差异。

表1 3 组冬枣根际土壤样本理化性质的测定结果†Table 1 Determination of physicochemical properties of rhizosphere soil samples from three groups of winter jujube
2.2 OUT 及多样性分析
高通量测序结果表明,所有样本的覆盖率(Goods coverage)均在98%以上(表2),各组稀释曲线接近平稳(图1),表明测序深度符合要求,可以反映样本的真实情况。细菌OTU 数目的分布范围为2 312 ~3 370 个,真菌OTU 数目的分布范围为541 ~1 394 个。物种注释结果显示,从所有土壤样本中共检出细菌门76 个、纲155 个、目351 个、科479 个、属773 个,真菌门16 个、纲65 个、目168 个、科383 个、属840 个。不同组别的土壤样本间土壤细菌的有效序列数和OTU数目均无显著差异,低盐组土壤样本中真菌的有效序列数及OUT 数目均显著高于中盐及高盐组土壤样本的(P<0.05)。

图1 3 组冬枣根际土壤样本中细菌和真菌的稀释曲线Fig.1 Dilution curves of bacteria and fungi in rhizosphere soil samples from three groups of winter jujube
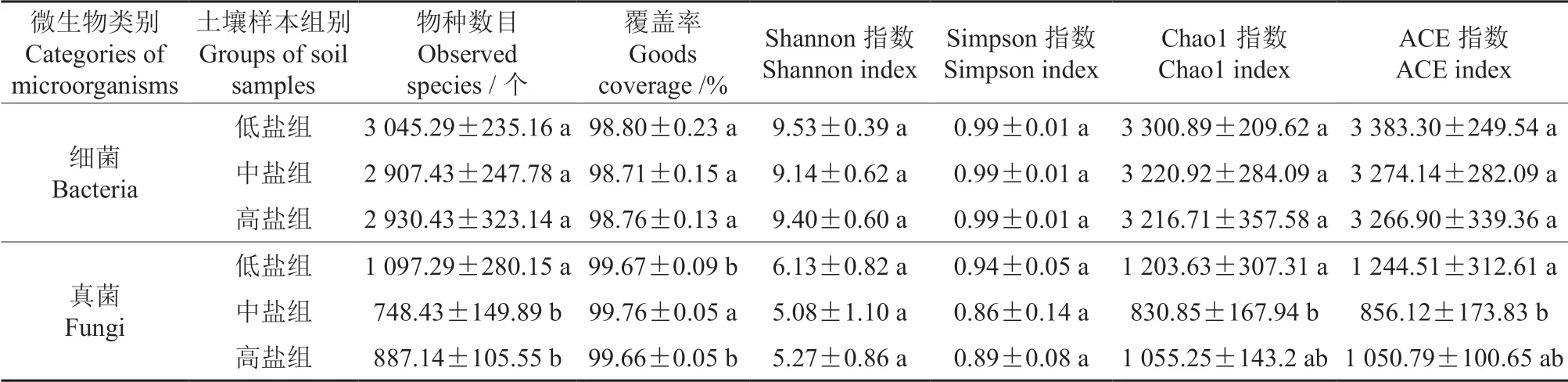
表2 3 组冬枣根际土壤样本的微生物Alpha 多样性指数†Table 2 Microbial Alpha diversity index of rhizosphere soil samples from three groups of winter jujube
分析不同组别土壤样本中OTU 各个组成成分的相互关系,构建了其细菌与真菌分布的韦恩图,结果如图2所示。3 组土壤样本中的细菌共有的OTU 数目为4 286 个,低盐、中盐、高盐组土壤样本中的细菌特有的OTU 数目分别为1 229、1 145、917 个;3 组土壤样本中的真菌共有的OTU数目为1 377 个,低盐、中盐、高盐组土壤样本中的真菌特有的OTU 数目分别为1 320、565、437 个。3 组土壤样本中的细菌与真菌特有的OTU 数目由大到小均依次为低盐组>中盐组>高盐组。
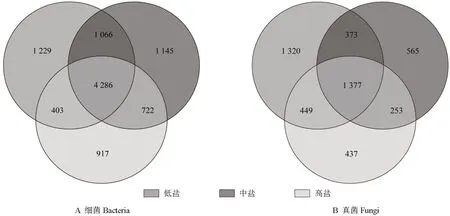
图2 3 组冬枣根际土壤样本中细菌和真菌的基于OUT 数目的韦恩图Fig.2 Venn diagram based on OUT number of bacteria and fungi in rhizosphere soil samples from three groups of winter jujube
本研究选取Shannon 指数、Simpson 指数、Chao1 指数和ACE 指数进行Alpha 多样性分析,分析结果见表2。表2显示,3 组土壤样本间冬枣根际细菌Alpha 指数的差异不显著;而其真菌Alpha 多样性指数均表现为低盐组>中盐组>高盐组,其中,低盐组的物种数目和Chao1、ACE 指数均显著高于中盐组的(P<0.05)。这表明中盐条件下真菌的多样性显著低于低盐条件下的,而随着盐分的增加,真菌多样性指数再次增加。
基于非权重的UniFrac 分析,即利用各样品序列间的进化信息,分析不同样本之间微生物群落的差异显著性。采用主坐标分析(principal coordinates analysis,PCoA)方法先对分析得到的unweighted-UniFrac 距离进行可视化处理,再分析3 组冬枣根际土壤样本中细菌和真菌的Beta 多样性,结果如图3所示。图3显示,3 组冬枣根际土壤样本中细菌和真菌的Beta 多样性均表现为低盐组>中盐组>高盐组,其中,低盐组的均显著高于中盐组和高盐组的(P<0.05)。图3显示,中盐组与高盐组接近重合,而与低盐组具有较大差异。
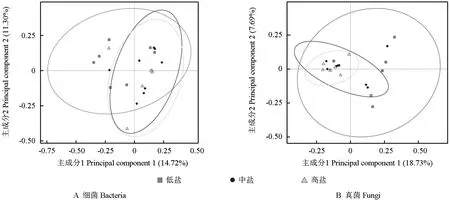
图3 3 组冬枣根际土壤样本中细菌和真菌的主坐标分析(PCoA)结果Fig.3 Principal coordinate analysis (PCoA) of bacteria and fungi in rhizosphere soil samples from three groups of winter jujube
2.3 微生物群落在门水平上的组成分析
3 组冬枣根际土壤样本中细菌和真菌在门水平上的相对丰度如图4所示。图4A 显示,3 组冬枣根际土壤样本中,排名前10 位的细菌门数占所有细菌总门数的比例为84.9%,优势细菌群落为变形菌门Proteobacteria,其群落数占所有细菌群落总数的30.88%,其中,总丰度超过5%的细菌群落分别为酸杆菌门Acidobacteriota(9.82%)、放线菌门Actinobacteriota(9.76%)、厚壁菌门Firmicutes(6.99%),总丰度超过1% 的细菌群落分别为绿弯菌门Chloroflexi(2.98%)、Bacteroidota 门(2.87%)、泉古菌门Cyanobacteria(2.50%)、拟杆菌门Myxococcota(2.38%)及蓝细菌门Crenarchaeota(1.23%);低盐组、中盐组和高盐组冬枣根际土壤样本中,排名前10位的细菌门数占所有细菌总门数的比例分别为84.3%、84.8% 与85.7%。图4B 显示,3 组冬枣根际土壤样本中,总丰度排名前10 位的真菌门数占所有真菌门总数的比例为81.1%,优势真菌群落为子囊菌门Ascomycota,其群落数占真菌群落总数的61.03%,总丰度超过5%的真菌群落分别有被孢霉门Mortierellomycota(7.44%)、壶菌门Chytridiomycota(5.52%)和担子菌门Basidiomycota(5.41%)。 此外,还检测到丰度较低的捕虫霉门Zoopagomycota(0.76%)、梳霉门Kickxellomycota(0.14%)、球囊菌门Glomeromycota(0.32%)、Aphelidiomycota 门(0.26%)、类原生动物门Rozellomycota(0.10%)和毛霉门Mucoromycota(0.07%)。低盐组、中盐组和高盐组冬枣根际土壤样本中,排名前10位的真菌门数占所有真菌总门数的比例分别约为82.3%、81.5%与79.4%。差异分析结果显示,在细菌门的水平上,低盐组与高盐组间绿弯菌门的差异显著(P<0.05);在真菌门的水平上,低盐组的球囊菌门显著高于中盐组和高盐组的(P<0.05)。
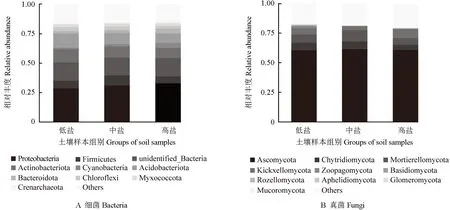
图4 3 组冬枣根际土壤样本中细菌和真菌在门水平上的相对丰度Fig.4 The abundance of bacteria and fungi in the rhizosphere soil samples from three groups of winter jujube at phylum level
2.4 微生物群落在属水平上的组成分析
3 组冬枣根际土壤样本中细菌和真菌在属水平上的相对丰度如图5所示。图5A 显示,3 组冬枣根际土壤样本中,总丰度排名前30 位的细菌属数占所有细菌总属数的比例为27.5%,排名前5 位的细菌属分别为芽孢杆菌属Bacillus(4.06%)、假单胞菌属Pseudomonas(3.25%)、RB41 属(2.98%)、MND1 属(2.09%)、东属Dongia(1.56%)。图5B 显示,3 组冬枣根际土壤样本中,总丰度排名前30 位的真菌属数占所有真菌总属数的比例为64.3%,排名前5 位的真菌属分别为镰刀菌属Fusarium(14.96%)、被孢霉属Mortierella(6.14%)、枝孢属Cladosporium(6.14%)、Plectosphaerella属(3.22%)、Gibberell属(4.74%)。
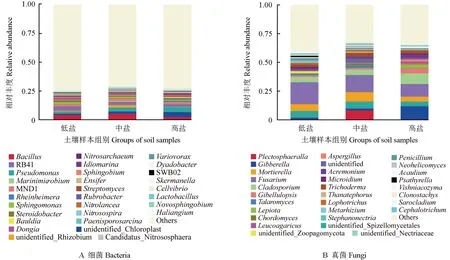
图5 3 组冬枣根际土壤样本中细菌和真菌在属水平上的相对丰度Fig.5 The abundance of bacteria and fungi in the rhizosphere soil samples from three groups of winter jujube at genus level
对低盐组和高盐组冬枣根际土壤样本中细菌和真菌在属水平上的丰度进行非参数t-test 检验(置信区间为95%,P<0.05),结果如图6所示。图6显示,不同组别的冬枣根际土壤样本间,存在差异的细菌属数较多,而存在差异的真菌属数较少。就细菌而言,低盐组与高盐组间有16 个属具有显著差异,在已鉴定过的丰度排名前5 位的属中,高盐组中的嗜盐单胞菌属Halomonas、Colidextribacter属、Pelagibius属和颤螺旋菌属Oscillibacter的丰度均显著高于低盐组相同属的丰度,而其类芽孢杆菌属Paenibacillus的丰度显著低于低盐组同属的丰度。就真菌而言,低盐组中Auriculariales 科的一种未知属的丰度显著高于高盐组的。

图6 低盐组和高盐组冬枣根际土壤样本中细菌和真菌属丰度的t-test 检验结果Fig.6 T-test results of bacterial and fungal genus abundance in rhizosphere soil samples of winter jujube from low-salinity and high-salinity groups
2.5 Co-occurrence 共现性网络分析
以细菌和真菌丰度最高的50 个属构建共现性网络结构,结果如图6所示。图6中的各圆点表示微生物的属,圆点大小表示微生物属的丰度,圆点与圆点间的黑色连线表示微生物的属与属之间存在着正相关性,而灰色连线则表示其属与属之间存在着负相关性。3 组冬枣根际土壤样本中参与网络共现性构建的微生物可分别归类于子囊菌门Ascomycota、变形菌门Proteobacteria、厚壁菌门Firmicutes、酸杆菌门Acidobacteriota、担子菌门Basidiomycota、放线菌门Actinobacteriota 等13 个门。低盐组土壤样本中的微生物,属与属之间呈正相关性的门数较多,而呈负相关性的门数较少;相对于低盐组土壤样本中的微生物而言,中盐组的属与属之间呈正相关性的门数减少,而呈负相关性的门数增加;高盐组的属与属之间分别呈正、负相关性的门数均高于低盐组与中盐组的。此外,低盐组土壤样本中微生物的丰度较高,其中关联性较高的细菌属多为变形菌门和酸杆菌门等门的,中盐组土壤样本中真菌子囊菌门的数量增加,而高盐组的子囊菌门占明显优势地位。
2.6 细菌及真菌功能预测分析
使用PICRUSt 和FunGuild 软件分别推测样本中细菌和真菌的功能基因组成,并进行KEGG分析。选取3 组冬枣根际土壤样本中丰度排名前35 位的子功能注释构建聚类热图,结果如图8所示。3 组冬枣根际土壤样本的功能注释结果类似,在细菌方面均涉及多种氨基酸代谢、遗传信息处理、免疫系统等代谢通路;真菌方面多涉及一些动植物病原体、腐生生物及菌根真菌等,3 组冬枣根际土壤样本的子功能丰度具有显著差异。在细菌层面,低盐组在碳固定和某些氨基酸、酯类代谢方面的丰度均较高,而高盐组在嘌呤、丙烷代谢等方面则均有较高的丰度;在真菌层面,高盐组富集了大量动植物病原、寄生菌及腐生生物的功能基因,而低盐组除了富集病原及腐生生物外,还大量富集外生菌根及丛枝菌根的功能基因。

图7 3 组冬枣根际土壤样本中微生物的共现性网络结构Fig.7 Co-occurrence network of soil microorganisms in the rhizosphere soil samples of winter jujube
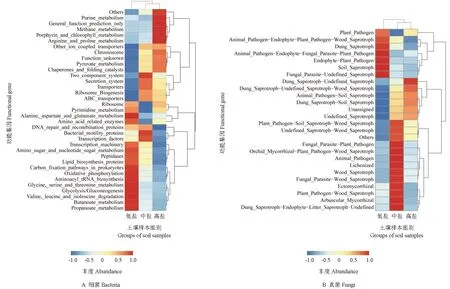
图8 3 组冬枣根际土壤样本中细菌和真菌功能基因预测的聚类分析热图Fig.8 Cluster heat map of bacterial and fungal function prediction in rhizosphere soil of winter jujube
3 结论与讨论
基于16S rDNA 和ITS 扩增子测序技术的盐碱土壤冬枣根际微生物多样性的研究结果表明,在土壤肥力状况相似的情况下,土壤盐分的增加会使微生物丰度降低,使其群落组成更加相似。这一研究结果与李岩等[25]对黑枸杞、戴良香等[26]对花生的研究结果均相同。盐分的增加不会对细菌多样性造成显著影响;在较低的盐分条件下,盐分的增加会导致真菌多样性显著降低,但在较高的盐分条件下,盐分的增加反而会导致真菌多样性显著增加(表2)。这一研究结果与国春菲[27]对滨海盐碱地区微生物多样性的研究结果一致。
微生物群落组成分析结果表明,盐碱条件下,冬枣根际土壤中的优势细菌门分别为变形菌门、酸杆菌门、放线菌门、厚壁菌门,其优势真菌门为子囊菌门。这可能因为,内陆大部分地区盐碱土壤中的优势细菌门均为变形菌门[20-21],而植物根际土壤中的优势真菌门一般为子囊菌门[12]。在属水平上,冬枣根际土壤中的优势细菌属分别为芽孢杆菌属、假单胞菌属,而其优势真菌属分别为镰刀菌属、被孢霉属、枝孢属。对比分析不同盐分条件下冬枣根际土壤中的微生物群落发现,在高盐条件下,细菌中的类芽孢杆菌属、亚硝化细菌属和链霉菌属等重要功能性细菌的丰度均显著降低,真菌中作为丛枝菌根的球囊菌门的丰度显著降低。此研究结果与李岩等[25]对黑枸杞、戴良香等[26]对花生的研究结果均一致,表明盐分的增加可能会导致土壤微生物的功能性下降。同时,盐分的增加也会使一些土壤致病真菌(如镰刀菌属)减少,可能会减少某些植物病害的发生。此外,在高盐组土壤样本中还发现了嗜盐单胞菌属、Colidextribacter属、Pelagibius属和颤螺旋菌属等耐盐微生物。
微生物共现性网络分析结果表明,不同盐分条件下冬枣根际土壤中微生物群落的互作关系存在较大差异。随着盐分的增加,微生物间的负相关性增强,且其整体的关联性变强,这表明在盐分增加的过程中,冬枣根际土壤中的微生物群落更加趋于稳定。在低盐条件下,关联性强的微生物多为变形菌等细菌,而随着土壤盐分的增加,真菌子囊菌门逐渐占据优势地位,并最终成为主导者。与细菌群落相比,土壤真菌群落在高盐条件下具有更强的稳定性,此结果与于少鹏等[28]对干旱草地的研究结果相同。其原因可能是,在干旱及盐碱等胁迫条件下,植物优先为真菌提供碳源[29],并由真菌维持根际微生物群落的稳定性,至于其具体的互作机制,仍需深入研究。功能预测分析结果表明,在高盐条件下,冬枣根际土壤中的细菌在提供碳固定和某些氨基酸、酯类代谢等方面的功能均降低,真菌中外生菌根和丛枝菌根等的功能基因减少;而盐分的增加,会使得细菌的丙烷代谢、嘌呤代谢等抗逆功能有所增强,真菌在高盐条件下则富集了更多的对植物有害的致病及寄生功能,表明土壤盐分是影响冬枣根际土壤中微生物群落功能的关键因素[25]。
根际土壤微生物对植物的生长和代谢具有重要影响,在面对盐胁迫等逆境胁迫时,微生物同样发挥着重要作用[16-17]。因此,利用微生物来缓解盐胁迫是提高盐碱土壤作物产量的重要手段[30]。而不同的微生物群落对于维持盐碱条件下群落稳定和缓解植物盐胁迫具有不同的作用,例如,在干旱草地上真菌在维持群落稳定方面上发挥着更加重要的作用[29]。此外,一些耐盐微生物能够通过自身的高钾离子吸收、强吸水性等机制很好地适应盐胁迫,同时与植物互相作用,缓解植物的盐胁迫[31]。本研究利用扩增子测序技术对不同土壤盐分条件下冬枣根际土壤中微生物群落多样性及群落结构进行了分析,结果发现,过高的盐分使得冬枣根际土壤中微生物群落的多样性指数减小,使其群落的整体功能变差,而真菌在高盐条件下对维持冬枣根际土壤中微生物群落的稳定性有更大的贡献。研究中还发现了嗜盐单胞菌等耐盐微生物在高盐条件下的冬枣根际中高度富集,这些耐盐微生物或可成为盐碱土壤冬枣栽培及盐碱土壤改良的可利用资源。除此之外,本研究对群落功能方面的分析,只是基于现有的已知微生物库进行比对预测,而要获取更加丰富且可靠的群落功能信息,还需要利用宏基因组等技术进行测试分析,对于研究中发现的冬枣根际耐盐微生物,也需要对其菌株进行分离培养与验证分析。因此,后续研究将集中于群落功能的深入分析与嗜盐单胞菌等耐盐微生物的分离培养、功能验证和应用等方面。
