长棘海星(Acanthaster planci)幼体特异性PCR 检测技术与应用*
2022-12-05张颖杨栎潼刘冰郑凡昱罗鹏陈偿
张颖, 杨栎潼, 刘冰,3, 郑凡昱, 罗鹏, 陈偿,4
1. 中国科学院南海海洋研究所, 中国科学院热带海洋生物资源与重点实验室, 广东省应用海洋生物学重点实验室, 广东 广州510301;
2. 厦门大学马来西亚分校, 中国东盟海洋技术学院, 马来西亚 雪兰莪州 雪邦 43900;
3. 中国科学院大学, 北京 100049;
4. 中国科学院南海海洋研究所, 海南西沙海洋环境国家野外科学观测研究站, 广东 广州 510301
近几十年来, 世界各地的珊瑚礁正在迅速减少(Hughes et al, 2017)。虽然气候引起的周期性白化是全球珊瑚死亡的主要原因(Hughes et al, 2018), 但以珊瑚为食的长棘海星(Acanthaster planci, 英文名为crown-of-thorns seastar, 简称CoTS)数量的激增加剧了印度—太平洋地区的珊瑚礁退化(Baird et al, 2013;Nakamura et al, 2014; Saponari et al, 2015)。例如,1985 年至 2012 年期间, 澳大利亚大堡礁(Great Barrier Reef, GBR)的珊瑚覆盖面积减少了约50%,其中 42%归因于长棘海星的破坏(De'ath et al,2012)。目前, 大堡礁正在经历自20 世纪60 年代以来有记录的第四次大规模长棘海星暴发(Pratchett et al, 2014, 2017)。与此同时, 印度—太平洋地区的许多其他珊瑚礁也受到长棘海星的严重影响, 包括法属波利尼西亚(Kayal et al, 2012)、印度尼西亚(Baird et al, 2013)和日本冲绳(Nakamura et al, 2014)的珊瑚礁。我国的珊瑚礁也未逃脱这一命运。据报道, 自2004 年以来, 西沙群岛海域珊瑚礁已经经历了两次长棘海星大规模暴发事件, 其中在第一次暴发期间,长棘海星的密度每公顷高达20000 只, 珊瑚的覆盖率从最初的60%多退化到不足10%, 而且经历长棘海星暴发的珊瑚礁至少需要10~15 年的时间才能逐渐恢复(吴钟解 等, 2011; 李元超 等, 2019)。
尽管在过去30 年里进行了大量的研究工作, 但制定有效的管理战略以控制长棘海星暴发仍然受到很多不确定性的限制(Pratchett et al, 2017)。其中一部分原因来自对野外原位长棘海星幼虫的了解有限。海洋浮游动物的分类鉴定通常是通过光学显微镜完成的, 要成功进行这项工作, 往往需要丰富的技能和大量的培训。即便如此, 仅根据形态来区分长棘海星幼虫与其他海星及海参的幼虫几乎是不可能的(Uthicke et al, 2015); 而且由于食物可获得性的不同, 导致长棘海星幼虫发育和形态上的表型可塑性, 使视觉识别更复杂且难度更高(Wolfe et al,2015)。因此, 研发一种新的识别手段尤为重要, 而遗传鉴定是一种高效且有用的工具。
线粒体细胞色素氧化酶亚基I(mtCOI, mitochondrial cytochrome oxidase subunit I)基因是一种线粒体基因, 因其具有高度保守以及高拷贝数的特性, 常被用作许多类群的DNA 条形码(Hebert et al, 2003; 位正鹏 等, 2009), 包括棘皮动物(Ward et al, 2008)和浮游动物(Bucklin et al, 2016)。而且, 相比核DNA,线粒体基因具有结构简单、进化速率高和母系遗传等特点(Gérard et al, 2008)。此外,mtCOI序列信息在遗传数据库中的可获得性, 使物种特定的遗传序列得以确定。因此本研究以长棘海星ApmtCOI基因和线粒体基因为靶点, 设计筛选引物, 以建立一种针对我国南海海域长棘海星特异性的PCR 检测方法。
1 材料与方法
1.1 样品的采集
成体海星的采集: 蓝指海星(Linckia laevigata)、面 包 海 星(Culcita novaeguineae) 、 粒 皮 海 星(Choriaster granulatus)和吕宋棘海星(Echinaster luzonicus)均 采 自 西 沙 七 连 屿 赵 述 岛(16°58.117′N,112°14.848′E)(图1)。

图1 各种海星样品D5: 面包海星, L5: 蓝指海星, X5: 粒皮海星, H5: 吕宋棘海星Fig. 1 Various starfish samples. D5: Culcita novaeguineae;L5: Linckia laevigata; X5: Choriaster granulatus; H5:Echinaster luzonicus
长棘海星幼体的采集: 2021 年9 月初将长棘海星成体采集上岸, 培养在循环水的水族缸中, 使用1-甲基腺嘌呤进行体内注射催产(Tian et al, 2017),取20 只原肠胚期幼虫装入2mL 冻存管中, 速冻于液氮用于后续基因组DNA 提取。
浮游生物样品的采集: 基于长棘海星偏食石珊瑚的特性, 我们在西沙群岛七连屿选取6 个具有不同活珊瑚覆盖率的点作为样品采集站位(表1)。2021年 10 月 21 日, 使用锥形浅水Ⅱ型浮游生物网(0.5mm 孔径)从水下10m 至海面进行垂直拖网采样,每个站位拖网水体积总共为5m3, 富集为500mL,收集于白色塑料瓶中。将水样立即带回海南西沙海洋环境国家野外科学观测研究站实验室, 0.45μm 滤膜真空抽滤后装入2mL 冻存管, 速冻于液氮。

表1 样品采集的站位Tab. 1 Sampling stations
1.2 基因组DNA 的提取
参照TIANamp Marine Animals DNA Kit 试剂盒(天根, 北京), 分别提取成体海星、长棘海星幼体和浮游生物样品中的基因组DNA。所有样品均使用NanoDrop-2000 分光光度计检测 DNA 的浓度和纯度。然后冻存于–20 ℃, 备用。
1.3 引物来源及海星成体目的基因PCR 扩增
基于完整的长棘海星线粒体 DNA(16234bp,GenBank 登录号为AB231475.1), 通过NCBI 网站中的Primer-BLAST 根据引物设计原则(Ye et al, 2012)设计了特异性引物对AcanP-TF/AcanP-TR, 其他引物则来自参考文献(表2)。各引物由生工生物工程股份有限公司合成。

表2 PCR 引物Tab. 2 PCR primers
目的基因PCR 扩增的反应总体积为25μL: 引物 0.6μL, 2×Phanta Max Master Mix(诺唯赞, 南京)12.5μL, DNA 模板(终浓度为1~10ng·μL–1)1μL,ddH2O 补足至25μL。扩增反应条件: 95 ℃ 3min;95 ℃ 15s, 60 ℃ /57 ℃ 15s, 72 ℃ 30s/1min, 34个循环;72 ℃ 10min 。各引物的退火温度和延伸时间见表3,以ddH2O 作为阴性对照, 长棘海星幼体基因组DNA作为阳性对照。
1.4 长棘海星幼体特异性引物的最佳退火温度
根据1.3 的实验结果, 选取引物2aooniF/2aooniR进一步研究。根据该引物的Tm 值, 将退火温度分别设置为56.5、57.5、58.5、59.5、60.5 和61.5 ℃, 对长棘海星幼虫样品进行梯度PCR 扩增。反应体系同1.3, 其他扩增条件见表3, 以ddH2O 作为阴性对照。
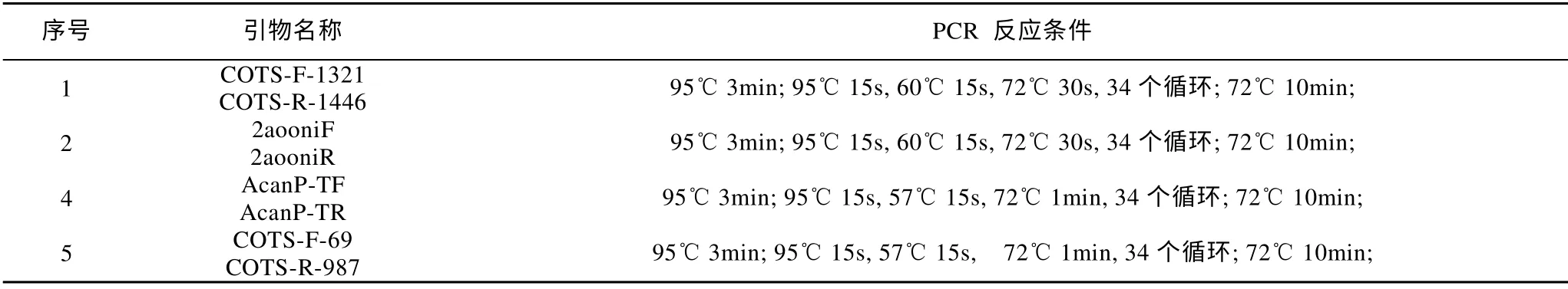
表3 PCR 反应条件Tab. 3 PCR reaction conditions
1.5 长棘海星幼体特异性引物的灵敏度检测
将长棘海星幼体基因组 DNA 的浓度4.17ng·μL–1按10 倍的梯度稀释至4.17×10–8ng·μL–1,并根据1.4 的实验结果, 选取引物2aooniF/2aooniR在58.5℃进行该引物灵敏度的检测, 反应体系和其余扩增条件同1.4。
1.6 野外浮游生物样品中长棘海星幼体的检测
使用引物2aooniF/2aooniR, 在退火温度为58.5℃时对浮游生物样品基因组DNA 进行长棘海星幼体目的片段的扩增。反应体系和其余扩增条件同1.4。
1.7 PCR 反应产物的检测
使用1.2%的琼脂糖凝胶对扩增产物进行电泳(135V, 28min), 260nm 凝胶成像仪下观察拍照, 确认目的条带。利用通用型DNA 纯化回收试剂盒(天根,北京)对目的片段进行回收纯化, 琼脂糖凝胶电泳检测回收产物, 将纯化产物送往公司进行测序(天一辉远生物科技有限公司, 广州)。利用 NCBI 中的BLAST 检索, 将测序成功的序列与GenBank 中已记录长棘海星线粒体基因序列进行相似性比对, 相似性高且E 值为0 的序列即为比对成功的序列, 比对成功的样品即为阳性样品。
2 结果
2.1 长棘海星特异性引物
利用4 对引物对长棘海星幼体和其他成体海星的基因组进行扩增。结果发现, 4 对引物均只能扩增出长棘海星幼体基因组目的片段, 无法扩出其他海星的基因组DNA, 且扩增的长棘海星目的条带清晰,无杂带或非特异性扩增产物(图2)。表明这4 对引物都可以用于鉴定长棘海星幼体。

图2 不同引物的特异性检测M: 2000bp marker; 1—6 分别为COST-F-1321/COST-R-1446 引物扩增下的样品D5、H5、X5、L5、阴性、阳性; 7—12分别为2aooniF/2aooniR 引物扩增下的样品D5、H5、X5、L5、阴性、阳性; 13—18 分别为AcanP-TF/TR 引物扩增下的样品D5、H5、X5、L5、阴性、阳性; 19—24 分别为COTS-F-69/COTS-R-987 引物扩增下的样品D5、H5、X5、L5、阴性、阳性Fig. 2 Specificity screening of different primers. M: 2000bp marker; 1-6: D5, H5, X5, L5, negative, positive control samples were amplified by COST-F-1321/COST-R-1446 primer; 7-12: D5, H5, X5, L5, negative, positive control samples were amplified by 2aooniF/2aooniR primer; 13-18: D5, H5, X5, L5, negative, positive control samples were amplified by AcanP-TF/TR primer; 19-24: D5, H5, X5, L5, negative, positive control samples were amplified by COTS-F-69/COTS-R-987 primer
2.2 长棘海星幼体特异性检测引物的最佳退火温度
鉴于长棘海星引物特异性检测结果, 我们挑选2aooniF/2aooniR 引物进行其最佳退火温度的筛选。结果显示, 改变2aooniF/2aooniR 引物的退火温度,得到的目的条带清晰且均无非特异性扩增(图3)。表明退火温度在56.5~61.5℃之间时, 2aooniF/2aooniR具有较佳的扩增效果。
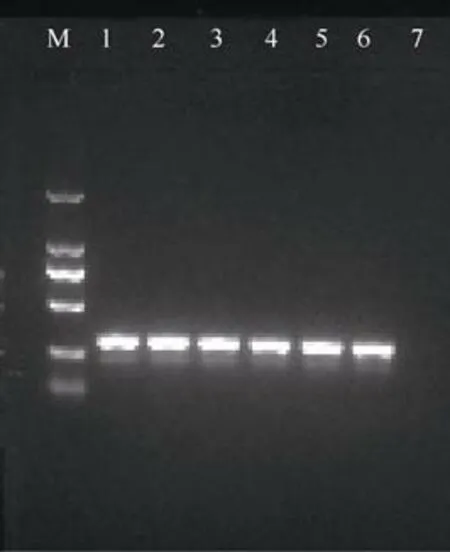
图3 2aooniF/2aooniR 引物在不同退火温度下对长棘海星幼体的扩增M: 2000bp marker; 1—6 分别是退火温度为56.5、57.5、58.5、59.5、60.5、61.5℃下对长棘海星幼体的扩增; 7 为阴性对照Fig. 3 Amplification of 2aooniF/2aooniR primer at different annealing temperatures on CoTS larvae. M:2000bp marker; 1-6: the different annealing temperatures which were 56.5, 57.5, 58.5, 59.5, 60.5 and 61.5 ℃,respectively; 7: negative control sample
2.3 长棘海星幼体特异性引物的灵敏度检测
基于2.2 的结果, 选取退火温度为58.5℃进行2aooniF/2aooniR 引物的灵敏度检测。结果发现, 当DNA 浓度为4.17ng·μL–1时, 条带最亮。随着DNA浓度的降低, 其扩增的条带亮度也逐渐减弱, 当浓度为4.17×10–4ng·μL–1时, 琼脂糖凝胶电泳完全无法检测到目的条带, 而浓度为4.17×10–3ng·μL–1时可以检测到目的片段(图4)。表明2aooniF/2aooniR 引物对长棘海星幼体 DNA 检测的浓度最低限为4.17pg·μL–1, 即皮克(pg)级别。

图4 2aooniF/2aooniR 引物在退火温度为58.5℃下, 对不同浓度长棘海星幼体的扩增M: 2000bp marker; 1—9 浓度分别为4.17、4.17×10–1、4.17×10–2、4.17×10–3 、 4.17×10–4 、 4.17×10–5 、 4.17×10–6 、 4.17×10–7 、4.17×10–8ng·μL–1; 10 为阴性对照Fig. 4 Amplification of 2aooniF/2aooniR primer at 58.5 ℃annealing temperatures on CoTS larvae. M: 2000bp marker;1-9: 4.17, 4.17×10–1, 4.17×10–2, 4.17×10–3, 4.17×10–4,4.17×10–5, 4.17×10–6, 4.17×10–7 and 4.17×10–8 ng·μL–1,respectively; 10: negative control sample
2.4 野外浮游生物样品长棘海星幼体的检测
利用2.2 筛选的特异性引物2aooniF/2aooniR 和退火温度58.5℃对西沙群岛七连屿浮游生物样品进行长棘海星幼体目的片段的扩增。结果发现, 在七连屿的6 个站位中, 4 号、5 号和6 号三个站位样品均能成功扩增出目的基因, 而其他站位的样品未扩增出目的片段(图5)。表明七连屿中岛、南岛和北沙洲存在长棘海星幼体, 且所采集水体中长棘海星幼体的DNA 浓度高于皮克级别。
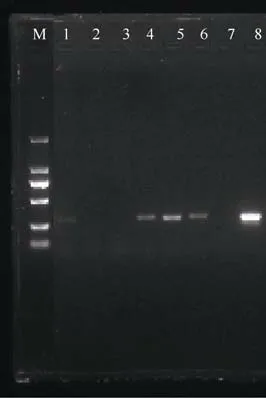
图5 2aooniF/2aooniR 引物在58.5℃退火温度下对浮游生物样品的扩增M: 为2000bp marker; 1—8 分别为58.5℃下扩增的XSZ、ZS-1、ZS-2、ZD、ND、BSZ、阴性、阳性样品Fig. 5 Amplification of 2aooniF/2aooniR primer at 58.5 ℃annealing temperatures on the plankton samples. M: 2000 bp marker; 1-8: XSZ, ZS-1, ZS-2, ZD, ND, BSZ, negative and positive control sample was amplified at 58.5 ℃annealing temperatures, respectively
3 讨论
引物与目标DNA 的成功结合是PCR 扩增中的关键一步, 主要受到退火温度的影响。本研究通过对引物特异性、灵敏性及其退火温度的摸索, 建立了长棘海星幼体的检测技术, 并应用到南海西沙七连屿长棘海星幼体的检测中。研究发现引物2aooniF/2aooniR 在退火温度为58.5℃进行PCR 扩增时, 其扩增效果最佳, 其检测灵敏度可达到皮克级别, 并且分别在中岛、南岛和北沙洲检测到长棘海星幼体。Suzuki 等(2016)也得到相似的结果, 引物2aooniF/2aooniR 可以成功扩增出单个长棘海星幼虫的目的片段。这表明2aooniF/2aooniR 引物的灵敏度高, 可应用于环境样品中长棘海星幼虫的监测。
有研究表明长棘海星浮游幼虫孵化时间一般在9~43d 之间, 时长的波动取决于食物和温度等各种因素(Pratchett et al, 2017)。野外研究表明, 大堡礁长棘海星产卵幼虫的浮游阶段一般少于30d (Uthicke et al, 2015)。鉴于本研究所有浮游生物样品均采集2021 年10 月21 日, 推测本研究检测到的幼虫可能来自2021 年9 月中旬至10 月中上旬, 表明南海长棘海星在9 月份和10 月份仍能产卵受精, 这进一步拓展了前期关于南海长棘海星的产卵主要发生在8月份的推测(Tian et al, 2017)。
海洋建模预测表明长棘海星幼虫一般的旅行距离是35~75km, 最大旅行距离为150km(Dight et al,1990)。虽然七连屿诸岛之间最远距离不超20km, 而且各岛之间的距离处于长棘海星幼虫能到达的区域范围内。但本研究仅在西沙七连屿的北沙洲、南岛和中岛检测到长棘海星幼虫, 而赵述岛和西沙洲均未检测到, 这可能与其他因素有关, 如洋流的速度、方向、强度以及幼虫的食物等(Pratchett et al, 2017)。有研究表明, 在较慢的洋流中, 长棘海星幼虫可以在单个珊瑚礁尺度上大量滞留(Wooldridge et al,2015)。中尺度和亚中尺度环流也会减少幼虫的远距离扩散(Wolanski et al, 1988)。此外, 浮游植物(如藻类等)会影响幼虫在水体中的分布。Sameoto 等(2008)的研究表明, 幼虫遇到藻类时会停止前行, 并在该位置发生聚集。由于环境因素的复杂性以及本研究所检测环境因子的局限性, 无法探明影响长棘海星幼虫地理分布特征的原因。因此要揭示幼虫种群地理分布的驱动机理, 需进一步探究环境因子与幼虫种群丰度和分布之间的耦合关系。此外, 尽管本研究建立了野外长棘海星幼虫的检测技术, 但是要了解幼虫种群的动态变化, 对环境样品进行定量分析是必不可少的一步。因此在今后的研究中, 需着力开发一套针对长棘海星野外环境中幼虫的定量检测技术。
