三种红树根部组织抗氧化酶活性对水淹胁迫的响应
2022-12-05苏柏予张维仕王友绍
苏柏予, 张维仕, 王友绍
1. 热带海洋环境国家重点实验室(中国科学院南海海洋研究所), 广东 广州 510301;
2. 中国科学院大亚湾海洋生物综合试验站, 广东 深圳 518121;
3. 南方海洋科学与工程广东省实验室(广州), 广东 广州 511458;
4. 中国科学院南海生态环境工程创新研究院, 广东 广州 510301;
5. 中国科学院大学, 北京 100049;
6. 临沂市白沙埠中学, 山东 临沂 276035
红树林是以红树植物为主体的、由常绿灌木或乔木组成的潮滩湿地木本植物群落, 具有“四高”特性(高生产力、高归还率、高分解率和高抗逆性), 是典型的海洋生态系统(王友绍, 2021; Wang et al,2021), 分布于热带及亚热带海岸, 具有重要的生态、社会和经济意义(林鹏, 2001)。较一般陆生植物而言, 红树植物对各种极端环境具有耐受能力, 能较好地适应重金属、石油烃、高温等非生物胁迫(张以科, 2008; Zhang et al, 2012; 刘锦, 2018), 其中最广为人知的是红树植物作为陆生植物对水淹胁迫的适应性, 这一适应性也使红树植物得以构成位于潮间带受海水长期或周期性浸淹的红树林生态系统。
红树植物对水淹有强大的耐受机制, 但其能力并非无限。全球变化带来的CO2浓度升高、海平面上升、紫外线辐射增强、海水盐度的变化、降水量的变化、风暴增多等都会对红树林生态系统造成不同程度的影响 (Snedaker et al, 1994; Valiela et al,2001)。全球气候变化对红树林的影响将是全方位的、立体的, 其中由于海平面上升、降水模式改变等所导致的水淹胁迫是不可忽视的重要影响因素(Ellison et al, 1997; Alongi, 2008)。就面对海平面上升而言, 红树林积累沉积物的能力可以跟上海平面每百年上升8 9cm 的速度(Ellison et al, 1991), 而每百年9 12cm 的上升速度则很有可能影响红树植物的生长, 从而影响红树林生态系统的稳定, 甚至导致该生态系统的消失(卢昌义 等, 1995)。潮汐实验表明, 在一定浸泡阈值内, 水淹会刺激红树植物生长, 而超过阈值的水淹则会对植物生长和生物量带来消极影响, 如白骨壤(Avicennia marina)小苗能较好地适应8 12h·d–1(廖宝文 等, 2010)的水淹; 红花玉蕊(Barringtonia racemosa)能适应8h·d–1以内的水淹, 但10h·d–1水淹时会形成胁迫, 植株上调过氧化物酶(peroxidase, POD)、超氧化物歧化酶(superoxide dismutase, SOD)的酶活性(梁芳 等, 2021)。红树林生态系统位于海岸潮间带, 相较其他生态系统受到高强度和复杂因素干扰的可能性更高(Alongi, 2008),受降水模式改变以及风暴潮等极端天气频发的影响,低洼地带红树林易受非潮汐性的长时间水淹影响,不少研究表示了对全球气候变化背景下红树林生态系统的长期维持和生存的担忧(Valiela et al, 2001;颜秀花 等, 2019; 黄雪松 等, 2021)。因此, 迫切需要在各生态学水平上对红树林生态系统进行更透彻的研究, 从而为其提供更好的保护并积极恢复其生态原貌。
红树植物的表面根、气根、板状根、支柱根等特殊且强大的根系牢固根植于滩涂并适应海水浸泡(王友绍, 2019)。由于氧气在水中的传递速率远低于空气, 潮汐带来的水淹会导致红树植物根部缺氧并阻断有氧呼吸(谭淑端 等, 2009), 处于低氧环境的细胞进行无氧代谢, 使无氧呼吸相关酶的活性增强,从而催化相关反应发生(Gibbs et al, 2003; Voesenek et al, 2006)。同时, 被淹植物组织内的活性氧生产和消除的平衡体系会遭到破坏, 导致活性氧(reactive oxygen species, ROS)的大量产生和累积(Mittler et al,2004)。在正常阈值内ROS 对植物细胞的生长和凋亡、胁迫响应等过程具有调控作用, 而过量的ROS会损害蛋白质、脂质及DNA; 损害细胞和组织; 从而对植株造成活性氧伤害( Ellison et al, 1991;Mittler et al, 2004; 谭淑端 等, 2009; Sairam et al,2009 ;张梦如 等, 2014)。SOD、过氧化氢酶(catalase,CAT)、抗坏血酸氧化酶(ascorbic acid oxidase, APX)与POD 与活性氧的消除有关, 它们在植物受胁迫后上调活性可保护植物免受活性氧伤害或降低活性氧带来的伤害, 对植物在逆境下的存活至关重要, 如木榄(Bruguiera gymnorrhiza)和秋茄(Kandelia candel)会因长期水淹上调POD 和SOD 酶活性 (Ye et al,2003); 虎尾草(Chloris virgata)遭受水淹胁迫后SOD、POD 及CAT 酶活性上升(夏斌 等, 2019); 小蓬草(Conyza canadensis)会提高组织内SOD 活性以应对水淹胁迫(杨玲 等, 2020)。
分子和个体水平的差异导致红树植物不同种群对水淹胁迫耐受性的差异, 而物种的耐受性差异会对红树林群落结构和物种分布带来影响。研究指出,红树植物的种群分布表现为过渡替代的交错分布,白骨壤和桐花树(Aegiceras corniculatum)种群密度由海向陆递减, 而木榄种群密度则相反地集中于高潮带, 这样的差异分布与潮汐浸泡程度、冲刷程度和底层营养盐浓度等一系列因素有关(温远光 等,2002)。因此, 本研究以红树植物自然种群分布为根据, 选择水淹为本实验探究的影响因子, 以在我国南方海岸带具有代表性的木榄、桐花树和白骨壤为实验物种, 通过设置高水位浸淹模拟极端条件下的水淹环境, 从氧化损伤的角度研究红树植物抗氧化酶系统对水淹胁迫的响应机制, 旨在更好地了解红树林对水淹胁迫的生理适应机制, 为红树林生态系统的保护与管理提供理论依据。
1 材料与方法
1.1 实验材料
2021 年3 月8 日于广东省湛江市采购株高约40cm、无病虫、无机械损伤的木榄、桐花树和白骨壤幼苗, 红树幼苗连同根部粘连泥土一同放置于塑胶周转箱中运回实验室。运输后的植株置室外恢复两周, 洗去植物根部土壤, 转移至干净河沙培养盆中, 浇灌1/2 Hoagland 营养液, 放置于条件为25℃、75%湿度、每日20000Lux 光强照射14h 的人工气候箱中进行为期7d 的驯化培养。水淹深度设置为沙面以上25cm, 约没过植株最靠近根部一对叶。分别在深淹处理1、3、5、7、14d 后收集植物根部组织, 同时采集未经深淹处理的0d 根部组织为对照。样品收集后被立即置于液氮中速冻处理并迅速转移至–80℃冰箱短暂保存待测。每一处理时间下的样品均设置3 个生物学重复实验。
1.2 测定方法
1.2.1 酶组织液准备
酶储备液的制备参考崔雪 等(2018)的方法, 将根组织样品在4℃磷酸缓冲溶液中漂洗, 吸水纸擦除水分并剪碎。准确称量0.2g 组织样品与1.8mL 匀浆介质混合。低温研磨, 保证研磨充分、细胞彻底破碎。CAT、POD、SOD 的酶储备液为组织研磨液以 4000r·min–1离心 15min 后吸取的组织上清液,APX 酶储备液为组织研磨液以10000r·min–1离心10min 后吸取的组织上清液。
1.2.2 酶活性测定
CAT、POD、SOD、APX 活性测定参照Zhu 等(2020)的方法, 使用南京建成生物工程研究所相应的试剂盒分别对四种酶的活性进行测定。
1.3 数据分析
所有数据根据平行样本测定所得值以平均值和标准差表示(M±SD), 利用SPSS 23.0 软件的单因素方差分析(one-way ANOVA)方法对不同处理样品间差异进行评价, 显著性差异水平设置为P<0.05, 采用 Waller-Duncan 法进行多重比较, 运用软件Graphpad Prism 8.0.2 作图使结果可视化。为了更直观地观察各物种、各处理时长之间抗氧化酶活性的相似性, 利用RStudio 对各组数据进行标准化处理,并按照完全聚合的比对方法进行层次聚类分析并绘制树状图。
2 结果与分析
2.1 深淹处理对POD 活性的影响
桐花树和木榄POD 活性在实验所设置的浸淹周期内呈现随时间持续上升的趋势(图1)。桐花树浸淹1d 后根组织POD 活性到达367.188U·g–1, 较对照组0d 的197.049U·g–1极显著上升(P<0.01), 且在1d至7d 内都维持较高活性水平, 而14d POD 活性又较7d 再次显著增长(P<0.01), 达到实验周期内的峰值696.037U·g–1, 约为对照组的3.5 倍。木榄浸淹1d 后根组织POD 活性到达181.424U·g–1, 较对照组0d 的82.951U·g–1显著上升(P<0.01)随后保持较高活性水平, 在7d 后其活性又达新高375.868U·g–1, 而活性最高的14d 组织POD 活性396.111U·g–1约为对照组的5 倍。白骨壤POD 活性在受水淹胁迫1d 后显著上升(P<0.01)达500.463U·g–1, 随后在3d 处呈下调态势, 随后再逐日增加(图1), 其活性峰值在第1 天,为对照组1.4 倍。
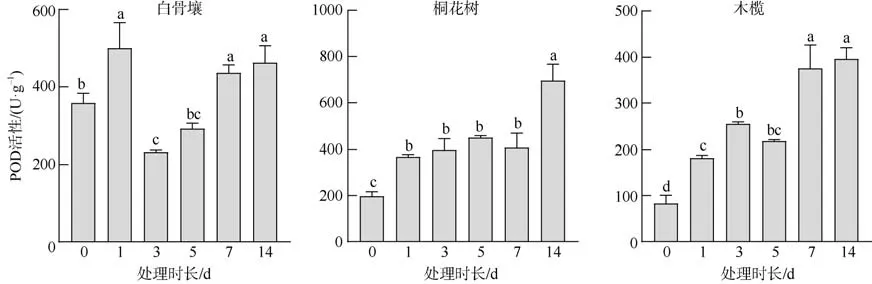
图1 不同水淹时间下3 种红树植物根组织的POD 活性Fig. 1 The POD activity in root tissues of different mangrove plants for different periods of submerge
2.2 深淹处理对SOD 活性的影响
3 种红树植物SOD 活性在水淹后均呈显著上升后下降趋势(图2)。白骨壤SOD 活性在3d 达到峰值358.119U·g–1, 较0d 的170.060U·g–1上调约2倍。如图2 所示, 白骨壤SOD 活性在7d 恢复到受胁迫前水平并在继续下降, 在 14d 达到最低点62.864U·g–1。桐花树SOD 活性在1~5d 内持续上升并在处理后5d 达到峰值746.598U·g–1, 为对照组405.956U·g–1的1.8 倍, 同样, 其SOD 活性在处理周期后半段下降到了未处理的 0d 水平之下107.89U·g–1。木榄SOD 活性在1~7d 内较对照组而言处于高活性水平状态, 峰值 627.582U·g–1出现在5d, 为对照组340.657U·g–1的1.8 倍。而14d活性最低, 仅69.172U·g–1。
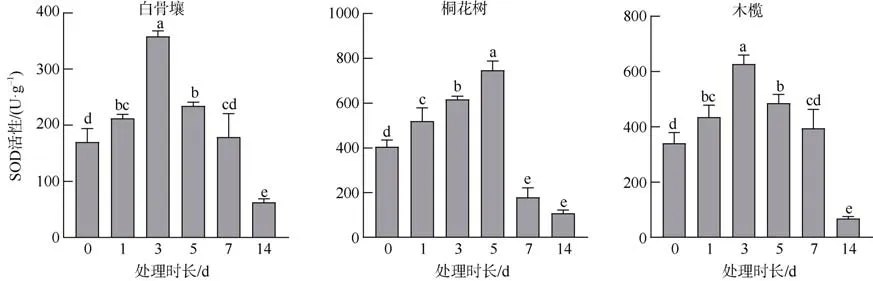
图2 不同水淹时间下3 种红树植物根组织的SOD 活性Fig. 2 The SOD activity in root tissues of different mangrove plants for different periods of submerge
2.3 深淹处理对CAT 活性的影响
如图3 所示, 白骨壤CAT 活性在1~7d 内较0d显著上调, 最高值109.084U·g–1出现在7d, 为对照组(60.923U·g–1)的1.8 倍, 且在高活性期间各时间点的酶活性差异较小, 14d 其活性回归至对照组水平。桐花树CAT 活性在处理后的1~5d 内呈现缓慢上升态势, 7d 活性达到最高 176.189U·g–1, 为对照组(64.701U·g–1)的2.7 倍, 在14d 期回到较低水平。木榄CAT 活性峰值131.781U·g–1出现在5d, 约为对照组(51.267U·g–1)的2.6 倍, 随后虽缓慢下降但仍处于对照组之上, 即在处理周期内均处于上调水平。
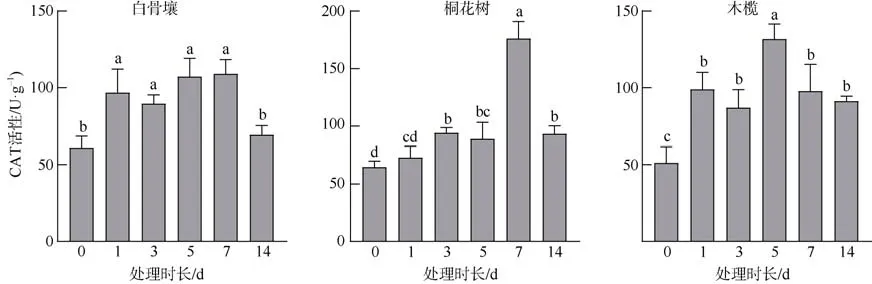
图3 不同水淹时间下3 种红树植物根组织的CAT 活性Fig. 3 The CAT activity in root tissues of different mangrove plants for different periods of submerge
2.4 深淹处理对APX 活性的影响
如图4 所示, 白骨壤APX 活性在深淹处理的1d和3d 期间显著上调, 其中最高的2.512U·g–1出现在1d, 约为0d 0.582U·g–1的4.3 倍, 随后活性下降回到与对照组无显著差异水平。桐花树受胁迫后APX 活性变化趋势与白骨壤相似, 在1d 和3d 显著上调随后下降, 其中1d 活性最高达到0.825U·g–1, 约是对照组0.284U·g–1的3 倍。木榄受胁迫后在1d 处APX活性达到最高0.995U·g–1, 约为对照组0.500 的2倍, 而随后的3~14d 处活性均逐步下降并回到对照组水平。
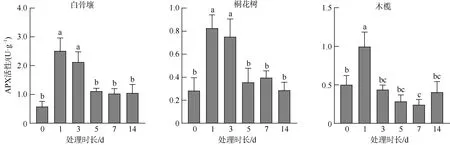
图4 不同水淹时间下3 种红树植物根组织的APX 活性Fig. 4 The APX activity in root tissues of different mangrove plants for different periods of submerge
3 讨论
如图5 所示, 实验所涉及的4 种活性氧清除相关酶活性均在3 种红树植物受水淹胁迫后上升, 帮助植物应对低氧胁迫造成的ROS 异常。 POD 活性在试验周期内(14d)持续上升, SOD、APX、CAT 的活性在试验周期内呈先上升后下降趋势。在Ye 等(2003)的研究中, 木榄在12 周的水淹周期内根组织POD 活性持续上升, 秋茄水淹后根组织POD 活性则是在8 周内持续上升。
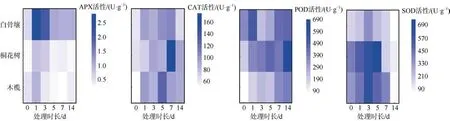
图5 3 种红树植物各酶活性水平热图Fig. 5 Heatmaps of enzymes activities of three mangrove plants
研究表明, 植物受长期水淹后POD 活性变化一般呈现两种趋势: 先上升后下降趋势与持续上升趋势, 如华北紫丁香叶片(白果 等, 2021)、棱角山矾幼苗叶片(赵楚 等, 2021) POD 活性分别在10d、38d下降; 而水竹根系(金艺 等, 2021)、虎尾草根系(夏斌 等, 2019)和双穗雀稗根系(谭淑端 等, 2013)POD活性在各自的实验周期内(分别为15d、30d 和150d)都呈现持续上升态势。POD 活性在受水淹植物的根系和叶片呈现两种变化趋势展示了植物不同组织内POD 对水淹胁迫的应对机制, 在水淹实验中根组织长期处于胁迫环境可能是导致不同植物根组织POD活性在各自实验周期内都持续增长的原因。
植物在遭水淹胁迫后有氧呼吸受阻, 植物细胞开始进行无氧呼吸, 无氧呼吸会导致有害物质乳酸和乙醇在细胞中的累积(Gibbs et al, 2003)。POD 除了能与H2O2反应, 它还参与某些有毒物质如醇类、酸类和酚类的反应, 在这类反应中的副产物正是ROS, 其具体反应过程如下(Hiraga et al, 2001;Kawano, 2003)。

E 为POD, EI、EII 为反应过程中的POD 复合物;AH 为反应底物; A·为底物的自由基态;为氧自由基。本研究中3 种红树植物POD 活性在受胁迫期间较其他酶而言其趋势没有出现随处理时间延长而相对下降的变化。这可能与其不仅与过氧化氢反应还可能参与细胞对乳酸和乙醇的解毒过程有关。 有研究表明, 在敲除基因或利用反义互补方法阻止APX1 和CAT2 表达的实验中, 特定种的POD(classⅢ)表达会上调(Mittler et al, 2004), 这一类实验表明了ROS 产生后POD 对植物的保护, 结合本研究的实验结果, 推测POD 在红树植物遇较长时间的水淹胁迫后可为植物提供较长期的保护。
SOD、APX 和CAT 对ROS 的消除和平衡具有重要作用。SOD 可以催化结合H+生成过氧化氢和氧气。过氧化氢被 APX 催化生成水和丙二醛(malondialdehyde, MDA); CAT 也可催化过氧化氢并生成水和氧气。SOD 是向H2O2转化的关键, 而CAT 和APX 的活性则关系到H2O2的清除(Hiraga et al, 2001; Kawano, 2003)。
从图5 的SOD 热图中可以看到, 与对照组0d相比在1~5d 的时间内SOD 活性增强, 红树植物根部细胞积极响应组织内上升的氧自由基。在7d 的取样点处, SOD 活性较之前下降并基本回到受胁迫前水平, 而14d 处的采样点SOD 活性甚至降低至0d处酶活性水平以下, 这与饲料桑苗(Morus alba)和湿地松(Pinus elliottii)的水淹实验SOD 活性先增后减的趋势一致(崔雪 等, 2018), 表明SOD 作为一种应激表达的蛋白并不能在红树植物受水淹胁迫时长期维持在高活性状态。水淹胁迫使CAT 与APX 活性在短期内增强。与SOD 相似, CAT 与APX 活性同样不能长时间维持在高水平。CAT 与APX 底物均为H2O2, 由这两种酶的变化趋势推测, 水淹发生时CAT 可在更长时间内保护植物免受H2O2威胁, 在水淹胁迫下对ROS 的清除起更重要作用。实验结果表明活性氧清除有关的酶是应激表达的, 红树植物应对长期的水淹胁迫还有赖于其他生理结构和生化途径, 如通气组织的形成和侧根的生长等。
三种红树植物在自然生态系统中的带状分布是不同高程海岸带各环境因子共同作用的结果, 而潮汐所带来的浸泡时间长短与水位高低是其中的关键因子之一。模拟极端水淹条件后白骨壤、桐花树和木榄的ROS 清除酶活性的变化趋势并没有出现十分显著的差异, 虽然针对某一种酶的表达量会存在物种间的差异, 就单因素方差分析而言, 其变化趋势上的共性不能区分三种红树植物抗氧化酶的活性模式, 于是本研究选择聚类分析进行更进一步的讨论, 旨在更直观表现三种红树植物的抗氧化酶对水淹胁迫响应模式的相似或相异性。
以每一处理时长下3 种红树植物各项酶活性为指标, 按照层次聚类的方法对其进行分析, 其结果以树状图形式展示。如图6 所示, 当聚类数为2 时各目标被聚集分为A 组和B 组, 白骨壤各处理组全部聚集于A 组, 而桐花树除7d 和14d, 木榄除14d外聚集于B 组。从聚类的角度, 白骨壤在水淹胁迫下的各项抗氧化酶活性模式较桐花树和木榄存在一定差异, 而在较长时间水淹胁迫处理下的桐花树和木榄抗氧化酶的各项响应模式趋向于白骨壤的活性模式。在B 组中, 桐花树0d 与木榄0d 被聚集于同一分支下, 其余处理天数则位于另一分支, 表明未受水淹的桐花树和木榄组织内各项酶活性以相似的模式表达, 水淹发生后这两种植物酶系响应并具有相似的上调模式。白骨壤1d 和3d 被分为C 组, 其余天数处理下的各项位于D 组, 这表明白骨壤在胁迫发生后的3d 内各指标出现变化而后迅速恢复。白骨壤与桐花树、木榄各指标的差异可能是白骨壤作为“先锋树种”对水淹胁迫具有良好耐受能力的原因之一, 就桐花树和木榄两物种而言, 本实验分析认为二者在各处理组中抗氧化酶指标活性模式是相似的, 因此这两种植物在潮间带高程分布的差异可能由其他因素主导。
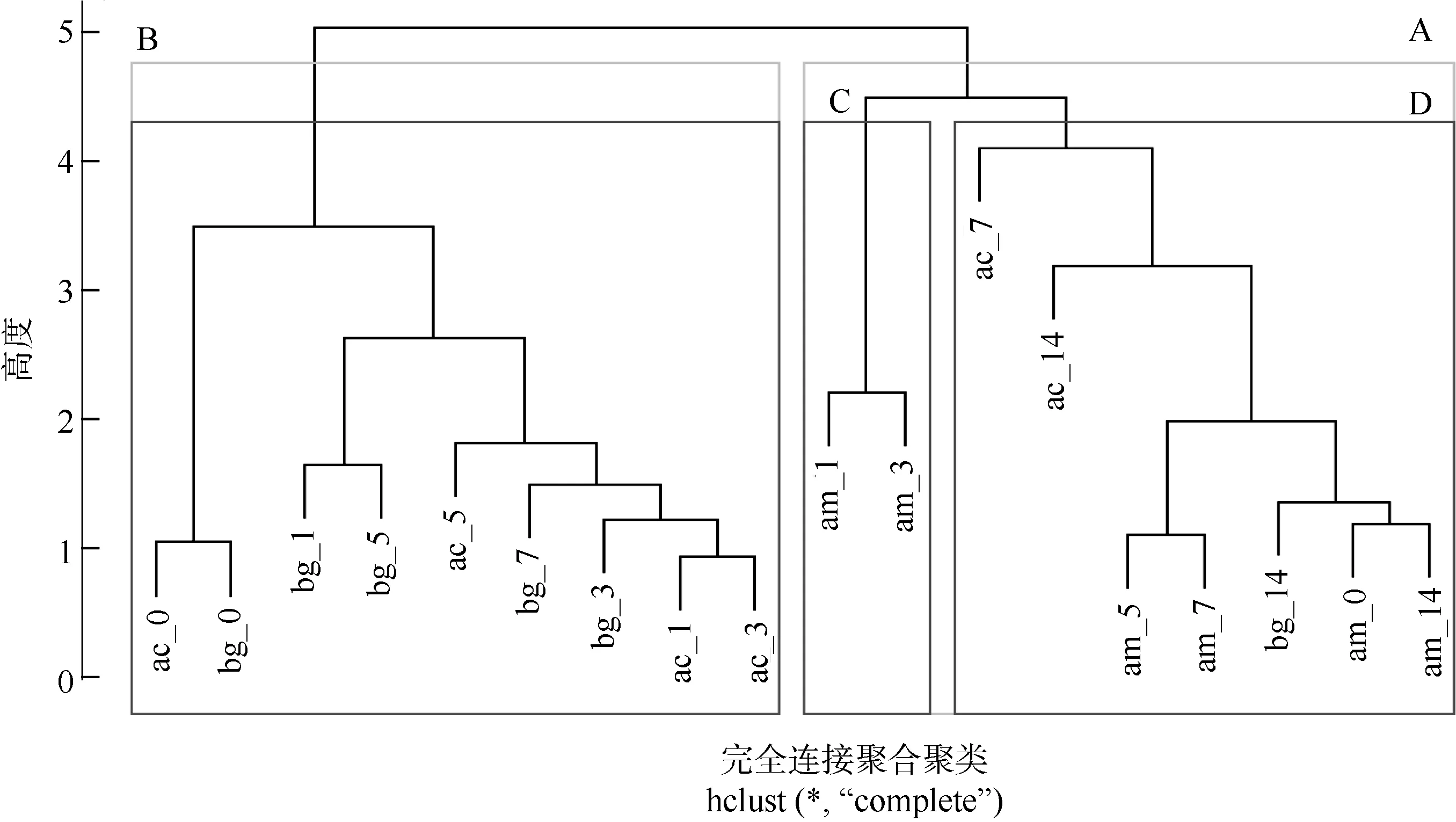
图6 酶活性水平聚类分析树状图各分支标签中am 为白骨壤, ac 为桐花树, bg 为木榄; 标签数字尾缀代表水淹处理天数Fig. 6 Dendrogram derived from cluster analysis of enzymes activities. In the labels of each branch, am represents A. marina,ac stands for A. corniculatum and bg means B. gymnorrhiza. The label number represents the periods of submerged stress
4 结论
抗氧化酶APX、SOD、CAT 和POD 对3 种红树植物受水淹胁迫后的活性氧消除至关重要。聚类分析中3 种植物0d 的酶活性机制与处理后的差异,强调抗过氧化酶对水淹胁迫的响应。单因素方差分析表明, 4 种抗氧化酶在水淹发生后均显著上升, 其中APX、SOD、CAT 的酶活性在3 种植物中均表现出先上升后下降的趋势, 其峰值基本出现在7d 以前,表明这3 种酶在胁迫发生早期发挥作用, 可以帮助植物应对非生物胁迫; POD 活性在14d 内持续增长并没有出现明显的下调趋势, 这可能与其特殊的酶功能有关。
层次聚类发现白骨壤各项酶指标的活性机制与桐花树和木榄的存在差异。此分析方法没有发现桐花树与木榄间明显的差异。酶活性机制的差异可能在一定程度上有助于白骨壤应对潮汐带来的胁迫,结合生理和结构上的优越性使其成为向海的“先锋树种”。因此, 建议在进行红树林人工生态修复时应遵循自然种群的高程分布特点, 如白骨壤具有优秀的耐水淹能力, 适合种植于沿海低洼地带和较低潮间带。
