红海榄肉桂酸-4-羟基化酶基因的克隆与表达分析
2022-12-05谢勇王友绍张维仕
谢勇 , 王友绍, 张维仕
1. 热带海洋环境国家重点实验室(中国科学院南海海洋研究所), 广东 广州 510301;
2. 中国科学院大亚湾海洋生物综合试验站, 广东 深圳 518121;
3. 中国科学院南海生态环境工程创新研究院, 广东 广州 510301;
4. 中国科学院大学, 北京 100049;
5. 南方海洋科学与工程广东省实验室(广州), 广东 广州 511458;
6. 临沂市白沙埠中学, 山东 临沂 276035
红树林作为四大高生产力的海洋生态系统之一,具有“四高”特性, 在改善近海生态环境、净化水质、防浪护岸和保护生物多样性等方面具有不可替代的重要作用 (王友绍, 2019; Wang et al, 2021)。近年来,随着工农业的快速发展, 不规范的海水养殖等导致沿海地区污染严重, 其中重金属污染较为常见(王友绍 等, 2019)。红树林沉积物中重金属浓度的增加在全世界都有记录(Tam et al, 1997)。多项研究证实,红树林已成为重金属污染物的重要储存库(Usman et al, 2013; Bourgeois et al, 2019)。大量重金属污染物的输入给红树植物的生长发育带来了严峻的挑战。红海榄是一种广泛分布于我国南方沿海的红树科植物, 经常作为红树林恢复种进行人工种植, 具有较强的抗重金属胁迫能力。木质素合成反应是红海榄耐受重金属胁迫的一个重要机制。植物细胞木质素的合成有利于增加细胞壁厚度, 阻止金属离子进入细胞, 减小重金属胁迫对植物的损害(芮海云 等,2019)。肉桂酸-4-羟基化酶是植物中分布最广的细胞色素P450 单加氧酶家族成员, 是苯丙烷途径中第二步反应的关键酶(Fahrendorf et al, 1993), 催化反式肉桂酸生成 4-香豆酸, 对木质素的合成有促进作用。迄今为止, 许多陆地植物的C4H基因被克隆分析, 如荸荠C4H基因(宋慕波 等, 2020)、海南龙血树C4H基因(梁惠桢 等, 2018)、紫苏C4H基因(宋西红 等, 2015)、茶树C4H基因(姚胜波 等, 2015)等, 但关于红树植物C4H基因序列及其抗逆功能研究很少 (宋晖 等, 2012)。
本研究利用同源克隆和RACE 技术, 从红海榄中克隆得到了肉桂酸-4-羟基化酶基因的cDNA 全长,并运用生物信息学方法对该基因进行预测分析, 以红海榄18S rRNA 作为内参基因, 检测红海榄叶片中C4H基因表达情况与重金属处理时间的关系。本研究为进一步了解C4H基因在红海榄响应重金属胁迫过程中的作用, 以及利用基因工程手段提高红树植物耐受重金属胁迫的能力提供了基础资料。
1 材料与方法
1.1 试验材料
植物材料: 实验用的红海榄幼苗采自广东省湛江市红树林育苗基地, 挑选长势良好的幼苗移至26℃人工气候培养箱进行培养, 用人工配置的混合重金属水溶液(Cu2+112.5mg·L–1、Pb2+22.5mg·L–1、Cd2+4.5mg·L–1、Hg2+4.5mg·L–1)进行胁迫处理。
试剂盒: RNAprep Pure Plant Kit(Polysaccharides$ polyphenolics-rich)多糖多酚植物总RNA 提取试剂盒(天根生化科技有限公司, Cat: DP121221);PrimeScript™ RT reagent Kit with gDNA Eraser(Perfect Real Time)反转录试剂盒(TAKARA, Code No.RR047A); CISTROME(Cat,#E0104S) 混合酶;StarPrep Gel Extraction Kit 胶回收试剂盒(GenStar 公司 ); SMARTer® RACE 5′/3′ Kit (Clontech,No.634858)试剂盒。
1.2 实验方法
1.2.1 总RNA 提取与反转录
红海榄叶片总RNA 的提取采用试剂盒的方法进行, 提取完成后利用NanoDrop Lite 型号紫外分光光度计检测 RNA 样品的浓度和纯度(OD260nm/OD280nm), 要求RNA 样品浓度高于30ng·µL–1, OD 比值在1.8~2.1 之间, 红海榄总RNA 经检测合格后进行反转录反应生成cDNA, 反转录反应采用试剂盒方法, 操作方法见说明书。
1.2.2 中间片段克隆
从NCBI 网站下载蔷薇超目植物的C4H 氨基酸序列, 将序列导入Base-by-Base 寻找保守区域, 将所得结果导入 j-CODEHOP 设计兼并引物C4H-F 和C4H-R 进行中间片段克隆(表1), 以红海榄cDNA 为模板, 使用CISTROME(Cat,#E0104S)混合酶进行中间片段克隆扩增, PCR 程序设置为95℃预变性3min,94 ℃ 30s、55℃ 30s、72 ℃ 1min, 35个循环, 72℃延伸10min, 反应结束后对PCR 产物进行1%琼脂糖凝胶电泳得到C4H基因中间片段, 利用试剂盒方法进行胶回收后送往华大基因公司测序。

表1 引物列表Tab.1 Primer list
1.2.3C4H基因cDNA 全长扩增
以红海榄C4H基因中间片段为模板, 利用Promer5.0 设计RACE 反应中的特异性引物。3′端反应体系的配制与RACE 试剂盒说明书一致, 扩增程序如下, 94 ℃ 30s、62 ℃ 30s、72 ℃ 3min, 28个循环。5′端按照RACE 试剂盒方法得到条带不清晰,故以RACE 试剂盒中反转录生成的第一链cDNA 为模板, C4H-NGSP-5′和UPM 为引物进行PCR 扩增,程序如下95℃预变性3min, 94 ℃ 30s、53 ℃ 30s、72 ℃ 1min, 35个循环, 72℃延伸10min, PCR 产物进行1%琼脂糖凝胶电泳后胶回收送往华大基因公司测序, 得到3′和5′端序列后进行拼接得到C4H基因cDNA 全长。
1.2.4C4H基因生物信息学分析
生物信息学分析所利用的软件、网址等详见表2。

表2 生物信息学分析软件或网址Tab. 2 Bioinformatics analysis software or website
1.2.5 基因表达差异分析
为研究重金属处理下RsC4H基因的表达变化情况, 在重金属处理后的第0h、3h、6h、12h、1d、2d、3d、4d、5d、6d、7d、10d 分别剪取3 片新鲜的、无机械损伤的嫩叶进行qRT-PCR 反应, 本实验采用非特异性 SYBRGreenI 染料法在杭州博日FQD-96AQPCR 仪中进行。qRT-PCR 引物详见表1,以红海榄 18S rRNA 作为内参基因, 实验结果用2–ΔΔCT表示。利用SPSS21 进行单因素方差分析, 分析不同处理时间下红海榄叶片RsC4H基因的表达量与初始表达量之间的差异, 标注*的数据代表与对照组具有显著性差异(P<0.05)。
2 结果与分析
2.1 RsC4H 基因的克隆
将3′和5′端序列进行拼接后得到红海榄C4H基因的cDNA 全长, 将其命名为RsC4H基因。RsC4H基因全长为2006bp, BLAST 比对结果显示其与银白杨C4H基因(Populus alba, XM_035065468.1)同源性高达83.49%, 与山葡萄C4H基因(Vitis amurensis,MH045992.1)同源性达84.46%, 与橡胶树C4H基因(Hevea brasiliensis, XM_021825151.1) 同源性达82.69%, 证明克隆得到的基因全长确实是红海榄的C4H基因序列。RsC4H基因从271 号核苷酸到1842号核苷酸为开放阅读框区域, 开放阅读框长1572bp,共编码523 个氨基酸(图1)。

图1 RsC4H 基因的ORF 与编码氨基酸序列Fig. 1 ORF and coding amino acid sequence of RsC4H gene
2.2 RsC4H 蛋白理化性质分析
RsC4H 蛋白的理化性质结果显示, 红海榄C4H蛋白相对分子量为60.18kD, 预测等电点为8.96。其中包含异亮氨酸(Leu)60 个占整个氨基酸序列的11.5%, 缬氨酸(Val)42 个占8.0%, 带负电荷的残基总数 Asp + Glu 共63 个, 带正电荷的残基总 Arg +Lys 共 71 个, 原子总数 8567 个, 分子式为C2748H4317N743O742S17, 脂肪族指数为99.87, 亲水性的平均值(GRAVY)为–0.168(<0), 是亲水性蛋白质,不稳定指数为44.09(>40), 属于不稳定蛋白。将红海榄C4H 氨基酸序列输入ProtScale 在线分析红海榄C4H 蛋白的疏水-亲水性, 结果显示RsC4H 蛋白在N 端有一个明显的疏水峰, 在C 端有两个比较明显的疏水峰。在第19 位氨基酸的疏水性最强, 分值达到3.611, 在第416 位氨基酸的亲水性最强, 分值是–2.711, 整体上亲水区更多, 亲水性的平均值为–0.168, 为亲水性蛋白。
2.3 RsC4H 蛋白二级结构与三级结构预测
利用SOPMA 在线软件对RsC4H 蛋白的二级结构进行预测, 结果显示RsC4H 蛋白包含47.42%的α 螺旋(Alpha-helix), 15.11%的β 折叠(extended strand), 4.78%的β 转角(beta-turn)和32.70%的无规则卷曲(random coil), 红海榄C4H 蛋白的二级结构以α 螺旋和无规则卷曲为主。利用SWISS-MODEL在线软件进行三维模型构建, 以高粱C4H(6vby.1.A)三维模型为模板, 氨基酸序列同源性达76.53%, 构建出红海榄的C4H 蛋白的三维模型(图2)。结果显示RsC4H 蛋白含有大量的α-螺旋,中间由无规则卷曲进行连接, 这与SOPMA 二级结构的预测结果保持一致。

图2 红海榄C4H 蛋白的三维模型(SWISS-MODEL)Fig. 2 Three-dimensional model of RsC4H protein(SWISS-MODEL)
2.4 RsC4H 蛋白跨膜螺旋与信号肽预测
利用TMHMM 2.0 在线工具对RsC4H 蛋白进行跨膜螺旋预测, 结果显示 RsC4H 蛋白共有两个跨膜螺旋结构, 在肽链的N 端和C 端各含一个, 1—3号氨基酸在膜结构外侧, 4—23 号氨基酸为跨膜螺旋,24—503 号氨基酸在膜结构内侧, 504—522 号氨基酸为跨膜螺旋, 523 号氨基酸在膜结构外侧。利用SignalP 4.0 Server 对RsC4H 蛋白信号肽进行分析,结果显示其Y值、S值很小, 均小于0.5, 表明该蛋白不存在信号肽酶切位点, 红海榄C4H 蛋白没有信号肽。
2.5 RsC4H 蛋白保守结构域查询与亚细胞定位
利用NCBI 网站Conserved Domain Search 功能寻找保守结构域, 结果显示红海榄C4H 蛋白含一个保守结构域PLN02394, 属于细胞色素P450 超家族。对RsC4H 蛋白进行亚细胞定位分析, 预测结果显示红海榄的C4H 蛋白是一种膜结合蛋白, 主要存在于膜结构上或内质网上。
2.6 RsC4H 蛋白系统发育树构建
由于目前对红树植物的C4H基因研究很少, 除秋茄C4H基因的部分cDNA 序列被克隆出来以外,基本找不到红树植物的C4H 氨基酸序列或基因序列,所以将红海榄的C4H 蛋白与从NCBI BLAST 结果中选取的麻风树(Jatropha curcas, XP_01207817 6.1)、决明(Senna tora, KAF7816240.1)、笋瓜(Cucurbita maxima, XP_023007159.1)、南瓜(Cucurbita moschata, XP_022947682.1)、雷公藤(Tripterygium wilfordii, XP_038693505.1)、莲花(Nelumbo nucifera, XP_010253046.1)、芍药(Paeonia lactiflora, AGG55322.1)、橄榄(Canarium album,ACR10242.1)、喜树(Camptotheca cuminata, ANR763 95.1)、可可树(Theobroma cacao, EOY20175.1)、地黄(Rehmannia glutinosa, QOJ53928.1)美国黑树莓(Rubus occidentalis, ACM17896.1)等12 个植物的C4H 蛋白, 用 MEGA6 中 Phylogeny 模块下的Neighber-joining 方法, Bootstrap 值设置为1000,构建了系统发育树, 分析不同物种的C4H 蛋白之间的进化关系(图3) , 系统发育树结果显示红海榄和笋瓜(CuCurbita maxima, XP_023007159.1)、南瓜(CuCurbita moschata, XP_022947682.1)的C4H 蛋白聚在一个小分支, 表明它们的亲缘关系更近, 而南瓜、笋瓜与红海榄都属于蔷薇超目, 系统发育树的结果与它们在植物分类系统上的地位一致, 表明系统发育树具有可信度。

图3 C4H 蛋白的系统发育树Fig. 3 Phylogenetic tree of C4H protein
2.7 RsC4H 基因表达差异分析
利用qRT-PCR 技术检测红海榄幼苗在遭受重金属胁迫10 天内叶片中C4H基因的表达情况, 结果如图4 所示。RsC4H基因在重金属胁迫下除在第3h表达量显著高于初始值外, 其他时间内表达量与初始值无显著差异(P>0.05)。RsC4H基因在重金属胁迫下的3h 内大幅上调, 在第3h 时表达量达到最大值, 显著高于初始表达量(P<0.05), 达到处理前的4.29 倍, 随后迅速回落, 从第6h 到第6 天RsC4H基因表达量均略低于初始表达水平, 小幅度波动, 从第7 天之后逐渐稳定, 在第10 天时表达量为初始表达量的1.66 倍左右, 但是差异并不显著。整体上,重金属胁迫下红海榄C4H基因的表达水平有所提高, 这有利于木质素的合成, 增加细胞壁厚度, 进而阻止金属离子进入细胞, 减弱金属离子对植株的损害。
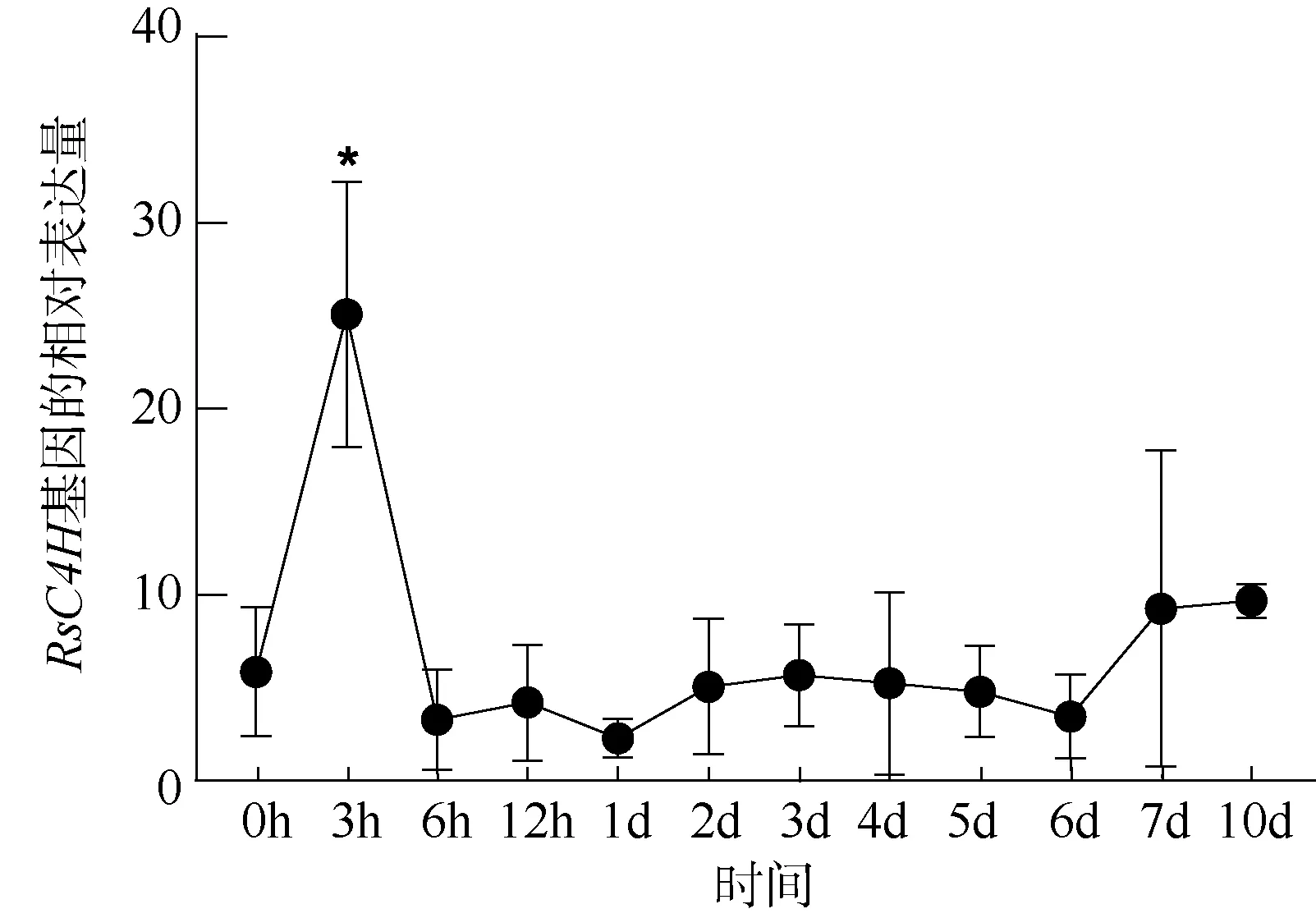
图4 重金属胁迫下红海榄C4H 基因的表达情况Fig. 4 The expression of RsC4H gene under heavy metal stress
3 讨论
苯丙烷代谢途径可合成多种植物次生代谢产物,包括黄酮类化合物、木质素、香豆素等, 是植物重要的次生代谢途径, 在植物生长发育、机械支持、防御反应等方面发挥重要作用(Winkel-Shirley,2001)。苯丙烷代谢途径由苯丙氨酸在苯丙氨酸解氨酶的作用下生成反式肉桂酸, 反式肉桂酸在肉桂酸-4-羟化酶催化下生成香豆酸, 香豆酸在4-香豆酸辅酶A 连接酶的作用下产生香豆酰辅酶A, 然后进入黄酮、木质素等化合物的下游合成途径。当植物中C4H基因的表达受到抑制时, 植物木质化程度降低,总木质素含量以及木质素单体的含量降低, 据此认为C4H基因的表达直接影响植物木质素的合成(Blee et al, 2001; Sykes et al, 2015) 。而植物木质素含量的增加可以增加细胞壁的厚度, 阻止重金属离子进入细胞, 细胞壁的阻挡作用是植物耐受重金属胁迫的第一道屏障, 因此C4H基因的表达对于植物耐受重金属胁迫有重要作用。
本研究利用同源克隆技术和RACE 方法扩增得到了红海榄C4H基因的cDNA 全长, 其开放阅读框长1572bp, 共编码523 个氨基酸。红海榄C4H 蛋白是不稳定的亲水性蛋白, 有一个P450 功能结构域,在N 端和C 端分别含有一个跨膜螺旋, 无信号肽, 亚细胞定位显示其是一种膜结合蛋白, 主要在膜结构或内质网上发挥功能, 二级结构主要为α 螺旋和无规则卷曲。通过构建系统发育树发现, 红海榄和笋瓜、南瓜的C4H 蛋白聚在同一个小分支, 它们的C4H 蛋白亲缘关系更近。系统发育树中的标尺为0.01, 指遗传变异度为1%, 表明发育树中各物种的C4H 蛋白变化度很小, C4H 蛋白保守性很强, 预测由于C4H 蛋白是植物响应逆境胁迫的重要酶, 所以具有比较高的遗传稳定性, 物种间的差异较小。
肉桂酸-4-羟基化酶基因可以受多种胁迫条件诱导表达, 比如寒冷、水杨酸、脱落酸处理等都会诱导植物C4H基因的表达(Cheng et al, 2018), 海南龙血树在脱落酸、油菜素内酯、茉莉酸、紫外线等多种胁迫处理时,DcC4H基因的表达量均会上调(梁惠桢 等, 2018), 而肉桂酸-4-羟基化酶可以介导木质素的合成(Umemoto et al, 2016)。C4H基因在大麻叶中的高度表达导致了木质素含量的增加(Docimo et al, 2013), 莲雾果实C4H基因的表达水平和木质素含量呈正相关关系, 且两者的相关系数高达0.972 (黄利娜 等, 2020), 以上研究均证实了C4H基因的表达对于木质素的合成有促进作用。本研究中,红海榄在遭受重金属胁迫时,C4H基因的表达量先快速提高, 在第3h 时表达量达最大值, 这表明该基因对重金属胁迫的响应十分迅速, 在受到重金属胁迫后快速提高了C4H基因的表达量, 促进木质素的生成, 阻止金属离子进入细胞, 随后表达量出现快速回调, 但随着胁迫时间的延长,C4H的表达量也开始逐步稳定, 虽然与对照组无显著差异, 但有高于初始表达水平的趋势。在重金属胁迫下红海榄C4H基因表达量整体上表现出上调趋势, 据此认为RsC4H基因参与了红海榄抗重金属胁迫的响应过程,促进了木质素的生成, 阻止金属离子进入细胞, 对于红海榄耐受重金属胁迫有积极作用。
4 结论
本研究克隆得到了红海榄C4H基因的 cDNA全长, 其开放阅读框长1572bp, 共编码 523 个氨基酸, 编码蛋白的相对分子量为60.18kD, 包含2 个跨膜螺旋结构和一个P450 家族功能结构域, 是一个不稳定的亲水性蛋白, 无信号肽, 二级结构以α 螺旋和不规则卷曲为主, 亚细胞定位显示主要在膜结构或内质网上发挥作用。红海榄C4H 蛋白与其他物种的C4H 蛋白同源性很高, 预测它们的功能也相似,包括催化反式肉桂酸生成香豆酸、促进木质素的合成及参与多种胁迫应急反应。在重金属胁迫下, 红海榄C4H基因可以快速响应重金属胁迫, 在红海榄机体抗重金属胁迫响应的初始阶段就开始发挥作用, 促进木质素合成, 增加细胞壁厚度, 阻止金属离子进入细胞对植株造成损伤。红海榄C4H基因的成功克隆, 丰富了红海榄抗性基因库的内容, 为进一步探究红海榄耐受重金属胁迫的分子机制提供了基础资料。
