三亚湾珊瑚来源虫黄藻不同株系微环境中微生物群落结构的差异比较分析
2022-12-05黄思军邱晨龙超龙丽娟
黄思军, 邱晨, 龙超, 龙丽娟,4
1. 中国科学院热带海洋生物资源与生态重点实验室, 中国科学院南海海洋研究所, 广东 广州 510301;
2. 南方海洋科学与工程广东省实验室(广州), 广东 广州 511458;
3. 中国科学院大学, 北京 100049;
4. 三亚海洋生态环境工程研究院, 海南 三亚 572000
珊瑚礁生态系统是地球上生物多样性最高的生态系统之一, 以不到 1%的海洋表面积维持着约25%的海洋生物的生存和繁衍(Spalding et al, 2001)。珊瑚依赖于与虫黄藻的共生关系, 使其在寡营养的环境中也能得以生存(Muscatine et al, 1977)。在这种共生关系中, 虫黄藻可为珊瑚提供高达95%的碳源,而珊瑚则为虫黄藻提供无机碳进行光合作用(Muscatine, 1990)。虫黄藻在较长时间内被认为是一个单一物种——小亚德里亚共生藻(Symbiodinium microadriaticum) (Freudenthal, 1962), 但随着对虫黄藻超微结构的进一步研究, 发现不同虫黄藻藻株在宿主识别(Schoenberg et al, 1980)、形态学(Blank et al,1989; Trench et al, 1995)、染色体数目和体积(Blank et al, 1985)、类菌胞素氨基酸(mycosporine-like amino acids, MAAs) (Banaszak et al, 2000)等方面具有明显差异。后来遗传方法的应用, 如比较核糖体小亚基rRNA 序列(Rowan et al, 1991)、大亚基rRNA序列(van Oppen et al, 2001)、转录间隔区(ITS1、
ITS2)(Pochon et al, 2001; Rodriguez-Lanetty et al,2004)、叶绿体psb基因(Moore et al, 2003)、线粒体COX1 基因(Takabayashi et al, 2004)等, 加速了虫黄藻分类学的发展。之后, 随着进化枝 I 的发现,Symbiodinium属被分为 9 个谱系(Clade A—I)(Pochon et al, 2010)。Lajeunesse 等(2018)提出将Symbiodinium属提升为Symbiodinaceae 科, 将之前的9 个进化枝细分为15 个谱系(相当于属), 并正式描述了其中的7 个。
虫黄藻与珊瑚的研究已获得了重要的认识。Bongaerts 等(2010)发现珊瑚宿主的基因型与虫黄藻的组成密切相关, 珊瑚也可以与多种虫黄藻共生(Blackall et al, 2015)。Mizuyama 等(2020)推测虫黄藻的基因型可能会影响珊瑚宿主的生态差异, 这可能有助于珊瑚适应复杂的生存环境。然而, 珊瑚共生功能体(holobiont)并不仅限于虫黄藻和珊瑚, 极其多样的珊瑚细菌群落的作用也不容忽视(Rohwer et al, 2001)。众多研究已表明珊瑚可能具有特异性的细菌群落(Rohwer et al, 2002; Wegley et al, 2007;Morrow et al, 2012; Sharp et al, 2012; Bayer et al,2013; Bosch, 2013), 一些细菌在珊瑚系统的硫循环和碳循环中扮演着重要的角色(Raina et al, 2010;Rädecker et al, 2015), 另一些则有利于珊瑚的健康,如珊瑚粘液中发现的具有抵抗致病菌弧菌的细菌(Nissimov et al, 2009)。在全球变暖的背景下, 研究人员发现珊瑚白化过程伴随着虫黄藻的离开及细菌群落的显著变化(Bourne et al, 2008; Grottoli et al,2018; Yang et al, 2021)。这些都表明珊瑚、虫黄藻与细菌群落之间的关系密不可分(Bourne et al, 2016)。
虽然珊瑚—细菌, 虫黄藻—珊瑚的关系已被广泛研究, 但虫黄藻与细菌之间的关系却长期被忽视(Matthews et al, 2020)。藻细胞可以产生有机分子在其周围形成藻际环境, 生存于藻际环境的细菌被称为藻际细菌(Seymour et al, 2017)。藻菌之间的关系是既密切又复杂的, 且可以长期保持稳定。藻吸引过来的有益细菌可以通过消耗氧来缓解藻生长过程中的氧气压力, 或矿化有机物为藻提供无机营养盐,甚至可以为藻类提供维生素, 但细菌的大量繁殖反过来也会抑制藻的生长(张增虎 等, 2018)。早期Ainsworth 等(2015)通过采集珊瑚不同部位的样本揭示了共生虫黄藻所在的内胚层与上皮细胞及表面黏液层细菌群落的显著差异, 但虫黄藻所在环境还包含了其他生物存在, 所以原位采样并不能准确得到虫黄藻密切相关的细菌群落。因此目前研究虫黄藻藻际微生物群落主要通过离体培养的方法(Lawson et al, 2018; Camp et al, 2020; Maire et al, 2021)。随着核心微生物组的概念被提出(Turnbaugh et al, 2007),也逐渐应用在珊瑚领域(Ainsworth et al, 2015;Lawson et al, 2018; Pootakham et al, 2021)。珊瑚的核心微生物组一般被定义为出现频率30%~100%的微生物类群(Hernandez-Agreda et al, 2017), 核心的定义可以是对于几种珊瑚共有的微生物类群而言, 也可以是对于某种珊瑚时间尺度上持续存在的微生物类群而言(Shade et al, 2012)。探寻不同属虫黄藻的藻际核心微生物群落具有重要的意义, 这些微生物可能对虫黄藻提供关键功能。
近年来, 南海三亚湾鹿回头海域珊瑚礁在人类活动和全球变化的共同影响下, 覆盖率已经下降了70%左右(Zhao et al, 2012)。我国学者对该地区珊瑚共附生微生物进行了大量的研究: Zhou 等(2011)对该区域44 种珊瑚的虫黄藻类型做了详细的调查, 发现主要为C、D 型虫黄藻; 李淑 等(2011)发现虫黄藻密度整体呈现夏季低、冬季高的特点; Li 等(2014)揭示了澄黄滨珊瑚的黏液、组织和骨骼的细菌群落的季节变化; 吴家法 等(2015)发现放线菌门、α—变形菌纲、γ—变形菌纲、厚壁菌门和拟杆菌门为四种珊瑚来源的主要菌群。然而, 尚未有文献对该珊瑚礁区域分离的虫黄藻进行藻际细菌群落的系统分析。本研究对该区域珊瑚组织分离出的5 个属的6株虫黄藻进行了离体培养, 旨在研究不同株系虫黄藻藻际细菌群落结构的差异, 并找出与虫黄藻相关的核心细菌类群。
1 材料与方法
1.1 虫黄藻纯系藻株的获得、培养、DNA 提取和测序
6 株虫黄藻(表1)从中国海南省三亚鹿回头海域(109°28′26″E, 18°12′43″N)的4 种珊瑚的骨骼表面组织中分离纯化获得。珊瑚样本的初处理和虫黄藻纯系的获取按照Yang 等(2020)描述的方法进行。经纯化后的藻细胞置于装有IMK 培养基的玻璃培养瓶,在盐度 34‰、温度 23℃、光照强度为 60μmol photons·m–2·s–1、明暗周期为14h:10h 的环境条件下培养。待指数生长期时取藻液离心去除上清液得到藻细胞, 使用E.Z.N.A.® HP Plant DNA kit (Omega Bio-Tek, USA)试剂盒提取基因组DNA。藻株的ITS2序 列 使 用 引 物 ITS intfor2 (5'—GAATTGC AGAACTCCGTG—3')和 ITS2 CLAMP (5'—GGG ATCCATATGCTTAAGTTCAGCGGGT—3') (Qin et al, 2019)PCR 扩增得到, PCR 产物由上海美吉生物医药科技有限公司进行测序。另外, 依据培养过程中虫黄藻对玻璃基质培养瓶的附着能力差异, 分为悬浮型虫黄藻(SYSC-2-8、SYSC-14-11)和贴壁型虫黄藻(SYSC-2-1、SYSC-17-3、SYSC-24-3、SYSC-28-9): 贴壁型虫黄藻大部分藻细胞在培养瓶底部贴壁生活, 小部分存在于藻液中; 悬浮型虫黄藻则绝大部分藻细胞悬浮生活, 几乎无藻细胞贴壁。

表1 虫黄藻藻株来源及分类信息Tab. 1 Source and taxonomic information of zooxanthellae strains
1.2 虫黄藻分类鉴定
藻株的ITS2 基因型在非冗余虫黄藻ITS2 数据库Sym-ITS2 (http://sym-its2.marinegenomics.cn)进行匹配得到(Shi et al, 2021)。再结合NCBI 核苷酸数据库(https://www.ncbi.nlm.nih.gov/)ITS2 序列比对的结果(Altschul et al, 1990)以及系统发育分析对虫黄藻分类进行进一步的确认。系统发育分析所需的参考序列选自NCBI 核苷酸数据库中与本实验6株虫黄藻相近的23 株虫黄藻(A—E 型)的ITS2 序列,选择甲藻Ansanella granifera作为外群。系统发育树由MEGA X 软件中的最大似然法构建(Kumar et al, 2018), 使用Hasegawa—Kishino—Yano (HKY)模型计算, 可信度检测1000 次, 并通过在线可视化工具(EvolView v3)进行可视化(Subramanian et al,2019)。
1.3 实验设计
实验在纯系藻株培养半年后开展, 期间定期将培养物转移至新的培养基以保持虫黄藻活性。此时虫黄藻藻际细菌群落已经稳定, 且与虫黄藻密切相关的细菌类群被保留下来(Behringer et al, 2018;Mönnich et al, 2020)。为了比较虫黄藻不同株系微生物群落的差异, 取指数生长期的6 株虫黄藻培养至平台期并收集藻液, 藻培养条件同上, 实验设置3个生物学重复。参照Liu 等(2019)对颗粒粒径的分类方法, 使用3μm 的孔径将培养物藻液中的细菌分成两类: 自由生细菌和颗粒附着生细菌。藻液用注射器挤压的方式依次通过装有3μm 和0.2μm 聚碳酸酯膜(PC, 25mm, Millipore, United States)的可更换膜过滤器(25mm, Whatman, UK), 并收集3μm 和0.2μm滤膜, 即3μm 和0.2μm 样本。预实验已验证3μm 滤膜可完全截留所有的藻细胞, 因此3μm 滤膜上的细菌主要为藻液中附着藻细胞颗粒的细菌, 图中标记为“3μm”。0.2μm 滤膜上的细菌主要为自由生细菌,图中标记为“0.2μm”。对于贴壁型虫黄藻(4 株), 还额外采集了沉底贴壁的培养物——Settling 样本(将上层藻液倒尽后, 用无菌刀片刮取获得), 图中标记为“Settling”, Settling 样本的细菌主要附着在沉底贴壁的藻细胞上。0.2μm、3μm 和Settling 样本代表着藻际细菌群落的三类细菌。所有样本(n=48): 虫黄藻的3μm 和0.2μm 样本各6 株(n=36, 包含三个生物学重复), 以及4 株贴壁型藻的Settling 样本(n=12, 包含三个生物学重复), 均液氮速冻储存在–80℃冰箱直至DNA 提取。
1.4 DNA 提取和16S rRNA 基因测序
为避免试剂盒带来的误差, 所有样本的DNA均使用DNeasy PowerSoil Kit (MoBio Laboratories,Carlsbad, CA)提取, 液氮速冻后立即储存在–80℃冰箱中待分析。选择 515FmodF-806RmodR 引物(Walters et al, 2015)对细菌16S rRNA 基因的V4 高变区进行聚合酶链式反应(polymerase chain reaction,PCR)扩增, 该过程在ABI GeneAmp®9700 (applied biosystems, thermofisher scientific)仪器上进行。每个反应包含 10ng DNA 模板、0.8μL 正向引物(5μmol·L–1)、0.8μL 反向引物(5μmol·L–1)、5×transStart FastPfu 缓 冲 液 4μL、0.2μL BSA、2μL dNTPs(2.5mmol·L–1)、0.4μL FastPfu Polymerase, 添加无核酸酶水(thermofisher)至总体积为20μL。每个样本设置3 个PCR 重复。PCR 条件为: 95℃预变性3min,95℃变性30s, 55℃退火30s, 72℃延伸45s, 30 个循环, 72℃延伸10min, 产物最后在10℃保存。PCR 产物在2%琼脂糖凝胶上检测, 然后用AxyPrep DNA Gel Extraction Kit 回收290~310bp 的PCR 产物。用Quantus Fluorometer 定量后, 根据每个样本的测序量要求, 将样本按对应比例混合。每个样本的PCR纯化产物的扩增子文库由 NEXTFLEX Rapid DNA-Seq Kit (Bioo Scientific, United States)按照标准程序制备, 利用Illumina 公司的Miseq PE300 平台进行测序(上海美吉生物医药科技有限公司)。
1.5 16S rRNA 基因序列分析
16S rRNA 基因序列选择QIIME2 v 2021.2(Bolyen et al, 2019)进行分析, 具体步骤按Maire 等(2021)的方法进行, 得到扩增子序列变异(amplicon sequence variant, ASV)表及代表序列。基于与SILVA 138 (Quast et al, 2013)数据库中16S rRNA基因的 V4 区域 70%的相似性, 利用 featureclassifier 插件通过预先训练的朴素贝叶斯分类器进行代表序列的注释。过滤掉线粒体和叶绿体序列, 得到最后的注释表。测序原始序列及处理过程见附表S1, 将样本元数据文件、ASV 表、注释表导入R 进行统计分析。
1.6 统计分析
细菌群落分析使用R 版本4.1.1 和phyloseq、vegan、ggplot2、tidyverse、indicspecies、yyplot、ggBubbles、VennDiagram、UpSetR 包进行统计和绘图。对所有样本序列进行抽平(按照所有样本中最小的序列数)后, 每个样本含有27069 条序列, 该深度足以捕获样本间的多样性。选取 Chao1 指数、Shannon 指数和Pielou 指数作为α 多样性指标, α 多样性数据两组间的差异用Mann-Whitney U 检验进行比较。群落组成(β 多样性)的差异使用Bray-Curtis相异矩阵计算, 整体差异的显著性通过相似性分析(ANOSIM)进行检验, 两两之间的显著性则在整体差异显著后用置换多元方差分析(permutational multivariate analysis of variance, PERMANOVA)进一步确定, 使用多维尺度变换(non-metric multidimensional scaling, NMDS)进行排序分析。16S rRNA 基因数据都具有3 个生物学重复。物种组成分析时丰度取3 个重复的平均值作为结果, 其余需要统合分析时将至少在两个生物学重复中出现的ASV 定义为该样本的ASV 再进行分析。参照Maire等(2021)对细菌核心属的定义, 把存在于所有藻株的属定义为核心属, 得到A—E 型虫黄藻的核心属,以及3 种粒径样本各自的核心属。
2 结果
2.1 虫黄藻的分类鉴定
选取本实验中的6 株虫黄藻的ITS2 序列和23株相近的虫黄藻序列进行系统发育树重建(图1)。结合虫黄藻的 ITS2 基因型, 得到藻株的分类结果:SYSC-17-3 属于Symbiodinium属(A6 型, ITS2)、SYSC-28-9 属于Breviolum属(B1 型), SYSC-2-1 属于Cladocopium属 (C1 型 ), SYSC-24-3 属 于Durusdinium属(D1 型), SYSC-2-8 与SYSC-14-11 属于Effrenium属(E101 型), 用MEGA X 软件进行序列比对后发现SYSC-2-8 和SYSC-14-11 的ITS2 序列相似度为100%。
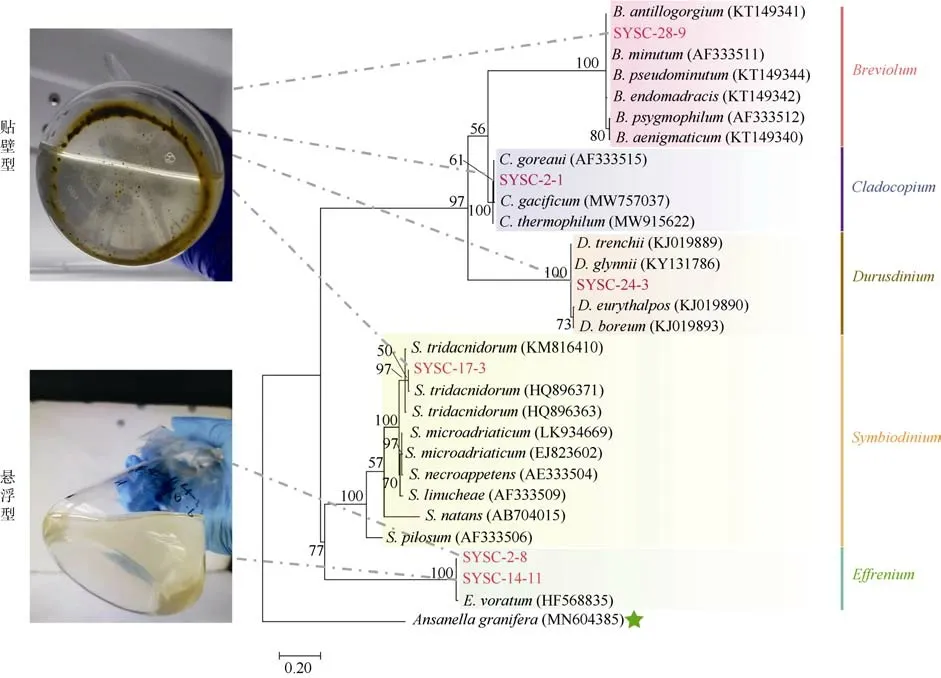
图1 基于ITS2 序列构建的系统发育树(ML 法)本实验的6 株虫黄藻用红色字体标注。Ansanella granifera 为外类群。支上的数字为1000 次自展支持率(%)。6 株虫黄藻被分为贴壁型(SYSC-2-1, SYSC-17-3, SYSC-24-3, SYSC-28-9)和悬浮型(SYSC-2-8 和SYSC-14-11)Fig. 1 Maximum-likelihood phylogenetic tree based on ITS2 sequences. The six strains of zooxanthellae in this experiment are marked in red. Ansanella granifera is used as the outgroup. The bootstrap value (%) with 1000 replicates is shown above the branch. The six zooxanthellae strains are classified into anchorage-dependent living lifestyle (SYSC-2-1, SYSC-17-3,SYSC-24-3, SYSC-28-9) and free-living lifestyle (SYSC-2-8 and SYSC-14-11), as indicated in the pictures
2.2 虫黄藻藻际细菌的多样性和组成
序列抽平后共有629 个ASVs 进入到之后的α和β 多样性分析。所有样本中古菌的序列占比均小于0.133%, 由于其相对丰度极低, 本研究中的以下结果将描述为“细菌群落”。
Chao1 指数可以指示物种丰富度, Pielou 指数反映群落中物种的均一程度, Shannon 指数则反映群落的整体多样性。基于这3 种α 多样性指数对这6 株藻的平台期样本细菌群落进行比较, 两两之间显著性差异采用Mann-Whitney U 检验。发现3μm 和0.2μm 样本中贴壁型虫黄藻细菌群落的Chao1 指数均显著高于悬浮型藻(P<0.05, 图2a;P<0.001, 图2b),其Settling 样本菌群的Chao1 指数也显著大于悬浮型虫黄藻的3μm 样本菌群(P<0.01, 图2b、c)。这说明贴壁型虫黄藻不论在自由生细菌(0.2μm)还是附着藻细菌(3μm 和Settling)物种丰富度均显著大于悬浮型虫黄藻。3μm 样本中贴壁型虫黄藻的Shannon指数也显著高于悬浮型虫黄藻(P<0.01, 图2h), 但这可能是由于Chao1 指数的巨大差异造成的, 因为Pielou 指数无显著差异。
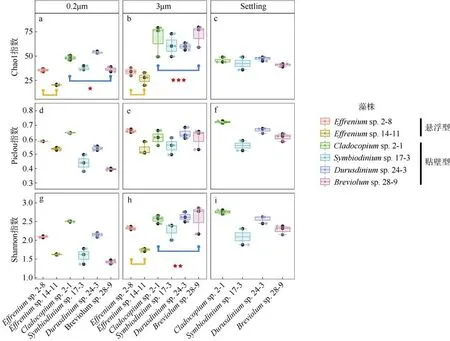
图2 6 株虫黄藻藻际细菌群落的Alpha 多样性(Chao1、Pielou、Shannon 指数)包括所有虫黄藻藻株的3μm 和0.2μm 样本, 及4 株贴壁型藻的Settling 样本。显著性标记***表示P<0.001; **表示P<0.01; *表示P<0.05Fig. 2 The α diversity indices (Chao1, Shannon, Pielou) of phycosphere bacterial communities in six zooxanthellae strains,including 3 μm and 0.2 μm samples of all zooxanthellae strains, as well as “Settling” samples of four anchorage-dependent living algae. Significance code: ***, P <0.001; **, P <0.01; *, P <0.05
基于NMDS 分析发现, 3 株贴壁型虫黄藻(A、B、D 型)的细菌群落结构相似, 且按3 种粒径的样本聚类,而同为贴壁型的C 型虫黄藻的细菌群落则明显独立于其他藻株。另外2 株悬浮型藻株(E 型)在NMDS 图中位置相近, 说明二者具有类似的细菌群落。统计分析表明, 首先, 假设藻际细菌群落包含3μm、0.2μm 以及Settling 样本(贴壁型虫黄藻特有), 不考虑3 种样本之间细菌比例影响, 则6 株虫黄藻藻际细菌群落结构整体之间具有显著差异(ANOSIM,P=0.001); 其次, 除了3 株虫黄藻(A、B、D 型)两两之间无明显差异, 6 株虫黄藻细菌群落两两之间均存在显著差异(PERMANOVA,P<0.05, “bh”法校正); 另外, 对于任意一株贴壁型虫黄藻, 其3 种粒径样本整体上存在显著差异(ANOSIM,P≤0.01)(图3)。
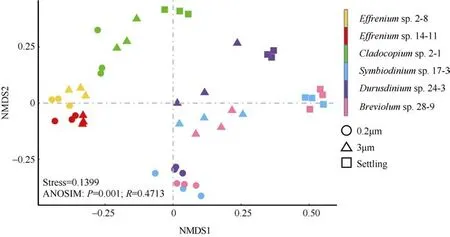
图3 基于Bray-Curtis 相异指数的虫黄藻藻际细菌群落的非度量多维标度(NMDS)分析ANOSIM 分析指示6 株虫黄藻藻际细菌群落的整体差异Fig. 3 Non-metric multidimensional scaling (NMDS) analysis based on the Bray-Curtis dissimilarity among bacterial community of zooxanthellae. Three types of samples are represented by different shapes (circles for 0.2μm samples, triangles for 3μm samples, and squares for Settling samples). The ANOSIM analysis indicates the overall similarity among the six algal strains
依据与非冗余SILVA 数据库比对得到的注释结果, 对虫黄藻不同株系3 种粒径样本的细菌群落进行分析。在门水平上, α-变形菌(Alphaproteobacteria)在所有样本中均占主导地位(>25%); 按0.2μm、3μm以及 Settling 的顺序, α-变形菌占比逐渐降低,Myxococcota 门占比逐渐升高, 这说明不同菌群对自由生活或是附着生活的选择不同; 不论是自由生细菌(0.2μm)或是附着藻细菌(3μm 和Settling), 悬浮型虫黄藻的α-变形菌的比例均明显高于贴壁型虫黄藻, 而浮霉菌(Planctomycetes)和Myxococcota 门的相对丰度则显著低于贴壁藻株(Mann—Whitney U testP<0.01); 除藻株 14-11(<1%)外, 拟杆菌门(Bacteroidota)在所有虫黄藻样本中均有一定的相对丰度(6% 38%)(图4a)。在属水平上, 所有藻株的0.2μm 和3μm 样本均含有较高比例的大洋柄菌属(Oceanicaulis, >9%)细菌, 但在贴壁型藻的Settling样本中占比则极低(<1%), 其更倾向于浮游生活。悬浮型虫黄藻与贴壁型虫黄藻在0.2μm 样本细菌属差异显著, 除了共有的大洋柄菌属(Oceanicaulis), 悬浮型虫黄藻以拉布伦茨氏菌属(Labrenzia, >10%)和红杆菌科未分类菌属(UC Rhodobacteraceae, >22%)为主, 而贴壁型虫黄藻主要以海命菌属(Marivita,除藻株2-1 外丰度>57.17%)为主。我们对悬浮型虫黄藻的主要附着藻细菌(3μm)与贴壁型虫黄藻的主要附着藻细菌(Settling)进行比较, 发现悬浮型虫黄藻主要附着藻细菌类群为大洋柄菌属(Oceanicaulis,>24%)、红杆菌科未分类菌属(UC Rhodobacteraceae,>12%)和海杆菌属 (Marinobacter, >7%), 而贴壁型虫黄藻的主要附着藻细菌为拉布伦茨氏菌属(Labrenzia, >15%)、nannocytastaceae 科未分类属(UC nannocytastaceae, >6%)和Ekhidna(>11%)。贴壁型虫黄藻的3μm 样本菌群兼具了0.2μm 和Settling 样本菌群的特征: 含有 0.2μm 样本的大洋柄菌属(Oceanicaulis)和海命菌属(Marivita), 及Settling 样本的拉布伦茨氏菌属(Labrenzia)和nannocytastaceae科未分类属(UC nannocytastaceae)。藻株2-1(C 型)的细菌群落似乎介于悬浮型藻与贴壁型藻的特征之间, 其Settling 样本具有明显的贴壁型藻株特征(主要菌群相似), 但 0.2μm 样本菌群缺少海命菌属(Marivita), 反而具有悬浮型藻株的优势菌群红杆菌科 未 分 类 菌 属(UC Rhodobacteraceae) 。 两 株Effrenium属的虫黄藻虽然优势菌群相似, 但在嗜青霉属(Algiphilus)、Pyruvatibacter属、Owenweeksia等属上具有显著差异(图4b)。
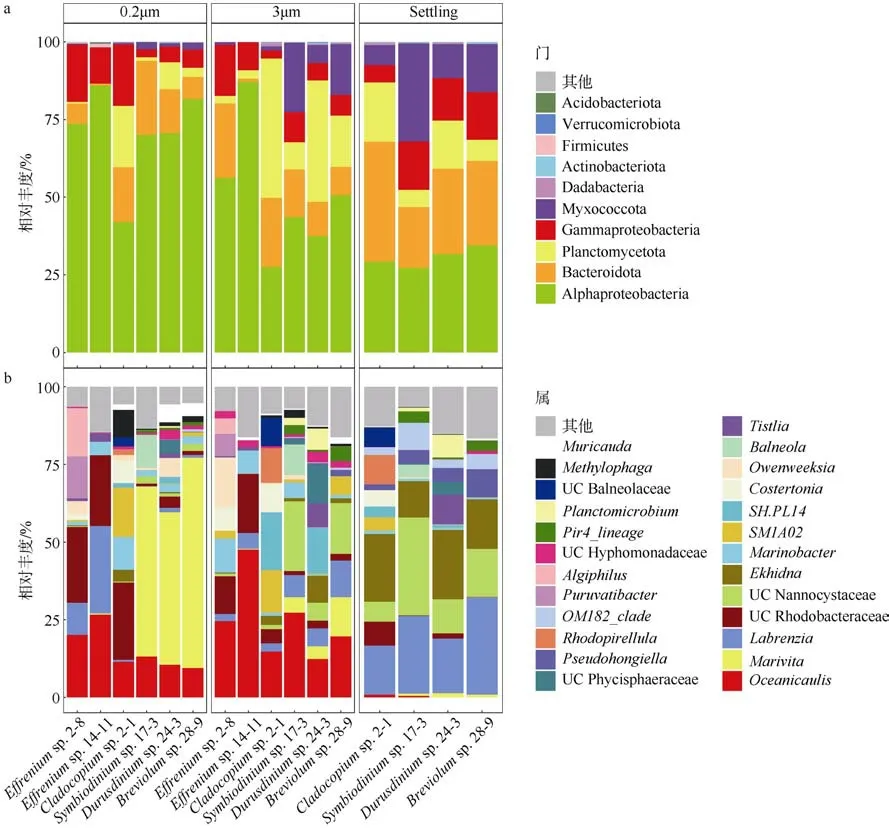
图4 虫黄藻藻际细菌群落在不同样本中的组成a. 门水平的虫黄藻藻际细菌群落物种组成, 在所有样本中总相对丰度<0.01%的属归为其他, 其中变形菌门细分为α-变形菌、β-变形菌和γ-变形菌; b. 属水平的虫黄藻藻际细菌群落组成图, 相对丰度<1%归为其他Fig. 4 Zooxanthellae associated bacteria community composition profiles in different samples(3 μm, 0.2 μm, Settling). (a)Bacteria community composition profiles at phylum level. Relative abundance <0.01% was classified into others. Phylum Proteobacteria was subdivided into α-Proteobacteria, β-Proteobacteria and γ-Proteobacteria. (b) Bacteria community composition profiles at genus level. Relative abundance <1% was classified into others
2.3 虫黄藻藻际细菌群落之间的共享及核心群落的鉴定
为了减小杂质ASVs 的影响, 将至少出现在两个重复中的ASV 定义为该藻样品的ASV。原本629个ASVs, 筛选过滤后得到120 个ASVs(19.1%)用于之后的分析。对于任意的一株藻: 其不同粒径样本中共享的ASVs 比例不低于75%, 3μm 样本的ASVs数最多, 几乎所有来自Settling 样本的ASVs 都与3μm 样本共享(图5)。从藻株之间ASVs 的共享来看,所有藻株只共享4 个ASVs, 藻株2-1 含有最高比例的特有 ASVs(28.85%), 藻株 2-8 则没有特有ASVs(图6)。两株藻之间共有的ASVs 占两株藻全部ASVs 的比例范围在12.33%~46.05%, 悬浮型藻和贴壁型藻同组内部藻株之间的共享ASVs 占比较二者组间明显更高(表2)。所有藻株均含有7 个属的细菌: 川西氏菌(Henriciella)、拉布伦茨氏菌属(Labrenzia)、海杆菌属(Marinobacter)、大洋柄菌属(Oceanicaulis)、生丝单胞菌科未分类菌属(UC Hyphomonadaceae)、红杆菌科未分类菌属(UC Rhodobacteraceae)和 nannocytastaceae 科未分类属(UC nannocytastaceae), 它们代表了A—E 型虫黄藻藻际核心细菌类群。之后, 我们比较了不同粒径样本各自的核心属, 发现0.2μm 样本和3μm 样本的核心属组成非常相似: 3μm 样本总共6 个核心属与0.2μm 样本共享了5 个, 且共享的属丰度比例也极其接近。Settling 样本核心属与0.2μm 样本和3μm样本有较大的差异, 例如在大洋柄菌属(Oceanicaulis)、海杆菌属(Marinobacter)上丰度较小,而在拉布伦茨氏菌属(Labrenzia)、Reichenbachiella、假洪吉氏菌属(Pseudohongiella)、OM182_clade、Ekhidna上拥有较高的丰度(图7)。
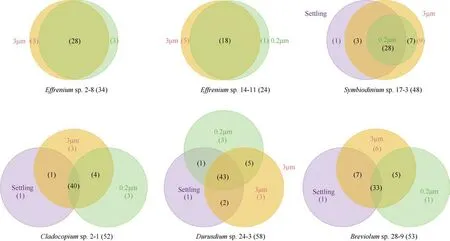
图5 虫黄藻藻际细菌基于ASV 水平在不同样本(3μm、0.2μm 和Settling)中的共享情况Fig. 5 Shared ASVs in different samples [3 μm, 0.2 μm and Settling (specific to anchorage-dependent living algae)] in each zooxanthellae strain
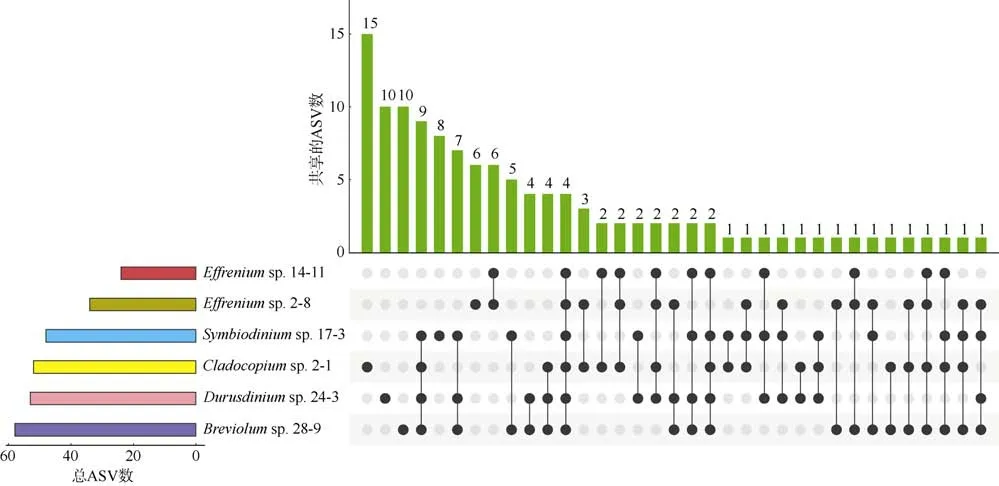
图6 不同虫黄藻细菌群落之间共享ASVs 的情况Fig. 6 The UpSet diagram showing the shared ASVs between different zooxanthellae strains
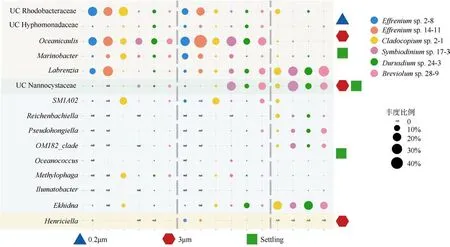
图7 6 株藻0.2μm、3μm、Settling 样本核心属之间的比较四个不同颜色的区域块对应着四种类型的核心属, 自上而下依次是: 0.2μm、3μm 和Settling 样本的核心属; 3μm 和Settling 样本的核心属; Settling 样本的核心属; 3μm 样本的核心属Fig. 7 Comparing the core genera in 0.2μm, 3μm, and Settling samples of 6 zooxanthellae strains. Four different colored area blocks correspond to 4 types of core genera, from top to bottom: core genera of 0.2 μm, 3 μm and Settling samples; core genera of 3μm and Settling samples; core genera of Settling samples; core genera of 3μm samples

表2 不同虫黄藻株两两之间共享ASVs 比例Tab. 2 The ratio of shared ASVs between different zooxanthellae strains
3 讨论
珊瑚共附生细菌群落的研究已有相当丰富的史料, 但虫黄藻与细菌之间的关系往往被忽视, 而珊瑚组织中的细菌群落中有一部分是与虫黄藻密切相关的。我们的研究通过离体培养的方法把虫黄藻与细菌联系起来, 藻株包括了悬浮型和贴壁型虫黄藻,涵盖了5 个属, 而类似研究并未包含Effrenium属(Lawson et al, 2018; Maire et al, 2021)。同时, 对藻株培养物3 种粒径(0.2~3μm, 自由生活; >3μm, 附着于藻体或颗粒物; Settling, 沉底贴壁藻体上)的样本进行了细菌群落分析, 0.2~3μm 粒径的细菌被认为是自由生细菌, >3μm 粒径的细菌被认为是吸附藻或颗粒物的细菌(Grossart et al, 2005), Settling 样本的细菌主要与沉底贴壁藻密切相关。
本研究的6 株虫黄藻均分离自珊瑚组织。悬浮型藻株2-8 和14-11 为Effrenium属虫黄藻, 该属虫黄藻被认为是营自由生活的, 且目前仅有一个物种(Lajeunesse et al, 2018)。另外四株藻为贴壁型虫黄藻:藻株17-3 为A6 型(ITS2), 目前该型只在砗磲组织中被发现或分离(Ishikura et al, 2004; Lajeunesse et al,2004); 藻株28-9、2-1、24-3 分别属于B1、C1 和D1 型, B1、C1 和D1 型虫黄藻均有被报道存在于珊瑚组织中(Garren et al, 2006; Zhou et al, 2012;Reichman et al, 2014; Ng et al, 2016; Gardner et al,2017)。对该区域珊瑚内共生虫黄藻的 ITS2 主要基因型进行核查, 发现我们分离出的虫黄藻类型往往不是珊瑚的优势类群, 如十字牡丹珊瑚的虫黄藻主要是C1 型(Zhou et al, 2011), 但我们却只分离出了B1 型虫黄藻。海南岛周边丛生盔型珊瑚虫黄藻类型主要是C、D 混合型(Zhou et al, 2017),但我们却分离出了A 和E 型。这说明由于操作和培养的种种原因影响, 没有达到预期的分离结果。藻株可能是珊瑚背景种或共附生于珊瑚。有研究指出珊瑚内共生的虫黄藻往往不可培养或难培养,所以分离得到的常为易培养的藻株(Hirose et al,2008)。
本研究中的虫黄藻藻际细菌群落的Chao1 和Shannon 指数显著低于相关虫黄藻离体培养的报道结果(Lawson et al, 2018; Camp et al, 2020)。这与分离培养的方法、藻株培养时间的长短等都有关。培养基、温度等因素会影响藻和细菌的生长(Sakamoto et al, 1997; Xiang et al, 2013), 分离时带入的污染杂菌也会对虫黄藻细菌群落造成影响; 随着培养时间的增长, 在操作分类单元(operational taxonomic unit,OTU)水平上一部分细菌会丢失, 但在属水平上仍能保持高度的保守性(>1a), 因此我们进行长时间的培养从而得到虫黄藻密切相关的细菌类群(Behringer et al, 2018; Mönnich et al, 2020)。另外我们发现Effrenium属虫黄藻的细菌物种丰富度要显著低于其他属, 该属虫黄藻被发现可以以蓝藻(Synechococcusspp.)等细菌以及小型微藻为食, 这可能会降低其藻际细菌物种的相对丰富度(Jeong et al, 2012)。
我们的研究表明, 变形杆菌(α, γ)为虫黄藻藻际环境的主要菌群(在3μm、0.2μm 和Settling 样本丰度均>25%), 这与培养研究的结果相近(Lawson et al,2018), 但现场采集的珊瑚内共生群落则放线菌相对丰度更高(Ainsworth et al, 2015)。这可能是由于原位环境并非只包括虫黄藻一类生物, 因此原位采样的结果并不能准确关联虫黄藻相关的细菌群落。我们发现, 悬浮型和贴壁型藻株对细菌的选择具有明显差异: 拉布伦茨氏菌属(Labrebzia)大量存在于悬浮型藻株的0.2μm 样本中, 而贴壁型藻株中比例却很小; 海命杆菌属(Marivita)则基本只存在于贴壁型藻中。这不太可能是培养基营养物质变化导致, 因为培养基的营养物质基本是过量的。最大可能是由于虫黄藻分泌的有机物类型不同(Gordon et al, 2010),导致其形成了不同的藻际细菌群落。恰巧的是E 型虫黄藻(悬浮型)被认为是不可共生的, 而A—D 型虫黄藻(贴壁型)被认为是可共生的, 或许共生关系与藻际细菌也存在关联。另外来自Effrenium属的两株藻2-8 和14-11 为同种虫黄藻, 但分离自不同珊瑚, 其优势菌属基本相似, 这表明细菌—虫黄藻之间可能是物种特异性的(Eigemann et al, 2013;Krohn- Molt et al, 2017; Kimbrel et al, 2019), 并不随珊瑚宿主改变。悬浮型虫黄藻自由生细菌与藻附着细菌群落相似, 这与类似的藻研究结果一致(Eigemann et al, 2013)。但对于任意的一株贴壁型虫黄藻, 其细菌群落3 种粒径样本整体存在显著差异, 特别是自由生细菌和沉底贴壁细菌之间的差异。但造成这种差异的原因不是菌群的不同, 事实上3 种粒径样本之间共享了绝大部分的ASVs, 差异的ASVs 所占比例较小, 各菌群相对丰度的差异才是导致同株藻不同样本细菌群落差异的原因。对于不同藻株之间的差异则可以用藻之间ASV 种类的差异来解释, 两株藻共享的ASVs 比例越高, 其细菌群落结构也越接近。
虫黄藻藻际细菌中的川西氏菌(Henriciella)、拉布伦茨氏菌属(Labrenzia)、海杆菌属(Marinobacter)、大洋柄菌属(Oceanicaulis)、生丝单胞菌科未分类菌属(UC Hyphomonadaceae)、红杆菌科未分类属(UC Rhodobacteraceae)和 nannocytastaceae 科未分类属(UC nannocytastaceae)广泛存在于本研究平台期样本以及过往研究的培养物中(Lawson et al, 2018;Camp et al, 2020; Maire et al, 2021), 表明它们可能是虫黄藻藻际细菌的核心类群。但着色杆菌科未分类属(UC Chromatiaceae)和Endozoicomonas这两个比较常见的属并未在我们的研究中发现(Neave et al,2017; Lawson et al, 2018)。拉布伦茨氏菌属(Labrenzia)在悬浮型藻的自由生细菌和贴壁型藻的沉底贴壁样本中聚集, 而先前的研究表明其倾向于依附藻生活(Maire et al, 2021), 其具有产生和分解DMSP 的能力(Curson et al, 2017), 并可能对虫黄藻受胁迫下产生的活性氧(Reactive Oxygen Species,ROS)具有清除作用(Sunda et al, 2002)。海杆菌属(Marinobacter)被发现可以产生一种低亲和力的双柠檬酸铁载体vibrioferrin(VF)以提高虫黄藻利用铁的能力(Amin et al, 2009)。大洋柄菌属(Oceanicaulis)在浮游细菌中比例较高, 其不仅参与合成维生素B,还能在寡营养的条件下有效地吸收磷元素(Guidi et al, 2018), 可能作为虫黄藻的营养储备长期存在于藻际环境中。红杆菌科是海洋环境最丰富的异养菌之一, 可占据海洋浮游细菌的20%, 对多种有机物进行降解, 在生物地球循环中起到重要作用(Wagner-Döbler et al, 2006; Sharpe et al, 2020)。鼠尾菌属(Muricauda, 6 株藻中4 株含有)能产生玉米黄素,一种具有清除活性氧(ROS)能力的类胡萝卜素, 已知可增加虫黄藻对光照和温度的耐受程度(Motone et al, 2020)。此外, 令人惊讶的是在Effrenium属的两株实验藻株的3μm 和0.2μm 样本中发现了可能存在于虫黄藻胞内的罗尔斯通菌属(Ralstonia)。我们对6 株藻0.2μm、3μm 和Settling 样本的核心细菌群落比较发现, 0.2μm 和3μm 样本的核心菌属结构相似,这与最近的一项研究结果基本一致(Maire et al,2021), 而与贴壁沉底样本有较大差异, 这可能是因为3μm 和0.2μm 样本细菌群落之间交互更密切。我们注意到3μm 样本的细菌群落拥有最多的ASV 种数, 它涵盖了绝大多数自由生和附着生细菌类群。在珊瑚礁中, 游离的虫黄藻会附着在珊瑚上参与钙化过程(Frommlet et al, 2015), 因为海水作用而脱离附着的虫黄藻可能会吸引一些其他的细菌, 最后再次附着在珊瑚上, 由此来增加珊瑚礁细菌群落的多样性。
4 结论
本文以中国南海三亚鹿回头海域分离的A—E型虫黄藻进行离体培养, 通过采集三种不同粒径样本对其平台期的细菌群落进行比较分析, 并找寻虫黄藻藻际细菌群落的核心类群, 获得如下结论:
1) 贴壁型藻(A—D 型)具有比悬浮型藻(E 型)更具多样性的细菌群落。两种生活类型的虫黄藻对细菌的选择具有显著差异, 如贴壁型藻的Myxococcota 门细菌远远大于悬浮型藻, 但α-变形菌相对丰度则小于悬浮型虫黄藻。
2) 悬浮型藻(E 型)的3μm 和0.2μm 样本中细菌优势菌群相似, 而贴壁型藻(A—D 型)的三种粒径样本(3μm、0.2μm 和Settling)则表现出整体显著差异。对于任意的一株藻, 不同样本的ASVs 高度共享,且不同样本细菌群落的差异主要是由于各组分细菌丰度差异导致, 而不同藻株藻际细菌群落差异则可以用细菌类群差异解释。
3) 本实验的 A—E 型虫黄藻的核心属为Henriciella、拉布伦茨氏菌属(Labrenzia)、海杆菌属(Marinobacter)、大洋柄菌属(Oceanicaulis)、UC Hyphomonadaceae 、 红杆菌科未分类属(UC Rhodobacteraceae)、UC Nannocystaceae, 自由生与颗粒附着生的核心细菌群落很相似, 但与沉底贴壁样 本有明显差异。
