嗜酸性粒细胞性肠炎伴复发性急性胰腺炎一例
2022-12-05王志伟杨爱明
邹 龙,王 强,吴 晰,王志伟,杨爱明
中国医学科学院北京协和医院 1病理科 2消化内科 3放射科,北京 100730
患者男性,46岁,因“间断腹痛2年”于2019年4月就诊于北京协和医院消化内科。
2017年5月,患者出现脐周烧灼样疼痛,下午及夜间发作,与进食、排便无关,持续8 h后减轻,伴夜间咳嗽、咳痰、呼吸困难。当地医院查血常规示白细胞6.41×109/L,中性粒细胞2.94×109/L,嗜酸性粒细胞1.06×109/L[正常范围:(0.02~0.5)×109/L],胶囊内镜可见小肠黏膜散在充血,诊断为“嗜酸性粒细胞性胃肠炎、哮喘”,予以抗过敏治疗后症状好转(未使用激素)。
2018年2月,患者无明显诱因出现上腹部剧烈胀痛,伴恶心、呕吐。外院查血常规示白细胞12.66×109/L,中性粒细胞11.59×109/L,嗜酸性粒细胞0.01×109/L;血淀粉酶 874 U/L(正常范围:25~115 U/L),脂肪酶 5804 U/L(正常范围:73~193 U/L);超敏C反应蛋白(hypersensitive C-reactive protein,hs-CRP) 284.82 mg/L;肝肾功能、电解质、血脂、肿瘤标志物、病毒抗体均无异常。腹部增强CT示胰腺肿大,部分坏死,伴周围多发积液,肝内、外胆管无扩张(图1A)。予禁食、补液、抑酸治疗。2018年4月,经空肠营养管行肠内营养期间,患者再次出现上腹部钝痛,复查血常规示白细胞 5.57×109/L,嗜酸性粒细胞 1.26×109/L;血涂片正常;血淀粉酶305 U/L,脂肪酶1807 U/L;hs-CRP 0.45 mg/L。腹部CT平扫示胰腺肿大、渗出及胰周积液较前改善。胃肠镜可见十二指肠降部及回肠末段黏膜散在充血,活检病理可见黏膜固有层较多嗜酸性粒细胞浸润,其中十二指肠>30个/高倍视野(high power field,HPF),回肠>56个/HPF。考虑为“嗜酸性粒细胞性肠炎可能性大,嗜酸性肉芽肿性多血管炎(eosinophilic granulomatosis with polyangiitis,EGPA)不除外”。予患者口服泼尼松40 mg,每天1次,腹痛明显改善,嗜酸性粒细胞计数恢复正常,随后泼尼松规律减量,2018年12月减停,期间患者病情稳定。
2019年3月,患者再次出现阵发性上腹胀痛。复查血常规:白细胞 9.42×109/L,嗜酸性粒细胞 0.14×109/L;血淀粉酶 777 U/L,脂肪酶 8547 U/L;hs-CRP 21.0 mg/L。腹部CT示胰腺周围包裹性积液范围较之前明显增大。
为行进一步诊治,患者于2019年4月2日收住北京协和医院消化内科病房。自2017年起病至今,患者病程中遇冷后偶发肢端红疹。既往史:2010年因鼻息肉、副鼻窦炎行手术治疗;2017年诊断为哮喘,应用非甾体抗炎药可诱发哮喘发作,诊断为阿司匹林加重性呼吸系统疾病(aspirin-exacerbated respiratory disease,AERD)。个人史:无吸烟、饮酒史。家族史无特殊。入院查体:生命体征平稳,心肺未见异常,腹部平软,剑突下轻度压痛,无反跳痛、肌紧张,未触及包块,肝脾肋下未及,墨菲征阴性,肠鸣音4次/min。神经系统查体无异常。
完善相关检查:白细胞 11.43×109/L,嗜酸性粒细胞计数正常;血淀粉酶 589 U/L,脂肪酶 1062 U/L;肝肾功能、血脂、电解质均无异常;红细胞沉降率 40 mm/h,hs-CRP 44.59 mg/L;总IgE 184.0 KU/L(正常范围:0~60 KU/L);补体、免疫球蛋白无异常;IgG4无异常;抗中性粒细胞胞浆抗体谱、抗核抗体谱、抗可溶性核抗原抗体谱、抗磷脂抗体谱均为阴性。粪便寄生虫、过敏原检测均为阴性。影像学检查:核磁共振胰胆管造影(magnetic resonance cholangiopancreatography,MRCP)示胰体假性囊肿,大小约6.8 cm×4.9 cm,其内可见分隔,病变似与主胰管相通,主胰管迂曲扩张(图1B)。胸部CT平扫示右肺尖多发肺大泡,左肺钙化灶,双侧腋窝及纵隔内多发小淋巴结。
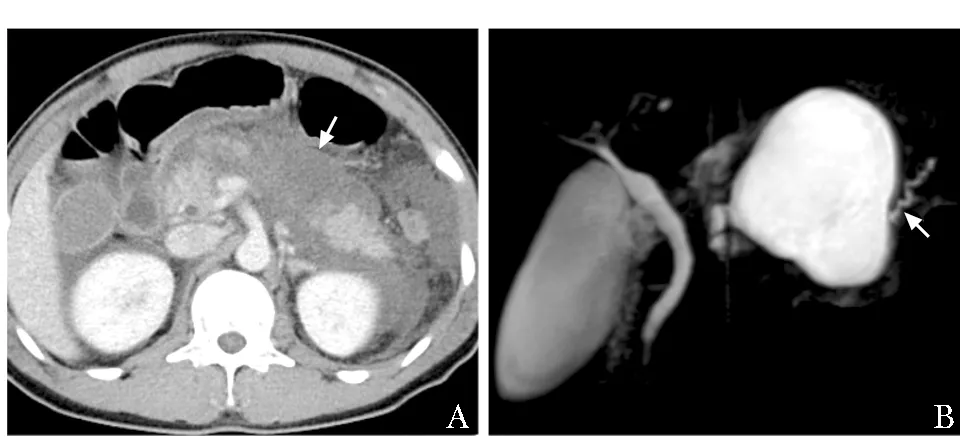
图1 患者胰腺影像学特征
患者中年男性,慢性病程。此次发病主要临床表现为腹痛,伴胰酶升高,影像学检查可见胰腺周围包裹性积液增多,为急性胰腺炎发作;患者既往有急性胰腺炎病史,与此次间隔时间超过3个月,考虑为复发性急性胰腺炎。鉴别诊断的重点在于复发性急性胰腺炎的病因。急性胰腺炎最常见的病因为胆源性、代谢性及酒精性,但患者无相关病史。患者病程中曾出现与胰腺炎发作不平行的腹痛,伴外周血嗜酸性粒细胞升高,肠道黏膜活检可见较多嗜酸性粒细胞浸润。既往已完善寄生虫感染、血液系统疾病、胃肠道炎症性疾病(如炎症性肠病)、系统性结缔组织病的筛查,均证据不足;患者虽有药物过敏史,但发病前无明确药物或其他过敏原接触史,故诊断为嗜酸性粒细胞性肠炎,其也可能因引起壶腹周围肠壁水肿或纤维化,致使胰液排出受阻,导致急性胰腺炎发作。此外,患者有AERD病史,结合病程中肠道受累及可疑皮疹,存在多系统受累表现,需考虑嗜酸性肉芽肿性多血管炎的可能性,而急性胰腺炎的发作也可能是小血管炎累及胰腺的表现,但目前尚缺乏血管炎或嗜酸性粒细胞浸润胰腺的组织学证据支持。患者此次急性胰腺炎再发,也可能非原发病所致,而与胰腺周围包裹性积液压迫有关,故入院后待患者胰腺炎病情稳定后,排除禁忌证,可考虑胰腺周围包裹性积液穿刺引流。
患者此次住院因急性胰腺炎再次发作,入院后遂予禁食、抑酸、肠外营养治疗,症状逐渐改善,血淀粉酶、脂肪酶逐渐下降,开始逐步过渡为肠内营养。2019年4月17日肠内营养期间,患者突发左上腹剧烈胀痛,查体可见左上腹新发包块,复查血淀粉酶、脂肪酶分别降至200 U/L、227 U/L,hs-CRP 25.18 mg/L。复查腹部CT示胰腺周围囊性积液范围较前增大,左侧可见一新发囊性改变(图2A)。超声内镜(endoscopic ultrasound,EUS)示胃底体旁巨大囊性病变,大小为6.7 cm×5.8 cm,内部回声均匀;其旁另见一长径约10 cm的低回声病变,囊壁显示不清,内可见分隔样改变,考虑液化不完全性渗出可能(图2B)。患者胰周再次出现大量渗出,需将液化完全的囊肿进行引流,缓解囊肿对胰管的压迫。但考虑到患者近期急性胰腺炎发作,且胰管近端狭窄明显,周围不除外纤维化,经胰管操作难度较高,并可能加重胰腺炎。故2019年4月19日全麻下行EUS,在充分评估穿刺路径并除外假性动脉瘤后,行经胃囊肿穿刺引流+双猪尾塑料支架置入术。术中抽取囊液呈淡黄色,送检结果显示:淀粉酶32 431 U/L,脂肪酶>150 000 U/L,癌胚抗原0.6 μg/L,糖类抗原19- 9 3507 KU/L。

图2 患者入院后腹部CT及超声内镜影像学特征
术后患者腹痛缓解,左上腹包块消失,逐渐过渡为经口半流质饮食。EUS引流术后1周,患者突发中上腹胀痛,伴呕鲜血,血红蛋白由129 g/L降至95 g/L,腹部CT示胃-囊肿引流管附近大量新发高密度影。考虑为囊内出血可能性大,遂急诊行上消化道动脉造影,可见肠系膜上动脉分支多发假性动脉瘤形成(图3A),予弹簧圈栓塞。患者血红蛋白稳定于100 g/L以上,胃液引流转清亮。
EUS引流术后17 d,患者再发腹痛,胃管内新见暗红色液体,血红蛋白由127 g/L降至90 g/L。再次急诊行上消化道动脉造影,胃网膜右动脉一分支可见假性动脉瘤及对比剂外溢,予微弹簧圈栓塞(图3B)。栓塞术后患者症状好转,次日胃液转清亮,血红蛋白、血淀粉酶及脂肪酶逐渐恢复正常,逐步过渡为经口进食后,于2019年5月14日出院。术后1年复查,患者病情稳定。
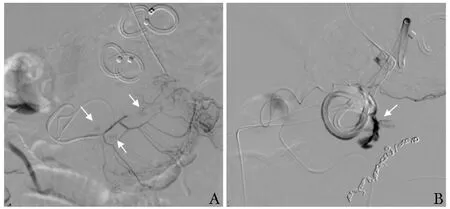
图3 患者上消化道动脉造影图像
患者病程后期胰腺炎反复发作可能与胰腺周围包裹性积液所致的主胰管引流不畅有关,故有穿刺引流指征。但考虑到患者近端主胰管明显狭窄,不除外因长期病变引起局部纤维化所致,经十二指肠乳头放置胰管支架困难,且有加重胰腺炎的风险,因此选择EUS引导下经胃囊肿穿刺引流。囊液检测结果符合假性囊肿囊液特征。穿刺引流术后,患者胰周积液完全吸收,胰腺炎未再发作,提示治疗有效。但患者引流术后的并发症值得讨论。研究表明,胰腺假性囊肿穿刺引流相关出血的发生率为0~17%,多发生于术中,术后相对少见[1]。引流术后出血的原因:(1)可能由于术前积液对血管的压迫,导致术前评估时未能清楚地识别病变血管,引流后胰酶和胃酸共同对囊内血管产生消化作用所致;(2)原积液远端引流后受到牵拉,致使假性动脉瘤形成并导致后续出血;(3)支架的留置对临近血管壁造成持续性刺激,形成假性动脉瘤并破裂出血。
本例患者初次动脉造影时,发现囊壁远端多发假性动脉瘤形成,可能为胰液引流后囊壁受牵拉和消化液共同作用所致;第二次动脉造影时,可见支架旁胃网膜右动脉破裂出血,不除外支架刺激所致。假性动脉瘤出血的早期识别和处理非常重要。当具有胰腺炎或胰腺假性囊肿病史的患者突发不明原因的贫血、假性囊肿增大、消化道出血时,需考虑假性动脉瘤出血的可能,经导管血管造影是假性动脉瘤诊疗的最佳方式。如果对假性动脉瘤出血患者仅进行基础生命支持,其死亡率大于90%;手术死亡率为20%~30%;动脉栓塞治疗的成功率最高,其死亡率约为16%,但也存在复发风险[2]。因此,对于此类患者,建议首选血管造影栓塞。
患者出院后长期口服酮替芬、孟鲁司特钠,规律随访,血常规嗜酸性粒细胞计数无异常。术后1年,复查腹部CT示支架已自行脱落,胰腺周围无明显渗出,胰体尾萎缩伴胰管扩张(图4);胃镜可见胃体后壁局灶性瘢痕,十二指肠黏膜未见异常,但活检仍可见较多嗜酸性粒细胞浸润,密集处约20个/HPF。随访2年,患者因鼻息肉复发再次行手术治疗,组织病理可见较多嗜酸性粒细胞浸润。

图4 患者术后1年腹部CT示胰体尾部萎缩伴胰管扩张,胰周未见渗出、积液或囊性病变(箭头)
本例患者临床突出表现为复发性急性胰腺炎,及与之发作不平行的嗜酸性粒细胞性肠炎,合并阿司匹林加重性呼吸系统疾病。该病例主要存在两个重要临床问题,一是复发性急性胰腺炎的病因诊断,二是胰腺局部并发症的处理。目前,已有关于嗜酸性粒细胞性肠炎合并急性胰腺炎的病例报道,认为嗜酸性粒细胞浸润可能导致壶腹及其周围十二指肠水肿、纤维化,甚至变形,从而导致急性胰腺炎发生[3- 4]。而本例患者的特殊之处在于合并AERD,又被称为阿司匹林耐受不良三联征:若患者同时具备支气管哮喘、慢性鼻炎-鼻窦炎伴鼻息肉病、环氧合酶- 1抑制性非甾体抗炎药摄入后出现急性呼吸道反应3个特征,即可明确临床诊断[5]。亦有研究报道,73%的嗜酸性粒细胞性肠炎患者至少存在一种特应性状态,如过敏性鼻窦炎、支气管哮喘、特应性皮炎、食物过敏等病史[6]。然而,此两种疾病同时出现可否视为偶然仍有待讨论。本例患者有上呼吸道、下呼吸道、胃肠道及可疑的皮肤等多系统受累证据,此时需考虑系统性疾病的可能。
EGPA是一种主要累及肺、鼻窦、心脏、神经、皮肤的多系统疾病,约37%~62%的患者可累及胃肠道[7]。EGPA的临床过程包括前驱期、嗜酸性粒细胞期和血管炎期,前驱期主要表现为支气管哮喘和鼻窦炎,嗜酸性粒细胞期可能出现嗜酸性粒细胞的广泛浸润,但尚无血管炎表现[8]。从前驱期症状出现至进入血管炎期出现多系统受累表现,平均潜伏期为3~4年[9]。在嗜酸性粒细胞期,患者若存在消化道受累,而内镜活检难以取得血管炎表现的组织标本,可能误诊为嗜酸性粒细胞性肠炎[10]。此外,亦有研究报道首诊为AERD的EGPA病例[11],但EGPA导致胰腺炎的报道非常罕见[12]。文献报道1例EGPA患者突发胰尾囊性病变,采用手术治疗,病理提示囊肿周围脂肪组织内小血管内弹力层破坏,伴嗜酸性粒细胞浸润增多,符合血管炎表现[13]。虽然根据本例患者的临床表现,考虑为EGPA,但组织学证据仍是EGPA确诊的重要依据,而本病例尚未获得[14];囊液的嗜酸性粒细胞计数可能对诊断有一定帮助。鉴于目前患者病情尚处于稳定阶段,不除外疾病正处于发展进程中,后续仍需密切随诊观察病情变化,若疾病进展,出现其他典型EGPA系统性受累表现,或获得嗜酸性粒细胞性血管炎相关证据,则更支持EGPA诊断,后续应加强治疗。
本例患者确诊为嗜酸性粒细胞性肠炎伴复发性急性胰腺炎,合并阿司匹林加重性呼吸系统疾病。因患者存在多系统受累临床表现及嗜酸性粒细胞浸润的组织学表现,故疑诊为EGPA,但确诊的证据尚不充分。虽经糖皮质激素治疗和胰腺局部并发症处理后病情好转,但原发病仍需密切随访,警惕疾病复发或进展。若出现典型的肺部浸润、神经病变或肾脏受累,或有嗜酸性粒细胞性肉芽肿性血管炎相关的组织学证据,将更支持EGPA诊断。胰腺假性囊肿相关的假性动脉瘤出血是较为少见且死亡率较高的并发症,在临床实践过程中需注意识别并积极处理。当有胰腺炎或胰腺假性囊肿病史的患者突发不明原因的贫血、假性囊肿增大、消化道出血时,需考虑假性动脉瘤出血的可能。经导管血管造影是假性动脉瘤诊断和治疗的最佳方式,临床工作中若怀疑假性动脉瘤出血,应尽早行经导管血管造影。
作者贡献:邹龙、王强负责收集临床资料,撰写和修改论文;吴晰、王志伟负责协助完成手术,采集并分析相关数据;杨爱明负责临床资料及数据审核。
利益冲突:所有作者均声明不存在利益冲突
