器官血流动力学新认知:动脉-灌注-静脉
2022-12-05王小亭刘大为
赵 华,王小亭,刘大为
中国医学科学院北京协和医院重症医学科,北京100730
重症患者器官功能损伤有着明显的特征性,器官化治疗已不仅仅是单纯的器官功能支持或替代治疗,临床治疗原则也从强迫受损器官做更多的工作向减少器官损伤、让器官休息的“器官保护性”治疗方向转变[1]。如何进行器官保护性治疗,并把各个散在的器官联系起来成为临床亟待解决的问题。
血流将所有器官按功能联系在一起,是保证各个器官功能正常的基础,重症患者器官血流动力学改变是导致器官功能受损的核心。通常决定器官血流的主要因素包括:(1)全身血流情况即心输出量;(2)器官灌注压,其是平均动脉压(mean arterial pressure,MAP)与器官间质压的差值,是保证器官血流的直接动力,受入器官压力(动脉端的压力)和出器官压力(静脉端压力)的影响;(3)器官血管阻力,当全身流量和压力恒定时,血管阻力决定了器官灌注,其主要受器官自主神经功能的影响并通过神经内分泌因子调节血流和代谢。不同器官对血流的调整具有独特的灌注压力需求和调节系统,以匹配自身生理需求[2]。动脉端作为器官灌注的供给侧,主要通过灌注压力和调节系统以保证器官的血流。但器官血流灌注不仅取决于供给侧,还受静脉回流的影响,重要器官的动静脉梯度改变可影响器官血流灌注。同时,不同的器官内血流分布不尽相同,为了解器官整体血流动力学和代偿机制,应对器官的动脉和静脉进行联合评估。
1 器官血流动力学—动脉
入器官压力是保证器官灌注的直接动力,由动脉系统MAP决定。MAP是器官灌注的基础,但又不完全决定器官灌注,血压的剧烈波动可能导致器官血流恶化。研究表明,心脏手术期间血压不稳定性与患者术后30 d死亡率相关[3]。血压波动性升高,是预测重大非心脏手术后谵妄的指标[4]。而一项在非心脏外科手术中进行的研究显示,患者术中血压不稳定性与较高的30 d死亡率呈弱相关[5]。寻找能够保证足够器官血流的MAP一直是临床治疗的核心之一,压力自动调节(pressure autoregulation,PA)功能是器官在灌注压力发生变化时维持血流稳定的基础。PA存在于大多数器官中,包括大脑、脊髓、心脏、肾脏、骨骼肌和内脏器官等[6- 12]。然而,不同器官具有不同的自动调节能力(即异质性),特定器官的PA受年龄、性别、慢性疾病、代谢状态、心输出量、麻醉等多种因素的影响。根据自主调节功能的不同,可将器官分为如下三类:(1)自主调节能力强的器官,包括大脑、脊髓、心脏和肾脏,该类器官的自主调节具有清晰的压力下线和上限,平台期较宽且稳定;(2)自主调节能力中等的器官,主要为骨骼肌,具有可识别的压力下限和上限,但平台坡度相对陡峭;(3)自主调节能力弱的器官,主要包括胃、小肠、结肠、肝脏和胰腺等内脏器管,压力下限和上限很难识别,平台坡度非常陡峭。不同器官间PA能力的异质性意味着对于相同的血压变化,不同器官中的血流改变是不同的。重症患者PA功能不同程度受损,当灌注压力出现波动时,自主调节能力较弱的患者更易出现灌注不足表现。
1.1 自主调节功能较强的器官
大脑、脊髓、心脏和肾脏等再生或自我修复能力较差的器官具备了比其他器官更强的PA能力。研究表明,患者预后不良与目标血压低于脑血流自主调节压力下限(lower limit of autoregulation,LLA)相关[13],并提出将脑血流LLA值作为重症患者的目标血压。但大脑自主调节能力高于其他器官,当血压低于脑血流LLA值、脑灌注出现不足时,其他器官已经经历了灌注减少。因此,以脑自主调节功能来确定目标血压可能导致患者其他器官灌注不足[14]。与心脏、大脑和脊髓相比,肾脏血流自主调节能力较弱,满足肾血流LLA的目标血压对于其他器官(无局部血管疾病)基本足够,其是否可作为重症患者的目标血压,仍需进一步临床研究加以验证。2021年脓毒症与感染性休克治疗国际指南推荐意见中,对于脓毒症患者初始MAP的目标仍确定为65 mm Hg(1 mm Hg=0.133 kPa),着重指出了目标血压的确定主要基于大脑的自我调节功能,这是临床工作中确定血压目标的理论基础[15]。重症状态下,器官的自我调节功能受损,正常生理状态下的动脉压力可能无法维持患者合适的器官血流量,尤其是重要器官如心、脑和肾脏的血流。此时个体化的MAP应根据重要器官的自我调节功能来确定,而目前监测部分器官血流及器官自我调节功能已是明确的临床可操作行为。
1.1.1 脑血流动脉灌注
作为器官血流监测的典范,脑血流监测可通过血流形态、血流速度、搏动指数(pulse index,PI)、血流量的自主调节系统化地评价脑血流状态,并针对相应位点进行血流动力学调整。1928年,福布斯和沃尔夫记录了大脑自动调节反应报告,随后Lassen根据11组受试者的数据发布了第一张脑血流图。Aaslid等[16]首次采用经颅多普勒超声报告了动态脑自动调节过程。脑血流及其自主调节功能受年龄、性别、基础疾病状态、代谢情况、动脉血二氧化碳水平等多种因素影响,需动态监测其变化以指导临床干预。目前经颅多普勒超声技术已是床旁评价脑血流动脉灌注的核心技术,可根据其形态、流速、阻力指数等参数评价脑血流动脉端灌注状态。瞬间充血反应试验可用于评价脑血流的自主调节功能, 通过压颈试验造成大脑中动脉血流速度稳定下降至基线的30%~50%并维持3 s,解除压迫后观察血流速度与基线血流速度的比值。当该比值>1.09时,认为具有动态脑血管自动调节功能;反之,则认为动态脑血管自动调节功能受损。
重症早期,脑灌注可能存在自主调节平台期异常或斜率增加,如平台期缩短、下限上移、上限下移、灌注波动改变等,因此应根据病理生理变化进行个体化、器官化自主调节功能下限的滴定治疗,同时避免超过上限或出现斜率明显增加。对大脑而言,最佳的器官血流状态应将血流量维持在自主调节功能范围上下限之间,并尽可能扩展其自主调节平台期范围;最佳的血流状态是维持血流稳定,血流量不随压力变化而产生较大波动。Depreitere 等[17]提出了自主调节功能维持稳态的重要性,维持在自主调节功能平台期下限有利于制订目标脑灌注压力,而上限通常仅在某些特定场景下应用,不建议用于诊疗常规。脑血流频谱形态、流速、阻力指数和是否具备自主调节功能是临床确定MAP的有效依据,而对于脑损伤患者来说,其颅内压升高,自主调节能力下降,若仍确定MAP目标值为65 mm Hg可能会导致患者大脑低灌注,此时应根据动脉端血流供给状态调整MAP的目标值。
1.1.2 肾血流的动脉灌注
肾循环中,肾小球毛细血管网的两端为小动脉,与其他器官相比需要更高的前向灌注压力以驱动血流,因此肾脏血流更易受MAP波动的影响。肾脏自主调节功能易受损,高血压和糖尿病可加速损害肾脏自身调节能力,使血流自动调节曲线右移,LLA增加。SEPSISPAM研究表明,在患有高血压的感染性休克患者中,与MAP目标值65~70 mm Hg相比,MAP目标值80~85 mm Hg可降低血清肌酐水平并减少肾脏替代治疗[18]。
肾脏血流评估研究已相对成熟,主要集中于非侵入性方法,如超声、超声造影、对比增强磁共振成像、同位素肾造影和对比CT灌注成像等,但除超声外,其余均不适合进行床旁实时评估和监测,因此在危重患者中的应用受限[19]。Beloncle等[20]发现在高血压或糖尿病的感染性休克患者中,肾动脉阻力指数(renal resistive index,RRI)与MAP成反比,MAP和RRI之间存在相关性。Rhee等[21]在出血性休克的仔猪模型中,利用激光多普勒或近红外光谱法测得肾脏血流量,通过缓慢改变肾脏灌注压力,评价其与肾血流之间的关系来判断肾脏的自动调节功能。超声造影技术可实时床旁评价肾脏血流灌注量,是未来研究的方向。目前临床尚无判断肾血流自主调节功能的标准方法,需要进一步研究以明确肾脏血流LLA,从而滴定灌注压力、调整不同的缩血管药物等改善肾脏灌注[22]。
1.2 自主调节功能中等/较弱的器官
自主调节功能中等和较弱的器官对于灌注压力的耐受性较差,当循环出现波动时,灌注压力一旦低于LLA,器官血流会明显下降,休克早期即易受累。
1.2.1 骨骼肌
1902年,Bayliss首先进行了骨骼肌血流测量。1961年,Stainsby和Renkin首次描述了骨骼肌的自主调节功能。总体证据表明,骨骼肌具有中度PA能力,且自主调节有明确的上、下限,但其平台坡度比大脑、心脏或肾脏陡峭得多。骨骼肌血流受局部代谢需求影响较大,对于压力变化的自主调节范围目前研究仍较少。
1.2.2 内脏器官
100多年前,贝利斯等进行了内脏器官压力自主调节的研究,发现胃、小肠、结肠、肝脏和胰腺等内脏器官具有较弱的血流自主调节能力,但其上、下限难以辨认,平台坡度非常陡峭,压力-流量之间的关系在不同研究中有所不同。多种因素可影响内脏器官的血流自我调节,包括心输出量、交感神经和副交感神经调节、进食后食物刺激等。研究发现,对于感染性休克患者,低MAP目标值(65~70 mm Hg)与高MAP目标值(80~85 mm Hg)两组间肠系膜缺血发生率并无显著差异[18],且MAP从60 mm Hg增至90 mm Hg不影响肠黏膜灌注和内脏氧的需求/供应关系[23]。这一间接证据表明,60 mm Hg足以维持局部血流,即使高于此阈值,血流也不增加。肠系膜上动脉血流或内脏血流的改变与心输出量的变化相关性更明显,研究表明,肠系膜上动脉血流量与心输出量呈线性相关[24- 25]。
目前内脏器官动脉血流评估并不完善,临床主要通过超声针对腹腔干、肠系膜上动脉进行血流评价,可监测血流速度、流量、阻力指数等评估内脏血流改变情况,但重症疾病相关的应用仍需进一步明确。
2 器官血流动力学—静脉
从生理学的角度看,器官灌注取决于供应器官动、静脉之间的压力梯度。重症患者器官动、静脉压力梯度若减小,可能妨碍重要器官的充分灌注;静脉压力增加可能导致毛细血管静水压力升高而出现间质水肿、内皮屏障受损、器官间质压力迅速增高进而降低器官血流量。此外,间质水肿增加了氧扩散距离,不利于组织氧合。同时,不同器官对静脉端压力升高的耐受性不尽相同,例如,因大脑存在静脉窦,其静脉回流主要受颅内压影响较大;肾脏的肾髓质血流灌注受静脉端压力影响较大;自主调节功能较差的器官如内脏器官,受静脉端压力影响较大,临床较易出现淤血。在体实验发现,急性静脉高压会导致胃、小肠和结肠等器官血流减少[26]。临床工作中,如何确定不同器官的出器官静脉端压力增高一直是极具挑战性的问题。
2.1 器官静脉回流—中心静脉压
中心静脉压(central venous pressure,CVP)反映上腔静脉或右心房的局部压力,是静脉回流的终点,亦被认为是近似出器官压力。高CVP与急性肾功能不全、急性肝功能不全、急性胃肠道功能不全相关。研究表明,心外科术后右心功能不全的患者,肾功能受损先于心输出量降低出现[27]。刘大为等[28]提出的“CVP越低越好”的理论,已被越来越多的临床研究结果证实。CVP作为重症患者预后的危险因素也受到了广泛关注。过高的CVP不仅提示右心功能不全,也提示器官血流可能存在持续损害,在临床中应重视优化CVP对器官功能的保护作用。有学者建议,将CVP≥8 mm Hg定义为静脉回流受阻。在重症患者中,当CVP高于7 mm Hg时,每增加1 mm Hg,急性肾损伤的风险均进行性增加。但也有学者认为,不同的病理生理状态下,CVP阈值是不确定的,可联合其他静脉回流受阻指标,如肝脏、门静脉和肾静脉多普勒频谱联合评价。
2.2 器官静脉回流—静脉回流频谱
准确量化器官静脉回流受阻较困难,随着床旁重症超声的发展,临床医生能够可视化血管解剖结构并利用多普勒成像评估血流速度。当右心衰竭和/或液体超负荷导致右心房压力升高时,心动周期中右心房的压力变化向终末器官静脉系统传递。这种压力传输会改变静脉血流模式,并可通过静脉多普勒进行量化评估[29]。因各脏器距离心脏远近不同,静脉波形的表现及临床意义各不相同,通过观察肝静脉、门静脉、肾静脉的多普勒波形,临床医师能够观察到高右心房压力是否会转化为临床上显著的静脉充血。
2.2.1 静脉回流频谱—肝静脉
肝静脉靠近心脏,是器官静脉中最容易出现淤血的血管。因无静脉瓣,故肝静脉血流可反映整个心动周期的右心房的压力变化[30]。肝静脉中的正常血流呈阶段性和双向性顺行特征,且流动方向和速度的波动可反映右心房压力变化。正常肝静脉多普勒波形是由逆行A波(心房收缩)、顺行S波(心室收缩)、移行V波(心房过度充盈过渡波)和顺行D波(心室舒张)4个分量组成的三相波(图1)。

图1 肝静脉三相波
肝静脉波形受右心室收缩功能障碍、右心室舒张功能障碍、前负荷降低、三尖瓣反流和肺动脉高压等多种因素影响。肝静脉流出受损引起的肝静脉充血可导致充血性肝病,被动充血导致肝窦高压,直接影响肝脏生化、组织学以及全身葡萄糖、脂质代谢,并持续损伤肝功能[31]。有研究测量了患者术前、重症监护期间和出院后S波和D波的最大速度,发现其与心脏术后并发急性肾损伤密切相关[32],这些参数可反映围术期静脉充盈情况,并指导液体管理。
2.2.2 静脉回流频谱—门静脉
门静脉收集来自腹腔脏器的血液,其不具有自动调节流量的能力,血流依赖于门静脉和肝静脉之间的压力梯度。当右心房压力或CVP增高时,可向下传递导致肝静脉压力增高,进而引起肝窦后门脉系统流速降低,严重时导致门脉血流完全缺失或逆转。门静脉的正常波形为基线以上的连续性单相血流,变化通常较小(图2A)。心房收缩产生的肝静脉逆行血流压力变化通过肝窦传输至门静脉,使门静脉血流产生轻微波动(图2B)。随着右心房压力的增加,心动周期中的压力变化被传递至门静脉循环,导致“脉动”波形(图2C)。当右心房压力进一步增加或三尖瓣存在严重反流时,门静脉血流表现为收缩期血流逆转,基线上下来回脉动,使波形呈现“来回”模式(图2D)。

图2 门静脉多普勒血流图
门静脉血流可反映腹腔脏器尤其是胃肠道静脉压力,是临床评价胃肠道回流的有效指标。在胃肠道方面,增加的静脉压使肠微绒毛相对缺血,绒毛尖端的肠细胞易发生缺血性损伤、酸中毒,影响钠和磷酸盐转运代谢,肠道内的相对缺血还会导致肠道屏障功能降低,改变肠腔细菌微生物组的环境,使潜在病原微生物和细菌内毒素易位进入血液。门静脉血流搏动是心源性门静脉高压的超声标志物,可识别临床上显著的胃肠道充血,且与右心房压力升高、低全身灌注的血流动力学指标及心功能恶化相关[33]。Styczynski 等[34]的研究表明,50% 或更高的门静脉搏动分数是心力衰竭患者血清胆红素升高相关的最佳预测因素,证明静脉充血可导致肝功能受损。因此,门静脉多普勒频谱的改变被认为是心肠相互作用的潜在信号[35]。需注意的是,若以门静脉血流代表静脉充血程度,需除外引起门静脉高压的其他原因,如肝硬化和门静脉血栓形成等。
2.2.3 静脉回流频谱—肾静脉
由于结构特殊,肾脏相比其他器官其血流需要更高的前向灌注压力驱动,同时,由于肾脏毛细血管内皮的特殊性,静脉端压力的升高较易出现间质水肿,因此肾脏血流灌注对出器官的静脉端压力要求也较高。肾静脉距离右心最远,但由于右心房压力升高传递至肾静脉,可导致肾静脉血流的进行性改变。肾静脉多普勒信号通常是基线以下连续的单相血流,在心动周期中有一个小的变化幅度(图3A)。随着静脉充血的增加,收缩期血流逐渐减少,静脉血流波形变为搏动,类似于肝静脉血流的 S 波和 D 波不连续的双相血流(图3B)。随着静脉充血恶化,S 波变小,D 波更明显。最终 S 波完全逆转,与动脉波合并,只留下单相 D 波在基线以下(图3C)。
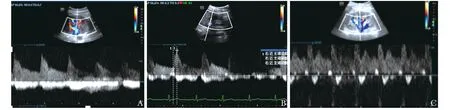
图3 肾静脉多普勒血流图
对于肾脏而言,肾静脉回流障碍会导致肾功能不全、腹内压升高、神经激素激活、肾小管对钠重吸收过多、液体超负荷和利尿剂抵抗的恶性循环,以及进一步的右心室压力升高。右心房压力升高传递至肾静脉,导致被包裹的肾脏内间质和肾小管静水压力增加,肾脏器官灌注压进一步减低,从而导致危重患者发生急性肾损伤。在静脉充血增加的情况下,异常或不连续的肾静脉血流模式与肾脏内的间质压力增加有关。Husain-Syed等[36]提出的肾静脉淤滞指数,可更好地反映肾充血的完整性和连续性,能够协助判断患者是否有发展为右心衰竭的倾向。充血性心力衰竭患者的液体负荷会导致肾静脉血流出现不连续模式并降低利尿剂反应[37],在因急性心力衰竭住院的肾静脉血流模式不连续的患者中,减充血治疗可使肾静脉血流正常化为连续模式[38],这促使肾静脉多普勒超声成为液体管理的监测手段。
2.2.4 静脉回流频谱—联合应用
2020年,Beaubien-Souligny 等[39]结合下腔静脉直径和门静脉、肝静脉及小叶间肾静脉的多普勒波形建立了静脉充盈超声分级评分系统(venous excess ultrasound grading system,VExUS),将定性评估与静脉充血严重程度分级相结合以量化全身充血。沿着右心室压力传递的顺序,通过对静脉系统的多普勒超声评估使临床医生能够评估升高的右心房压力对周围器官的下游影响,从而反映右心功能,评估右心室功能障碍。另外,VExUS通过评估具有临床意义的器官充血,为静脉回流状态评估提供了客观标记,可被用于指导心肾综合征的靶向液体清除以及心力衰竭的减充血治疗,可能为液体复苏提供停止点,是实现精确液体管理的关键[40]。Beaubien-Souligny等[41]发现,心脏手术患者术后VExUS 评分升高与急性肾损伤进展之间存在显著关联。Bhardwaj等[42]研究结果支持了VExUS评分与急性肾损伤分期相关,并发现VExUS分级的动态趋势与临床状况的改善关系,从而潜在地降低了患者术后急性肾损伤风险。
3 小结
器官的血流动力学治疗是重症患者实现器官化治疗的临床可操作行为。不同器官在不同的疾病、损伤打击下,血流动力学改变并不完全相同。充分理解不同类型器官对于入器官(动脉)和出器官(静脉)压力的需求及其血流动力学影响,是进行器官血流动力学治疗的关键。自主调节能力不同的器官对于动脉端的压力并不完全相同,临床应根据相应的自主调节范围寻找合适的动脉端灌注压。由于距离心脏的远近和器官本身的特性不同,不同器官对于静脉回流障碍的耐受程度也不完全一致。临床应开展进一步深入研究,通过对不同部位的静脉状态予以评价,以证实通过血流动力学干预调整器官不同压力能否改善器官功能,进而真正实现重症治疗的器官化。
作者贡献:赵华负责文献收集、分析和论文撰写;王小亭负责论文段落构架、文献分析和论文修订;刘大为负责选题设计,论文修订和终审定稿。
利益冲突:所有作者均声明不存在利益冲突
