不同干燥方式黄芪提取物理化性质及HPLC-ELSD指纹图谱的比较
2022-12-05李明月常丽静韦花花
李明月, 常丽静, 韦花花, 陈 新
(长春中医药大学长白山道地药材药效物质重点研究室,吉林 长春 130117)
黄芪为豆科植物蒙古黄芪Astragalusmembranaceus(Fisch.)Bge.var.mongholicus(Bge.)Hsiao或膜荚黄芪Astragalusmembranaceus(Fisch.)Bge.的干燥根,其化学成分包括黄酮类、皂苷类和多糖类化合物等。现代药理学研究表明黄芪中皂苷类及黄酮类成分是其主要药效成分,具有改善心脑血管、调节肾功能、抗氧化、神经保护等多种药理作用[1-3],本实验根据皂苷、黄酮类成分的溶解性,利用水提醇沉法制备黄芪提取液,经浓缩、干燥制备黄芪固体提取物。
中药固体原料药是中药制剂中间体常见形式,干燥是中间体粉末制备的必要步骤之一。因加热方式、干燥条件的差异,不同干燥方式可能会对目标样品的成分特性及理化性质造成影响,进而影响制剂过程及制剂工艺,而中药原料药粉末的理化性质可从溶解性、吸湿性、平衡溶解度、稳定性等方面进行表征[4-5],反应其制剂成型性以及成药性性能。本研究拟从样品粉末理化性质、HPLC-ELSD指纹图谱研究常压干燥、减压干燥、冷冻干燥三种常用干燥方式[6]对黄芪提取物的影响,以期为黄芪中药制剂的辅料选择、制剂优化、以及黄芪二次开发[7-8]等提供参考依据。
1 材料
1.1 仪器 LXJ-IIB低速大容量多管离心机(上海安亭科学仪器厂);Agilent 1260 ELSD高效液相色谱仪(美国Agilent公司);Epsilon 2-4 LSCplus 真空冷冻干燥机(德国Martin Christ公司);DDSJ-308A电导率仪(上海雷磁仪器厂);实验室PH计[梅特勒-托利多仪器(上海)有限公司];DZF-6050型真空干燥箱(上海一恒科学仪器有限公司);GZX-9240 MBE数显鼓风干燥箱(上海博讯实业有限公司医疗设备厂);TS-100B恒温摇床[匡贝实业(上海)有限公司];全自动中药煎药机(青岛达尔电子机械销售有限公司);NDJ-1型旋转式粘度计(上海力辰邦西仪器科技有限公司)。
1.2 药品与试剂 黄芪甲苷、黄芪皂苷Ⅰ、黄芪皂苷Ⅱ、黄芪皂苷Ⅲ、毛蕊异黄酮葡萄糖苷、毛蕊异黄酮、芒柄花黄素、次芒柄花苷对照品(上海弘扬科技信息有限公司,批号分别为190110-015、190216-016、190216-017、181118-018、181217-013、181108-012、180303-011、190114-044,纯度均≥98%)。氯化钠(国药集团化学试剂有限公司,批号20201017);磷酸二氢钠(北京北化精细化学品有限责任公司,批号20190218);磷酸氢二钠(上海麦克林生化科技有限公司,批号S818100);磷酸二氢钾(广东光华科技股份有限公司,批号20201020);磷酸氢二钾(北京北化精细化学品有限责任公司,批号20170311);硝酸钾(上海西陇化工股份有限公司,批号20180717)。黄芪(河北仁心药业有限公司,产地内蒙,批号201803-01、201803-02、201803-03、201810-01、201810-02、201811-01、201811-02、201911-01、201911-02、201911-03),经长春中医药大学肖井雷教授鉴定为豆科植物蒙古黄芪Astragalusmembranaceus(Fisch.)Bge.var.mongholicus(Bge.)Hsiao。
2 方法与结果
2.1 水煎液制备 取药材1 kg,加10倍量水浸泡5 h后煎煮3 h,滤过,残渣加8倍量水煎煮2 h,滤过,合并滤液,即得水煎液,浓缩至1.2 L,同法制备10批(编号H1~H10),测定浓缩前后体积、TDS、电导率、盐度、pH值、电位,结果见表1。
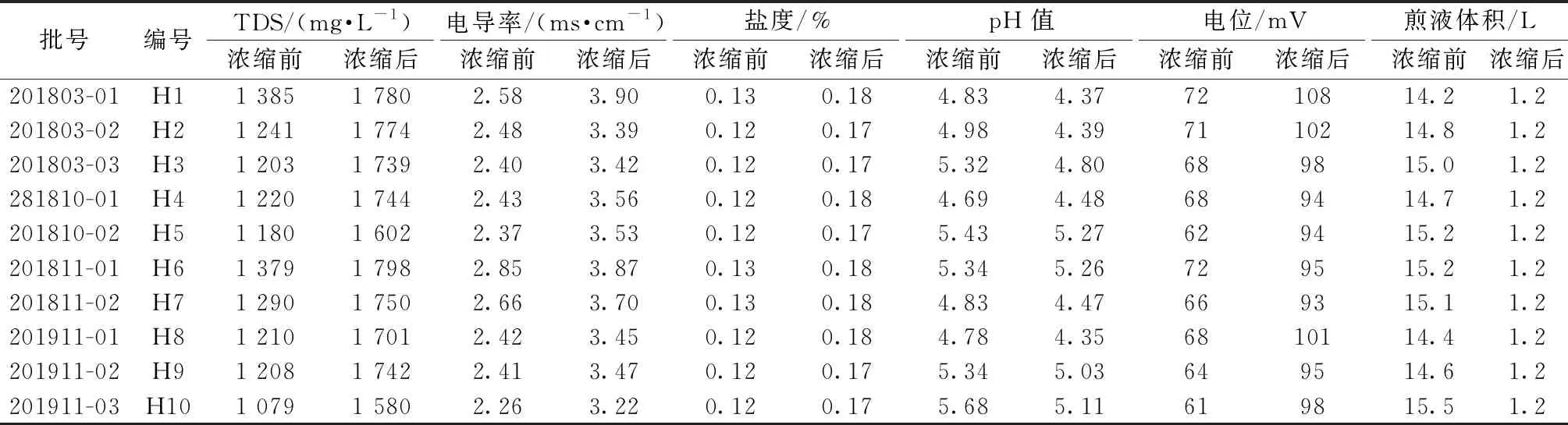
表1 水煎液物理指标测定结果
2.2 提取物制备 取“2.1”项下水煎液(H1~H10),加入3.36 L乙醇至醇体积分数为70%,静置24 h后3 000 r/min离心,取上清液,加70%乙醇定容至5.0 L,分成3份,回收乙醇并浓缩至相对密度为1.20~1.30(25 ℃)的浸膏,其黏度[9]见表2。再分别进行常压干燥(温度80 ℃,干燥时间72 h)、减压干燥(温度80 ℃,压力-80 kPa,干燥时间48 h)、冷冻干燥(温度-80 ℃,压力0.013 3 kPa,干燥时间35 h,预冻时间12 h),分别编号S1~S10、S11~S20、S21~S30,干膏得率分别为22.53%~30.64%、21.35%~33.93%、19.88%~31.82%,平均含水量分别为3.82%、3.36%、3.16%,将其进行粉碎(3次,每次3 min)后过6号筛,即得,密封保存备用。
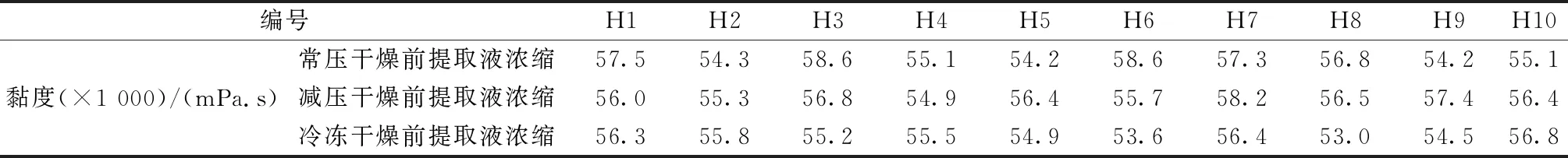
表2 提取物黏度测定结果
2.3 黄芪甲苷含量测定
2.3.1 色谱条件 Agilent ZORBAX Eclipse Plus C18色谱柱(4.6 mm×250 mm,5 μm);流动相乙腈-水(32∶68);体积流量1.0 mL/min;柱温25 ℃;进样量2、10 μL(对照品)及10 μL(供试品);蒸发器温度50 ℃;雾化器温度50 ℃;载气体积流量1 400 mL/min。
2.3.2 对照品溶液制备 精密称取黄芪甲苷对照品适量,甲醇溶解,制成质量浓度为0.484 8 mg/mL溶液,即得色谱图见图1。
2.3.3 供试品溶液制备 精密称取提取物粉末2.0 g,精密加入50 mL甲醇,超声(400 W、40 kHz)处理20 min,过滤,10 mL甲醇冲洗滤渣,蒸干,加10 mL水溶解,水饱和的正丁醇萃取4次,每次50 mL,合并正丁醇液,蒸干,残渣加适量甲醇溶解,转移至10 mL量瓶中,加甲醇至刻度,摇匀,0.45 μm微孔滤膜过滤,即得,色谱图见图2。
2.3.4 线性关系考察 取对照品适量,甲醇逐级稀释至0.484 8、0.387 9、0.242 4、0.193 9、0.121 2、0.096 9 mg/mL,分别吸取10 μL,在“2.3.1”项色谱条件下进样测定。以黄芪甲苷峰面积对数为纵坐标(Y),进样量对数为横坐标(X)进行回归,得方程为Y=1.698 8X+6.927 5(r=0.999 8),在0.97~4.85 μg范围内线性关系良好。
2.3.5 精密度试验 取提取物(S11)粉末适量,按“2.3.3”项下方法制备供试品溶液,在“2.3.1”项色谱条件下进样测定6次,测得黄芪甲苷峰面积RSD为0.46%,表明仪器精密度良好。
2.3.6 重复性试验 取提取物(S11)粉末适量,按“2.3.3”项下方法制备供试品溶液6份,在“2.3.1”项色谱条件下进样测定,测得黄芪甲苷含量RSD为0.64%,表明该方法重复性良好。
2.3.7 稳定性试验 取提取物(S11)粉末适量,按“2.3.3”项下方法制备供试品溶液,于0、3、6、9、12、24 h在“2.3.1”项色谱条件下各进样10 μL测定,测得黄芪甲苷峰面积RSD为0.40%。表明溶液在24 h内稳定性良好。
2.3.8 加样回收率试验 精密称取黄芪甲苷含量已知的提取物(S11)粉末6份,按“2.3.3”项下方法制备供试品溶液,精密加入含黄芪甲苷0.484 8 mg/mL的对照品溶液1 mL,在“2.3.1”项色谱条件下进样测定,计算回收率。结果,黄芪甲苷加样回收率为96.81%,RSD为0.94%。
2.3.9 黄芪甲苷含量测定 结果见表3。
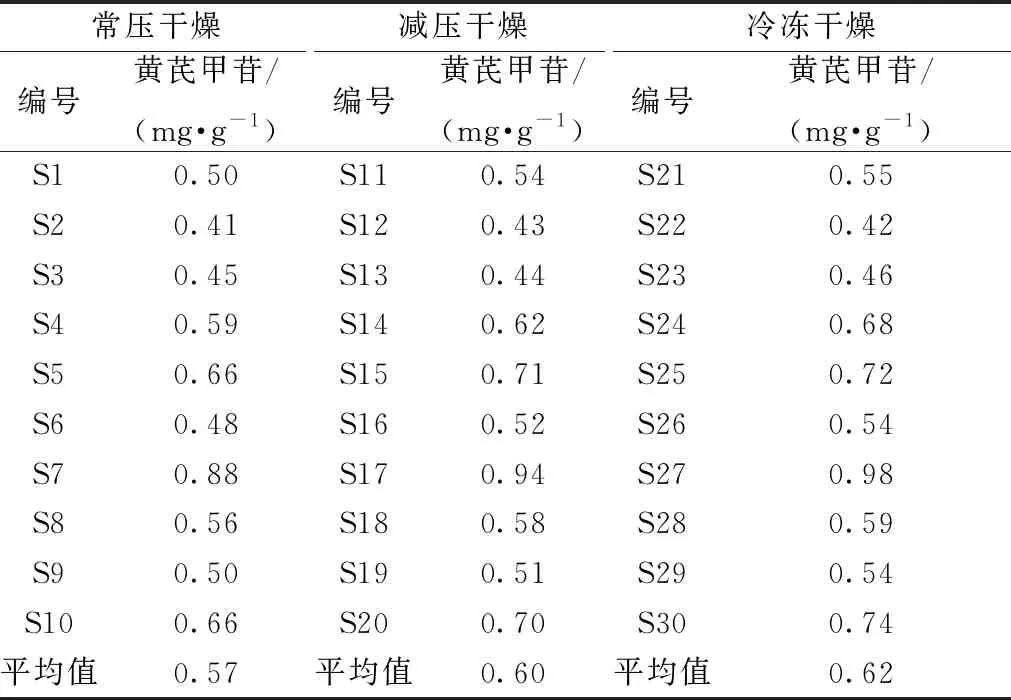
表3 黄芪甲苷含量测定结果
2.4 理化性质测定
2.4.1 溶解性 取10批提取物,每批3.0 g,平行3份,精密称取质量(M0),加入50 mL水,恒温(25 ℃)振荡30 min,离心,分离上清液和沉淀,湿沉淀称定质量(M1),上清液放到干燥至恒重的蒸发皿中蒸干,挥去水分,置于105 ℃烘箱中干燥至恒重(M2),计算溶解性、吸水性指数,公式分别为溶解性指数=(M2/M0)×100%、吸水性指数=[M1/(M0-M2)]×100%,结果见表4、图3。由此可知,提取物溶解性指数依次为冷冻干燥>减压干燥>常压干燥,均≥76.62%;吸水性指数依次为常压干燥>减压干燥>冷冻干燥,均≥101.38%。
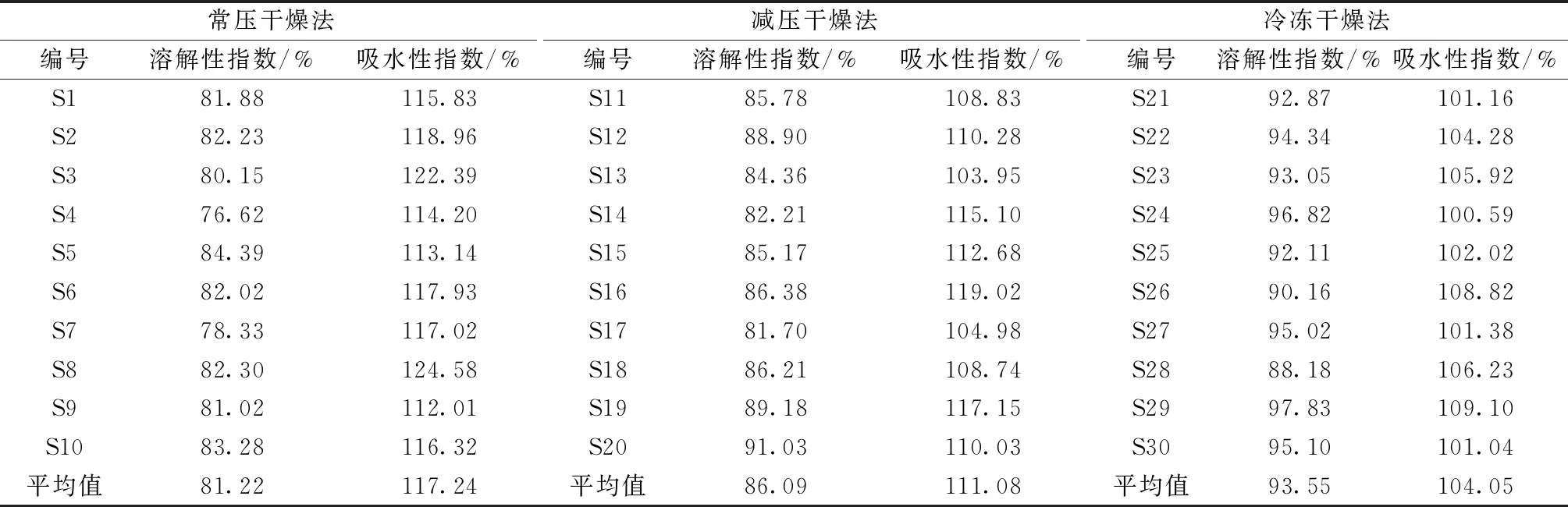
表4 不同干燥方式提取物溶解性、吸水性指数测定结果
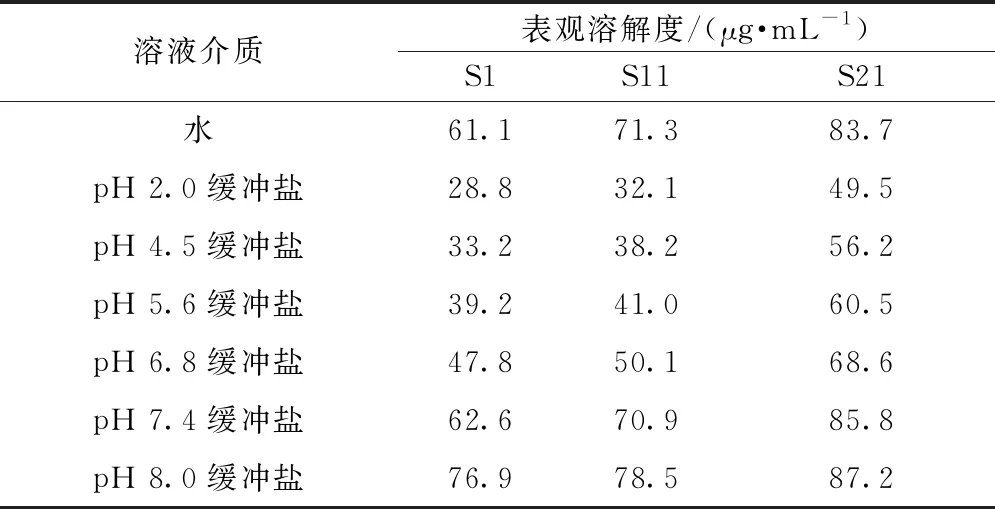
表5 提取物表观溶解度测定结果
2.4.3 吸湿性 将干燥至恒重的扁形瓶置于装有饱和氯化钠溶液[相对湿度(75±1)%、温度15.5~60 ℃]的干燥器中,室温下预饱和24 h,精密称取扁形瓶质量(M4)。取不同干燥方式提取物粉末各4.0 g,平铺于扁形瓶中(厚度小于5 mm),精密称取质量(M5),将扁形瓶敞口放置于装有饱和氯化钠溶液的干燥器中,于不同时间点取出,精密称取质量(M6),计算吸湿率,绘制吸湿曲线,公式为吸湿率=[(M6-M5)/(M5-M4)]×100%,结果见图5。
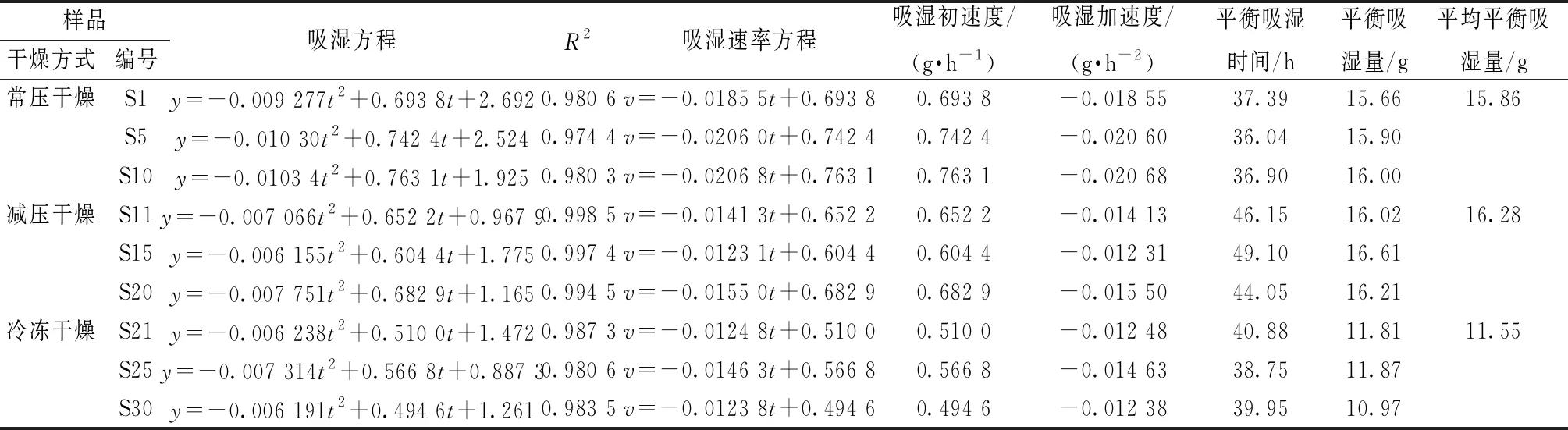
表6 提取物吸湿方程回归分析及吸湿参数
2.4.4 粒径分布特征 将预先称定质量的标准筛网按照六、七、八号筛的顺序由上至下叠放[12],精密称取3批不同干燥方式提取物粉末,每批约30 g,称定质量(Ma),置于上层筛网中,水平振摇3 min,不时在垂直方向轻扣筛以使粉末通过各号筛网,取截留粉末,称定质量(Mb),计算通过率,公式为通过率=[(Ma-Mb)/Ma]×100%,绘制粒度分布直方图,见图6。由此可知,常压干燥、减压干燥、冷冻干燥提取物经六、七号筛的通过率分别为(79.83±1.43)%、(84.01±1.66)%、(89.7 7±1.28)%,经八号筛的通过率分别为(60.76±1.93)%、(61.90±0.59)%、(66.91±1.50)%。
2.4.5 稳定性
2.4.5.1 高温试验 取不同干燥方式提取物粉末S1、S11、S21各5 g,平铺于扁形瓶底部,置于60 ℃恒温干燥箱中10 d,于第0、5、10天取样,检查外观性状,按“2.3”项下方法测定黄芪甲苷含量,结果见表7。
2.4.5.2 强光照射试验 取不同干燥方式提取物粉末S1、S11、S21各5 g,平铺于扁形瓶底部,置于装有日光灯的光照箱[(4 500±500)lx]中10 d,于第0、5、10天取样,检查外观性状,按“2.3”项下方法测定黄芪甲苷含量,结果见表7。
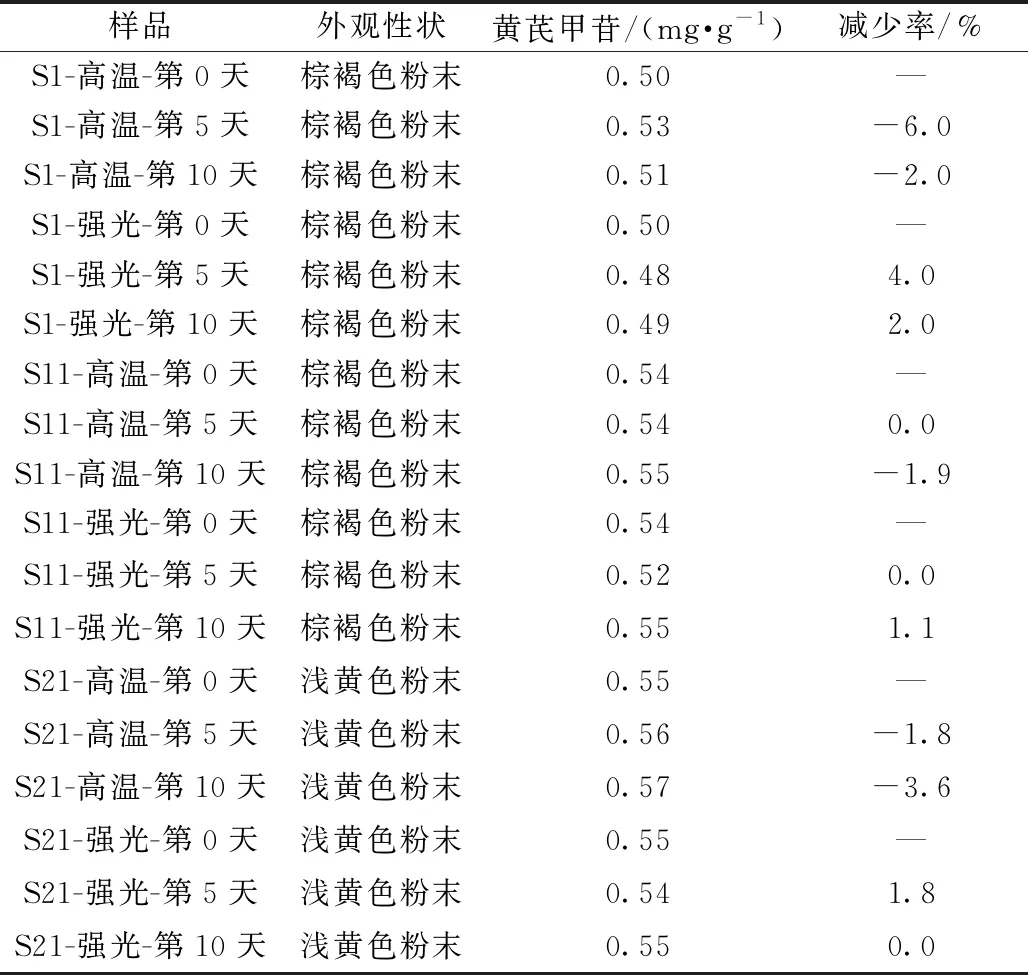
表7 高温、强光照射试验结果
2.4.5.3 高湿试验 取不同干燥方式提取物粉末S1、S11、S21各4 g,平铺于扁形瓶底部(厚度≤3 mm),精密称取质量,置于装有饱和硝酸钾溶液(相对湿度92.5%,25 ℃)的干燥器中10 d,于第0、5、10天取样,检查外观性状,测定增重率,结果见表8。
我国近代的著名教育家、艺术家们都极其注重学习中文和西文,有着深厚的国学和西学根底。他们尊崇优秀传统文化,重视国际文化交流,具有强烈的文化自觉精神和历史使命感,在中西文化互补方面起表率作用。

表8 高湿试验结果
2.4.5.4 结果分析 不同干燥方式提取物在高温、强光照射条件下,黄芪甲苷含量减少率均≤4.0%,外观性状无明显变化,表明在高温、强光照射下稳定性良好;在高湿下,不同干燥方式提取物均由粉末状变为稠膏状,增重率均≥48%,即均易吸湿液化,其中常压干燥时最大增重率达59%。
2.5 HPLC指纹图谱建立
2.5.1 色谱条件 参考文献[13]报道。Agilent ZORBAX Eclipse Plus C18色谱柱(4.6 mm×250 mm,5 μm);流动相乙腈(A)-水(B),梯度洗脱(0~18 min,90%~80%A;18~30 min,80%~72%A;30~40 min,72%~65%A;40~75 min,65%~49%A;75~100 min,49%~90%A);体积流量1.0 mL/min;柱温25 ℃;进样量20 μL;蒸发器温度50 ℃,雾化器温度50 ℃;载气体积流量1 400 mL/min。
2.5.2 对照品溶液制备 精密称取黄芪皂苷Ⅰ、黄芪皂苷Ⅱ、黄芪皂苷Ⅲ、黄芪甲苷、毛蕊异黄酮葡萄糖苷、毛蕊异黄酮、刺芒柄花苷、芒柄花黄素对照品适量,加甲醇制成质量浓度分别为0.490 8、0.490 8、0.491 2、0.484 8、0.492 4、0.491 2、0.502 9、0.492 4 mg/mL的贮备液,精密称取对照品适量,加甲醇制成质量浓度分别为0.108 8、0.101 9、0.221 5、0.223 3、0.098 9、0.098 0、0.114 7、0.115 6 mg/mL的溶液,即得。
2.5.3 供试品溶液制备 精密称取提取物粉末4.0 g,精密加入50 mL甲醇,超声(400 W、40 kHz)处理20 min,滤过,20 mL甲醇冲洗滤渣,蒸干,加10 mL水溶解,水饱和的正丁醇萃取4次,每次50 mL,合并正丁醇液蒸干,残渣加甲醇溶解,转移至10 mL量瓶中,加甲醇至刻度,摇匀,0.45 μm微孔滤膜过滤,即得。
2.5.4 专属性试验 取“2.5.2”“2.5.3”项下对照品、供试品溶液适量,在“2.5.1”项下色谱条件进样测定,结果见图7。由此可知,各成分分离度良好,表明该方法专属性良好。
2.5.5 精密度试验 取提取物(S11)粉末适量,按“2.5.3”项下方法制备供试品溶液,在“2.5.1”项下色谱条件进样测定6次,以13号峰(黄芪甲苷)为参照,测得各共有峰相对保留时间、相对峰面积RSD分别小于0.28%、2.03%,表明仪器精密度良好。
2.5.6 稳定性试验 取提取物(S11)适量,按“2.5.3”项下方法制备供试品溶液,于0、1.5、3.0、4.5、9、12、18、24 h在“2.5.1”项色谱条件下进样测定,以13号峰(黄芪甲苷)为参照,测得各共有峰相对保留时间、相对峰面积RSD分别小于0.14%、1.29%,表明溶液在常温下24 h内稳定性良好。
2.5.7 重复性试验 取提取物(S11)适量,按“2.5.3”项下方法平行制备6份供试品溶液,在“2.5.1”项色谱条件下进样测定,以13号峰(黄芪甲苷)为参照,测得各共有峰相对保留时间、相对峰面积RSD分别小于0.17%、1.43%,表明该方法重复性良好。
2.5.8 图谱生成及相似度评价 取30批样品及干燥前浸膏适量,按“2.5.3”项下方法制备供试品溶液,在“2.5.1”项色谱条件下进样测定,将数据导入“中药色谱指纹图谱相似度评价系统(2012版)”软件中,以浸膏样品的色谱图为参照图谱R,确定22个共有峰,指纹图谱见图7。与对照品溶液比对后,标定4号峰为毛蕊异黄酮葡萄糖苷,8号峰为刺芒柄花苷,11号峰为毛蕊异黄酮,13号峰为黄芪甲苷,14号峰为黄芪皂苷Ⅲ,16号峰为芒柄花黄素,17号峰为黄芪皂苷Ⅱ,20号峰为黄芪皂苷Ⅰ,其中13号峰响应值较高,分离度较好,保留时间稳定,故以其为参照。保留时间窗口设定为0.5 min,采用多点校正后进行自动匹配,生成叠加图谱(图8),测得不同干燥方式提取物图谱与对照指纹图谱的相似度均大于0.990,表明各批样品质量稳定;共有峰相对保留时间的RSD为0~0.48%,相对峰面积的RSD为16.11%~76.47%,表明各成分含量存在明显差异。
2.5.9 多元统计分析
2.5.9.1 聚类分析 以不同干燥方式提取物及浸膏指纹图谱共有模式筛选出的22个共有峰峰面积为变量,SPSS 20.0软件中的系统聚类法结合欧氏距离为样品测度,进行聚类分析[14],结果见图9。由此可知,当d=10时,30批样品聚为2类,S1~S10聚为1类,S11~S31聚为另1类,表明常压干燥提取物与减压干燥、冷冻干燥提取物存在明显差异。
2.5.9.2 偏最小二乘判别分析(PLS-DA) 对22个共有峰峰面积进行PLS-DA分析,绘制PLS-DA模型得分图,见图10,可知3种提取方式的10批样品各自聚为1类,浸膏样品另聚为1类;模型Q2=0.853,R2Y=0.929,均>0.5,表示模型成功建立。以变量重要性投影VIP>1为标准,得到10个分类标志物,分别为色谱峰12(VIP=1.300)、13(VIP=1.276)、2(VIP=1.245)、4(VIP=1.215)、8(VIP=1.204)、14(VIP=1.188)、1(VIP=1.177)、15(VIP=1.145)、6(VIP=1.111)、3(VIP=1.099),是区分知3种提取方式提取物的重要指标,见图11。
3 讨论
中成药研究对象多为中药提取物,即制剂中间体,对其化学成分进行研究的同时应结合理化性质、指纹图谱等进行综合分析,为中间体有效性研究、制剂辅料选择与优化提供参考依据[15]。
本研究以黄芪提取物为研究对象,以电导率等物理指标对黄芪水煎液进行一致性评价,在提取液制备过程中,使用粘度计对浓缩过程进行监控。综合实验结果表明,三种不同干燥方式样品均具有良好的溶解性、吸水性及高温强光稳定性,粒径分布基本一致,表观溶解度趋势一致且均在碱性条件下溶解度高。HPLC-ELSD指纹图谱相似度均在0.990以上,共有峰数目一致,说明不同干燥方式的黄芪提取物化学成分组成一致,但其理化性质及化学成分含量比例存在明显差异。常压干燥、减压干燥样品具有较强的吸湿性,冷冻干燥样品则具有较好的溶解性。观察常压干燥、减压干燥过程并分析其原因可能是二者干燥温度较高,使其外表的水分迅速挥散,形成一层干燥而光滑的膜,导致内部水分挥散受阻,一方面内部存有空气,继续受热膨胀,样品质地多孔疏松呈蜂窝状且吸湿性强,形成包裹导致溶解性降低,另一方面干燥时间长,热不稳定性成分可能会发生改变。多元统计分析结果显示,三种干燥方式样品的特征成分比例组成存在差异,其中毛蕊异黄酮、刺芒柄花苷、黄芪甲苷、毛蕊异黄酮葡萄糖苷、以及三个未指认色谱峰为主要差异因素。
本研究从宏观理化性质及微观分子组成对黄芪提取物不同干燥方式样品进行深入研究,为黄芪中药的制剂优化、二次开发提供参考。
