短管兔耳草提取物对对乙酰氨基酚诱导小鼠药物性肝损伤的保护作用与机制
2022-12-05朱继孝曾金祥吴茜娃任玲玲
毛 竹, 朱继孝, 曾金祥, 吴茜娃, 任玲玲
(江西中医药大学中药资源与民族药研究中心,江西 南昌 330004)
药物性肝损伤是指药物本身或/和其活性代谢产物所致的肝损伤,其与10%急性肝炎、50%以上急性肝衰竭、4%住院性黄疸有关[1]。近年来,我国药物性肝损伤的发病率已超过西方发达国家,成为严重威胁人们身体健康不可忽视的公共卫生问题[2]。N-乙酰半胱氨酸(NAC)、异甘次酸镁、糖皮质激素、水飞蓟素、甘草酸和S-腺苷基甲硫氨酸常用于治疗急性药物性肝损伤[3-5],但NAC治疗窗口窄且具有严重的胃肠道毒副作用[3-4],而其它药物是否可成功防治药物性肝损伤仍然存在疑问[5]。
中草药及其成分对药物性肝损伤具有良好的疗效[6-9],为筛选抗药物性肝损伤药物提供了重要途径[10]。藏药短管兔耳草系玄参科兔耳草属植物LagotisbrevitubaMaxim.的干燥全草,为藏药“洪连”的基原植物之一,具有清热解毒、行血调经之功效[11]。现代药理学研究表明短管兔耳草具有降尿酸、抗痛风、改善阿尔茨海默病症、调节小鼠免疫功能、抗肿瘤等多种活性[11-15]。本课题组前期研究发现短管兔耳草可通过清除自由基、抑制脂质过氧化反应、调控炎症因子等途径,有效防治急性酒精性肝损伤、α-异硫氰酸萘酯致肝损伤、四氯化碳致肝损伤[16-18]。最新研究表明,TLR4/NF-κB信号通路对肝损伤疾病的防治具有重要研究意义[19-21]。基于此,本研究通过TLR4/NF-κB通路继续探讨短管兔耳草提取物对对乙酰氨基酚(acetaminophen,APAP)致药物性肝损伤的保护作用及机制,以期为抗药物性肝损伤的新药开发提供一定的物质与理论基础。
1 材料
1.1 动物 SPF级健康雄性昆明种小鼠,体质量(20±2)g,购自江西中医药大学动物实验动物中心,实验动物生产许可证号SCXK(赣)2018-0003,自由饮水,适应性喂养7 d后进行实验,本实验符合江西中医药大学动物伦理委员会标准。
1.2 药材 短管兔耳草购于成都荷花池药材市场,经江西中医药大学钟国跃研究员鉴定为玄参科兔耳草属植物短管兔耳草LagotisbrevitubaMaxim.的干燥全草。称取短管兔耳草100 g,晒干粉碎,加入10倍体积60%乙醇加热回流提取2 h,过滤提取液,滤渣再同法提取2次,合并3次提取液,用旋转蒸发仪减压回收乙醇,浓缩至无醇味,得短管兔耳草提取物。以0.5%羧甲基纤维素钠配制高、中、低剂量(给药剂量按生药计分别为4.0、2.0、1.0 g/kg,小鼠灌胃容量为15 mL/kg),给药剂量参考文献以及前期预实验研究确定[16]。
1.3 试剂 对乙酰氨基酚试剂(批号099K0257)购自美国Sigma公司;N-乙酰-L-半胱氨酸(批号R018043)购自上海易恩化学技术有限公司;ALT、AST、SOD、MDA、GSH-Px、考马斯亮蓝蛋白定量测定试剂盒(批号C009-2、C010-2-1、A001-3、A003-1、A005、A045-2)购自南京建成生物工程研究所;TNF-α、IL-1β ELISA 试剂盒(批号EMC102a、EMC001b)购自深圳欣博盛生物科技有限公司;苏木素-伊红(HE)染色试剂盒(批号G1120)购自北京索莱宝科技有限公司;NF-κB p65、TLR4(批号ab16502、ab024751)购自英国Abcam公司;GAPDH、二抗(批号10494-1-AP、SA00001-2)购自美国Proteintech公司。
1.4 仪器 BT25S电子分析天平(北京赛多利斯仪器系统有限公司);RE5205旋转蒸发仪(上海亚荣生化仪器厂);超低温冰箱、Multiskan GO 全波长酶标仪(美国Thermo公司);电热恒温烘箱(上海博迅实业有限公司);DY89-Ⅱ电动匀浆机(宁波新芝生物科技股份有限公司);Centrifuge 5430R低温冷冻离心机(德国Eppendorf公司);PowerPac Basic电泳仪、ChemiDoc XR+凝胶成像仪(美国Bio-Rad公司);WD-9405B水平摇床(深圳沃德生命科技有限公司);H1210捞片机、HistoCore Arcadia C切片机、TP1020-1包埋机(德国Lecia公司);Nikon elipse ci-s 生物显微镜(日本尼康公司)。
2 方法
2.1 造模、分组及给药 将60只昆明种小鼠随机分成6组,为正常组,模型组(APAP),阳性药物组(N-乙酰-L-半胱氨酸),短管兔耳草提取物低、中、高剂量组(1.0、2.0、4.0 g/kg),每组10只。短管兔耳草提取物组灌胃给予相应剂量药物,阳性药物组灌胃给予0.2 g/kgN-乙酰-L-半胱氨酸,正常组和模型组灌胃给予等量0.5%羧甲基纤维素钠,每天1次,连续7 d。第7天给药1 h后,正常组小鼠腹腔注射生理盐水,其余组小鼠腹腔注射250 mg/kg APAP(溶于生理盐水)诱导药物性肝损伤。造模后小鼠禁食不禁水,4 h后摘眼球取血,取血后脱颈处死小鼠,立即于冰台上迅速取肝脏,用冷生理盐水漂洗肝脏,每组取相同部位肝组织(肝大叶)固定于10%甲醛中,剩余肝组织置于-80 ℃冰箱保存备用。血液室温下静置1 h,3 500 r/min离心15 min,取血清,4 ℃冷藏备用[9,22]。
2.2 试剂盒检测血清及肝组织各指标水平 按照试剂盒说明书操作,检测血清中ALT、AST活性,TNF-α、IL-1β水平及肝组织中MDA水平,GSH-Px、SOD活性。
2.3 HE染色观察肝组织病理学变化 取固定好的小鼠肝组织,置于包埋盒中流水冲洗过夜,梯度乙醇脱水,二甲苯透明,石蜡浸腊,包埋,切片,HE染色,中性树胶封片,于显微镜下观察肝脏病理学变化。
2.4 Western blot检测小鼠肝组织TLR4、NF-κB p65蛋白表达 取50 mg肝组织加1 mL 2%SDS匀浆,4 ℃、12 000×g离心10 min,取上清,采用BCA定量测定蛋白样品浓度。根据浓度制备样品后进行常规电泳,再将蛋白质转移到PVDF膜上,5%脱脂牛奶封闭2 h,一抗GAPDH(1∶5 000)、TLR4(1∶3 000)、NF-κB p65(1∶5 000)4 ℃下孵育过夜,洗膜3次,二抗(1∶5 000)室温下孵育1 h,洗膜3次,用ECL发光底物进行显影,采用Image Lab软件对所得蛋白质条带进行定量分析。
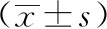
3 结果
3.1 短管兔耳草提取物对小鼠血清ALT、AST活性及TNF-α、IL-1β水平的影响 如表1所示,与正常组比较,模型组小鼠血清ALT、AST活性及TNF-α、IL-1β水平升高(P<0.01),表明造模成功;与模型组比较,阳性药物组和短管兔耳草提取物各剂量组血清ALT、AST活性及TNF-α、IL-1β水平降低(P<0.05,P<0.01),表明短管兔耳草可有效预防APAP致药物性肝损伤小鼠的肝损伤。
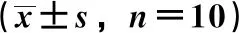
表1 短管兔耳草对小鼠血清ALT、AST活性及TNF-α、IL-1β水平的影响
3.2 短管兔耳草提取物对小鼠肝组织MDA水平及GSH-Px、SOD活性的影响 如表2所示,与正常组比较,模型组小鼠肝组织MDA水平升高(P<0.01),SOD、GSH-Px活性降低(P<0.01),说明APAP代谢形成的氧化应激产生了较大的肝损伤;与模型组比较,阳性药物组和短管兔耳草提取物各剂量组MDA水平降低(P<0.05),SOD、GSH-Px活性升高(P<0.05,P<0.01),表明短管兔耳草提取物能有效减缓APAP致药物性肝损伤小鼠的氧化应激。
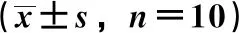
表2 短管兔耳草对小鼠肝组织MDA水平及SOD、GSH-Px活性的影响
3.3 短管兔耳草提取物对小鼠肝组织病理学的影响 如图1所示,正常组小鼠肝组织结构完整,肝小叶结构清晰,肝细胞排列整齐呈放射状且核圆而清晰,肝组织无炎性细胞浸润现象;模型组小鼠肝组织损伤严重,有大量炎性细胞浸润,肝细胞索排列紊乱,肝细胞间无明显界限,且大量肝细胞坏死;阳性药物组能改善小鼠肝细胞排列,肝组织结构较清晰,炎性细胞浸润及肝细胞坏死数量明显减少;短管兔耳草提取物低剂量组肝索排列紊乱,肝细胞出现大量核增生及核固缩,大量肝细胞坏死;短管兔耳草提取物中、高剂量组肝组织结构较清楚,肝细胞出现部分核固缩,炎性细胞浸润及肝细胞坏死数量明显减少。以上结果表明,短管兔耳草提取物可有效改善APAP致药物性肝损伤小鼠的肝脏病理学形态。
3.4 短管兔耳草提取物对小鼠肝组织中TLR4、NF-κB p65蛋白表达的影响 如图2所示,与正常组比较,模型组小鼠肝组织TLR4、NF-κB p65蛋白表达升高(P<0.01),说明APAP可激活TRL4/NF-κB p65信号通路;与模型组比较,短管兔耳草提取物各剂量组TLR4、NF-κB p65蛋白表达均降低(P<0.01),说明短管兔耳草提取物对TLR4/NF-κB信号通路具有很好的抑制作用。
4 讨论
APAP为临床上常用的一种解热镇痛药,由于其本身为非处方药且常与其它药物联用,故极易因不规范性使用导致急性肝损伤甚至肝功能衰竭[23]。APAP诱导的肝损伤已成为筛选抗药物性肝损伤药物的理想模型[24]。APAP在过量使用情况下,经细胞色素P450酶(CYP450)代谢生成大量毒性产物N-乙酰对苯醌亚胺(NAPQI),NAPQI在耗竭GSH之后,可与细胞膜上的蛋白结合,导致肝细胞损伤。同时,APAP还可诱导产生大量活性氧自由基(ROS),消耗SOD、GSH-Px、GSH等抗氧化剂,导致人体内抗氧化系统失衡,触发细胞内炎症信号通路释放炎症细胞因子,最终导致肝细胞损伤,严重时会导致肝细胞坏死[25-26]。ALT、AST及MDA等是评价药物性肝损伤程度的常用指标。当发生肝细胞发生损伤时,MDA水平升高,且细胞中ALT和AST会释放到血清中导致血清中ALT和AST活性升高[7]。本研究显示,短管兔耳草提取物能够降低APAP诱导的急性肝损伤小鼠血清ALT和AST活性,降低肝组织MDA水平,表明短管兔耳草提取物对APAP致药物性肝损伤具有一定的保护作用。短管兔耳草能提升肝组织SOD及GSH-Px活性,说明其可以通过改善氧化应激减轻APAP致药物性肝损伤发挥肝保护作用[6,8]。
TLR4属于细胞表面信号转导跨膜受体,广泛表达于Kupffer细胞、肝巨噬细胞、肝中性粒细胞及肝树突状细胞等多种肝细胞中,在免疫调节方面发挥着重要作用。NF-κB在细胞生长、凋亡和炎症反应中发挥调节作用,是重要的核转录因子[19]。在病理状态下,TLR4信号通路可激活一系列程序,包括使NF-κB p65转移至细胞核内,使炎性细胞因子如TNF-α、IL-1β释放等[21]。其中,TNF-α由Kupffer细胞产生并由T细胞激活,是最主要的炎症细胞调节因子[27]。而IL-1β由活化的巨噬细胞产生,在肝细胞坏死中起着重要作用[28]。这些释放的炎症因子表达过量又可反馈作用于NF-κB,继而加重炎症反应进一步加深肝组织的损伤[21]。因此,TLR4/NF-κB信号通路在抗肝损伤中起着重要作用[19-21]。本研究结果显示,不同剂量短管兔耳草提取物均能抑制TLR4和NF-κB p65蛋白表达,使炎性细胞因子TNF-α及IL-1β水平降低,说明抑制TLR4/NF-κB信号通路降低炎症因子水平是短管兔耳草提取物抗APAP诱导药物性肝损伤的重要机制。
综上所述,短管兔耳草提取物对APAP诱导药物性肝损伤小鼠肝脏具有一定的保护作用,其机制与TLR4/NF-κB信号通路有关。目前基于TLR4/NF-κB通路对药物性肝损伤的药理及药效物质研究仍不多见,本课题组将进一步对短管兔耳草化学成分及其药效物质进行研究,为短管兔耳草基于TLR4/NF-κB通路抗药物性肝损伤药物开发提供实验依据及物质基础。
