三七总皂苷对糖尿病肾病大鼠肾纤维化的改善作用
2022-12-05王风云肖亚利苌沛森马素好侯小丽姬新颖
李 娜, 王风云, 郑 雁, 肖亚利, 苌沛森, 马素好, 侯小丽, 姬新颖
(1.郑州澍青医学高等专科学校基础医学部,河南 郑州 450064;2.河南应用技术职业学院护理学院,河南 郑州 450000;3.河南大学医学院,河南 开封 475000)
随着人们寿命的延长和饮食结构的改变,糖尿病肾病成为我国终末期肾疾病的重要病因,严重影响人类的健康[1]。肾纤维化是糖尿病肾病的主要病理改变,其纤维化程度与肾功能损伤息息相关,但目前临床上尚无治疗肾纤维化的特效药物[2]。
鞘氨醇激酶1(SphK1)由Obinata等首次从大鼠肾组织纯化提取出来,可催化鞘氨醇(Sp)生成1-磷酸鞘氨醇(S1P)[3]。临床上发现,糖尿病肾病患者肾组织SphK1活性增强,S1P水平增加[4]。兰天等[5]研究发现,糖尿病大鼠肾脏SphK1-S1P信号通路被激活,促使肾功能损伤。相关研究发现,在高糖、糖基化终末产物(AGEs)和氧化应激等状态下,SphK1被激活,S1P水平增加使肾小球系膜细胞(MC)增殖和迁移,进而分泌大量的炎性介质和细胞外基质成分,加速肾纤维化进展[6-10]。氧化应激是高糖介导组织损伤途径的主要原因,也是肾纤维化形成的关键因素,贯穿于肾纤维化发生、发展的始终,在糖尿病肾纤维化的发病机制中发挥着重要作用[11-12]。因此,药物是否通过氧化应激途径激活SphK1-S1P信号通路,从而促进肾组织的炎症及纤维化的进程尚不明确。
传统医学认为,糖尿病肾病患者多以肾病血瘀证为主要症候,常伴有血尿,若单纯用止血药进行治疗,可止血但不可化瘀,若单纯用活血药物进行治疗,可化瘀但不可止血[13]。三七因具有活血和止血的双重功效,已成为临床上治疗肾病血瘀证患者的首选药物[14]。三七总皂苷是中药三七的主要活性成分,具有抗氧化、改善微循环、抗炎、抗休克等药理活性[15-16]。现代药理研究显示,三七总皂苷可改善糖尿病肾病模型大鼠的肾功能,延缓肾纤维化,但其具体作用机制尚不明确[17]。本研究基于SphK1-S1P信号通路,通过建立糖尿病肾病模型,探讨三七总皂苷改善糖尿病肾病肾纤维化的作用机制,以期为寻找相关药物提供新方向。
1 材料
1.1 仪器 BLT GelView 6000 Pro型化学发光成像系统(广州博鹭腾生物科技有限公司);稳捷血糖仪(美国强生公司);7600型全自动生物化学分析仪(日本日立公司);实时荧光定量聚合酶链式反应(PCR)仪(美国Thermo Fisher Scientific公司);PowerPac型电泳仪(美国Bio-Rad公司);RM2125 RTS型手动轮转式切片机(德国Leica公司);BX61型光学显微镜(日本Olympus公司);M200 PRO型多功能酶标仪(瑞士Tecan公司)。
1.2 试剂与药物 三七总皂苷(纯度99%,含量80%,批号TB20171210)购自西安天宝生物科技有限公司。链脲佐菌素(STZ,批号SO1300)购自美国Sigma公司;尿微量白蛋白(mAlb)酶联免疫吸附试验(ELISA)试剂盒(批号20170102B)购自中国原子能科学研究所;丙二醛(MDA,批号20171017)、还原型谷胱甘肽(GSH,批号20170815)、总超氧化物歧化酶(T-SOD,批号20170720)、血清胱抑素(Cys-C,批号20180714)、Masson染色试剂盒(批号20180521)均购自南京建成生物工程研究所;PCR引物由生工生物工程(上海)股份有限公司合成,引物序列及产物长度见表1;Prime ScriptTMRT reagent kit(批号DRR041)、SYBR Premix Ex TaqTMⅡ(批号RR820A)购自日本TaKaRa公司;S1P、C17-S1P对照品(纯度大于97%)购自美国Avanti Polar Lipids公司。其余试剂均为分析纯;水为超纯水。

表1 PCR引物序列
1.3 动物 SPF级SD大鼠,雄性,10~16周龄,体质量200~220 g,购自河南省实验动物中心,实验动物使用许可证号SYXK(豫)2019-0002。大鼠饲养条件为温度(23±1)℃,相对湿度(54±10)%,12 h/12 h明暗交替,自由进食饮水。
2 方法
2.1 分组、造模与给药 参照文献[18]报道,大鼠适应性喂养1周后禁食12 h,分为正常组(12只)和造模组(38只),造模组腹腔注射STZ溶液(65 mg/kg,临用时以柠檬酸-柠檬酸钠缓冲溶液溶解),正常组大鼠腹腔注射等体积柠檬酸-柠檬酸钠缓冲溶液,72 h后尾静脉采血,禁食8 h后检测空腹血糖(FBG)水平,连续4 d FBG均不低于16.7 mmol/L,则表明造模成功[19]。剔除造模不成功大鼠2只,将36只造模成功者随机分为模型组和三七总皂苷高、低剂量组(62、31 mg/kg,临用时以生理盐水溶解),每组12只,其中三七总皂苷组大鼠灌胃给予相应剂量药物,正常组和模型组大鼠灌胃给予等量生理盐水,每天1次,连续8周。
2.2 样品采集 末次给药后,大鼠转入代谢笼中,收集24 h尿液,腹腔注射5%水合氯醛(6 mL/kg)进行麻醉,腹主动脉取血2 mL(空腹时间大于8 h),2 000 r/min离心2 min,分离得血清,用于检测生化指标。取血后,大鼠脱颈椎处死,取肾组织,分离肾皮质,一部分置于4%多聚甲醛溶液中固定,用于组织病理学观察;另一部分用于肾组织氧化应激指标和相关蛋白表达的检测。
2.3 大鼠FBG、体质量检测 造模成功后,各组大鼠每周定期尾静脉采血检测其FBG和体质量。
2.4 大鼠肾组织肥大指数和肾功能相关指标检测 取“2.2”项下大鼠肾组织,称定质量,计算其肾肥大指数。取“2.2”项下大鼠尿液,按照相应试剂盒说明书方法检测mAlb水平。取“2.2”项下大鼠血清,采用全自动生化分析仪检测血清BUN、Scr、Cys-C水平。
2.5 大鼠肾组织AGEs水平及氧化应激相关指标检测 取“2.2”项下大鼠肾组织,加生理盐水进行组织匀浆,按照相应试剂盒说明书方法检测AGEs、MDA、GSH水平及T-SOD活性。
2.6 大鼠肾组织病理学形态观察 随机取“2.2”项下4%多聚甲醛溶液固定的大鼠肾组织,每组8份,经水洗、乙醇脱水后石蜡包埋,切成4 μm薄片,随机抽取一部分进行HE染色,另一部分进行Masson染色,在光学显微镜下观察,选取400倍镜下20个互不重叠的视野,采用Image-pro Plus 6.0软件进行Masson染色半定量分析,计算肾胶原蓝染面积。
2.7 RT-qPCR法检测大鼠肾组织SphK1、FNmRNA表达 取“2.2”项下大鼠肾组织,每组5份,采用TRIzol法抽提总RNA,经过逆转录反应合成cDNA,以cDNA为模板进行PCR扩增。反应体系(20 μL)为SYBR Green Mix 10 μL,正向、反向引物各0.7 μL,ddH2O 7.6 μL,cDNA模板1.0 μL。反应条件为98 ℃预变性3 min;98 ℃变性10 s,60 ℃退火10 s,72 ℃延伸30 s,循环30次;72 ℃延伸5 min。以β-actin为内参,采用2-ΔΔCT法计算目的基因mRNA相对表达,重复3次。
2.8 大鼠肾组织SphK1酶活性及S1P水平检测 随机取“2.2”项下大鼠肾组织适量,每组5份,加入裂解液裂解提取蛋白,4 ℃、14 000 r/min离心20 min,取上清液,采用BCA蛋白定量试剂盒检测蛋白浓度,参考文献[20]报道方法检测SphK1酶活性,以正常组为参照,计算其余各组相对酶活性。另随机取“2.2”项下大鼠肾组织适量,每组5份,生理盐水制备组织匀浆,采用BCA蛋白定量试剂盒检测蛋白浓度,取15 μL组织匀浆液,加入10 μL C17-S1P(内标,10 μg/L)混匀,再加入75 μL甲醇,涡旋后12 000 r/min离心5 min,取10 μL上清液,采用LC-MS/MS法检测肾组织S1P水平[21],并以正常组为参照,计算大鼠肾组织S1P相对水平。
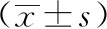
3 结果
3.1 三七总皂苷对大鼠FBG、体质量的影响 与正常组比较,模型组大鼠第2~8周FBG水平均升高(P<0.05),第4~8周体质量均降低(P<0.05);与模型组比较,三七总皂苷各剂量组大鼠第2~8周FBG水平降低(P<0.05),第4~8周体质量升高(P<0.05,P<0.01),见表2。
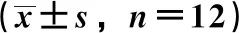
表2 各组大鼠FBG、体质量比较
3.2 三七总皂苷对大鼠肾肥大指数及肾功能相关指标的影响 与正常组比较,模型组大鼠肾肥大指数及mAlb、BUN、Scr、Cys-C水平均升高(P<0.01);与模型组比较,三七总皂苷各剂量组肾肥大指数及mAlb、BUN、Scr、Cys-C水平均降低(P<0.05,P<0.01),见表3。
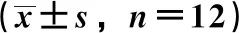
表3 各组大鼠肾肥大指数、肾功能相关指标比较
3.3 三七总皂苷对大鼠肾组织AGEs水平及氧化应激相关指标的影响 与正常组比较,模型组大鼠肾组织AGEs、MDA水平均升高(P<0.01),T-SOD活性及GSH水平均降低(P<0.01);与模型组比较,三七总皂苷各剂量组大鼠肾组织AGEs、MDA水平降低(P<0.05),T-SOD活性及GSH水平升高(P<0.05),见表4。
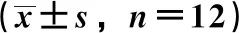
表4 各组大鼠肾组织AGEs水平、氧化应激相关指标比较
3.4 三七总皂苷对大鼠肾组织病理形态的影响 肉眼观察发现,正常组大鼠双肾颜色红润,大小正常,包膜完整;模型组大鼠双肾体积增大,颜色暗红,皮质较厚。HE染色显示,正常组大鼠肾皮质、髓质分界清晰,肾小球、肾小管排列紧密,无明显炎症细胞浸润,系膜细胞无增生,肾间质未见增生及胶原纤维组织沉积;模型组大鼠肾小球体积增大,肾小管上皮细胞空泡变性,间质增生水肿,有大量炎性细胞浸润,肾小球周边伴有大量纤维化组织沉积;三七总皂苷各剂量组大鼠肾组织的炎细胞浸润、纤维化沉积明显改善。Masson染色结果显示,与正常组比较,模型组大鼠胶原蓝染面积增加(P<0.05);与模型组比较,三七总皂苷各剂量组大鼠胶原蓝染面积减少(P<0.05),见图1、表5。
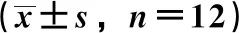
表5 各组大鼠胶原蓝染面积比较
3.5 三七总皂苷对大鼠肾组织SphK1、FNmRNA表达的影响 与正常组比较,模型组大鼠肾组织SphK1、FNmRNA表达均升高(P<0.01);与模型组比较,三七总皂苷各剂量组大鼠肾组织SphK1、FNmRNA表达降低(P<0.05,P<0.01),见图2~3。
3.6 三七总皂苷对大鼠肾组织SphK1酶活性及S1P水平的影响 与正常组比较,模型组大鼠肾组织SphK1酶活性、S1P水平均升高(P<0.01);与模型组比较,三七总皂苷各剂量大鼠肾组织SphK1酶活性、S1P水平均降低(P<0.05,P<0.01),见表6。
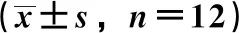
表6 各组大鼠肾组织SphK1酶活性、S1P水平比较
4 讨论
本研究通过单次腹腔注射STZ(65 mg/kg)复制大鼠糖尿病肾病模型,造模后大鼠的FBG不低于16.7 mmol/L,且肾小球体积增大,肾小管上皮细胞空泡变性,间质增生、水肿,大量炎性细胞浸润,肾小球周边伴有大量纤维化组织沉积。经三七总皂苷干预后,大鼠FBG、肾脏肥大指数、尿液中mAlb和血清中Scr、BUN、Cys-C水平均降低,肾组织炎性细胞浸润与纤维化沉积明显改善,表明三七总皂苷能改善糖尿病肾病模型大鼠的肾功能,与相关研究报道一致[22]。由于目前临床上无治疗肾纤维化的特效药,故在本研究中未设置阳性对照组。
糖尿病肾病发病机制复杂,其中高血糖是引起糖尿病肾病的重要始动因素,晚期糖基化终产物AGEs的蓄积可激活体内活性氧簇(ROS)水平,从而导致肾组织脂质过氧化和炎症反应,刺激促纤维化因子产生,进而加快肾纤维化进程[23]。氧化与抗氧化防御机制的失衡是肾间质纤维化发生发展的关键环节。GSH、T-SOD是组织内常见抗氧化剂,其水平/活性多少体现组织抗氧化能力的强弱。MDA是花生四烯酸过氧化分解产物,是氧化应激的主要指标[24]。本研究结果显示,与正常组比较,模型组大鼠肾脏中AGEs、MDA水平均升高,GSH水平及T-SOD活性均降低;经三七总皂苷干预后,大鼠肾脏GSH水平及T-SOD活性均升高,AGEs水平降低,提示三七总皂苷可能通过上调肾组织GSH水平及T-SOD活性,发挥抗氧化作用,从而改善肾损伤。
在高糖、AGEs和氧化应激等状态下,SphK1/S1P信号通路可被激活,从而调节肾纤维化进程[25-26]。Huang等[27]研究发现,在特发性肺纤维化时,抑制Sphk1的活性可使人肺成纤维细胞(HLFs)中FN和α-平滑肌肌动蛋白(α-SMA)水平降低,由此推测,抑制Sphk1活性可改善器官纤维化。本研究结果显示,与正常组比较,模型组大鼠肾组织SphK1、FNmRNA表达及SphK1酶活性、S1P水平均升高;经三七总皂苷干预后,大鼠肾组织SphK1、FNmRNA表达及SphK1酶活性、S1P水平均降低,提示三七总皂苷可通过抑制SphK1/S1P信号通路活性,下调FN表达,进而延缓肾组织的纤维化进程。
综上所述,三七总皂苷可改善糖尿病肾病模型大鼠的肾功能,其作用机制可能与抗氧化、抑制SphK1/S1P通路活性、下调FN表达有关。
