IPI-504通过LINC00312/let-7b-5p/EBF1轴抑制胰腺癌细胞的增殖和迁移
2022-12-04胡耀元谭晓冬李锐
胡耀元,谭晓冬,李锐
(中国医科大学附属盛京医院普通外科,沈阳 110004)
胰腺癌是最致命的肿瘤之一,也是癌症相关死亡的主要原因之一[1]。胰腺癌患者预后不良的主要原因是手术切除率低、对放化疗敏感性差、复发和转移率高。手术切除加围术期化疗是胰腺癌的标准治疗方法,但疗效不理想。由于胰腺癌组织中血液供应不良和免疫抑制微环境,化疗药物难以在肿瘤内达到有效的治疗浓度[2]。因此,开发有效的胰腺癌治疗药物刻不容缓。热休克蛋白(heat shock protein,HSP)90抑制剂在体外具有抗胰腺癌活性。IPI-504是一种HSP90抑制剂,在水中高度溶解且耐受性良好,是一种有前途的癌症治疗药物[3]。因此,探究IPI-504抑制胰腺癌进展的机制对促进其广泛应用十分必要。
本研究前期通过生物信息学分析筛选出IPI-504处理后上调且在胰腺癌组织中下调的LINC00312。研究[4-5]表明,LINC00312在多种癌症中发挥抑癌作用,但尚无研究报道其在胰腺癌中的作用。众所周知,长链非编码RNA(long noncoding RNA,lncRNA)通过与mRNA竞争结合微RNA(microRNA,miRNA),调节miRNA下游靶基因表达。本研究进一步分析与LINC00312结合的miRNA,发现let-7家族与LINC00312结合,且生物信息学分析显示,let-7b-5p高表达的胰腺癌患者总生存率低。研究[6]表明,let-7b-5p在多种癌组织中表达上调,从而促进癌症进展。此外,let-7b-5p在胰腺癌患者血清中上调,可能作为胰腺癌诊断的依据[7]。LINC00312是否结合let-7b-5p并在肿瘤中发挥调控作用,目前尚无研究报道。此外,本研究前期还预测了let-7b-5p的下游靶基因,并筛选出在胰腺癌中下调且在IPI-504处理的胰腺癌细胞中下调的let-7b-5p下游靶基因,包括SVEP1、ADAMTS3、ADCY1和早期B细胞因子1(early B cell factor 1,EBF1)。EBF1是位于人类染色体5q34上的转录因子,研究[8]表明,其表达在胰腺导管腺癌组织中下调,其敲低增加癌细胞活力和迁移,其在胰腺癌中的具体作用及机制有待进一步分析。因此,本研究探究了IPI-504介导的LINC00312/let-7b-5p/EBF1轴对胰腺癌细胞增殖和迁移的作用,并分析LINC00312、let-7b-5p和EBF1间的靶向关系,从而为探索胰腺癌诊断和治疗方法提供新思路。
1 材料与方法
1.1 细胞、试剂和仪器
人胰腺癌PANC-1细胞,购自武汉普诺赛生命科技有限公司。IPI-504购自美国MCE公司;双荧光素酶报告基因检测试剂盒、化学发光检测系统购自美国Promega公司;总RNA提取、实时荧光定量PCR(real-time fluorescence quantitative PCR,qRT-PCR)和逆转录试剂盒均购自南京诺唯赞生物科技股份有限公司;BCA试剂盒购自美国Thermo公司;EBF1抗体购自武汉三鹰生物技术有限公司;CCK-8试剂盒购自上海碧云天生物技术有限公司;倒置显微镜购自日本奥林巴斯公司;酶标仪购自上海中庸检验设备有限公司;qRT-PCR仪购自瑞士Roche公司;普通PCR仪购自美国ABI公司;全自动化学发光分析系统购自上海天能科技有限公司。
1.2 双荧光素酶报告基因实验
通过lncRNASNP2数据库(https://bioinfo.life.hust.edu.cn/lncRNASNP#!/)预测let-7b-5p与LINC00312的结合位点,通过ENCORI数据库预测let-7b-5p与EBF1mRNA的结合位点。将PANC-1细胞分为LINC00312-WT+NC mimics 组、LINC00312-WT+let-7b-5p mimics组、LINC00312-MUT+NC mimics 组、LINC00312-MUT+let-7b-5p mimics组、EBF1-WT+NC mimics组、EBF1-WT+let-7b-5p mimics组、EBF1-MUT+NC mimics 组和EBF1-MUT+let-7b-5p mimics组,按照Lipofectamine 3000转染试剂说明书进行转染。LINC00312-WT+NC mimics 组细胞转染包含let-7b-5p与LINC00312潜在结合位点序列的野生型质粒(LINC00312-WT)和NC mimics;LINC00312-WT+let-7b-5p mimics组转染LINC00312-WT和let-7b-5p mimics;LINC00312-MUT+NC mimics 组转染包含let-7b-5p与LINC00312潜在结合位点突变序列的突变型质粒(LINC00312-MUT)和NC mimics;LINC00312-MUT+let-7b-5p mimics组转染LINC00312-MUT和let-7b-5p mimics;EBF1-WT+NC mimics 组转染包含let-7b-5p与EBF1mRNA潜在结合位点序列的野生型质粒(EBF1-WT)和NC mimics;EBF1-WT+let-7b-5p mimics组 转染EBF1-WT和let-7b-5p mimics;EBF1-MUT+NC mimics 组转染包含let-7b-5p与EBF1mRNA潜在结合位点突变序列的突变型质粒(EBF1-MUT)和NC mimics;EBF1-MUT+let-7b-5p mimics组转染EBF1-MUT和let-7b-5p mimics。继续培养24 h后检测相对荧光素酶活性。
1.3 细胞培养和转染
PANC-1细胞用含10%胎牛血清和1%青链霉素的DMEM高糖培养基在37 ℃、含5% CO2的恒温细胞培养箱中培养。将细胞分为对照组、IPI-504组、IPI-504+敲减对照组、IPI-504+敲减LINC00312组、IPI-504+NC mimics 组、IPI-504+let-7b-5p mimics组和IPI-504+敲减EBF1组。对照组细胞不做处理;IPI-504组细胞加入终浓度1 μmol/L IPI-504处理48 h;IPI-504+敲减对照组细胞转染敲减对照质粒;IPI-504+敲减LINC00312组转染敲减LINC00312质粒;IPI-504+NC mimics 组转染NC mimics;IPI-504+let-7b-5p mimics组转染let-7b-5p mimics;IPI-504+敲减EBF1组转染敲减EBF1质粒。IPI-504+敲减对照组、IPI-504+敲减LINC00312组、IPI-504+NC mimics 组、IPI-504+let-7b-5p mimics组和IPI-504+敲减EBF1组细胞于转染后24 h加入终浓度1 μmol/L IPI-504。加入IPI-504后24 h,收集各组细胞进行后续实验。
1.4 qRT-PCR
取转染后24 h的各组细胞,TRIzol法提取细胞总RNA,将RNA反转录成cDNA,严格按照SYBR qRT-PCR试剂盒说明书进行qRT-PCR 。反应条件为95℃预变性30 s;95 ℃ 10 s,60 ℃ 30 s循环反应,40个循环。以GAPDH或U6为内参,根据2-△△Ct法计算LINC00312和EBF1mRNA或let-7b-5p的相对表达量。引物序列:LINC00312,正向5’-AAGCGAACCAAGC CAATA-3’,反向5’-CAAATCCCTGAAACTCTG-3’;EBF1,正向5’-AGCTTCTCTACAGCAATGGGAT-3’,反向5’-TGAGCAAGACTCGGCACATT-3’;GAPDH,正向5’-TCATTTCCTGGTATGACAACGA-3’,反向5’-GTCTTACTCCTTGGAGGCC-3’;let-7b-5p,正向5’-GCGCTGAGGTAGTAGGTTGTG-3’,反向5’-GTG CAGGGTCCGAGGT-3;U6,正向5’-GTGCTCGCTTCG GCAGCACATATAC-3’,反向 5’-AAAAATATGGAAC GCTCACGAATTTG-3’。
1.5 CCK-8法
将各组细胞以5×103/孔的密度接种于96孔板中,培养过夜后取出板,弃培养基,加入CCK-8检测液,37 ℃孵育1 h,酶标仪检测450 nm处吸光度值。
1.6 Transwell实验
将各组细胞以1×105/孔的密度接种于Transwell小室上室,向上室中加入无血清培养基,下室中加入含20%胎牛血清的培养基,继续培养24 h后取出上室,PBS洗涤后加入4%多聚甲醛,室温固定10 min,PBS洗涤3次,结晶紫染色1 h,蒸馏水漂洗,倒置显微镜下观察和拍照。
1.7 Western blotting
收集细胞,使用RIPA裂解液提取细胞总蛋白,BCA法定量蛋白,煮样,上样于聚丙烯酰胺凝胶,电泳分离蛋白,将蛋白转移到PVDF膜上,5%脱脂奶粉封闭,一抗4 ℃孵育过夜,PBST洗膜,二抗室温孵育1 h,PBST洗膜,ECL化学发光,使用ImageJ软件进行灰度分析。
1.8 统计学分析
采用SPSS 22.0软件进行统计学分析。数据均符合正态分布,以表示,多组间的比较采用单因素方差分析,并采用Tukey事后检验进行组间两两比较。P< 0.05为差异有统计学意义。
2 结果
2.1 LINC00312与let-7b-5p以及let-7b-5p与EBF1的靶向关系
生物信息学分析结果显示,let-7b-5p与LINC00312(图1A)以及let-7b-5p与EBF1mRNA存在结合位点(图1B)。双荧光素酶报告基因实验结果(图1C、1D)显示,LINC00312-WT+let-7b-5p mimics组与LINC00312-WT+NC mimics 组比较,EBF1-WT+let-7b-5p mimics组与EBF1-WT+NC mimics 组比较,PANC-1细胞相对荧光素酶活性显著降低(P< 0.05);LINC00312-MUT+let-7b-5p mimics组与LINC00312-MUT+NC mimics组比较,EBF1-MUT+let-7b-5p mimics组与EBF1-MUT+NC mimics 组比较,PANC-1细胞相对荧光素酶活性无统计学差异(P> 0.05)。

图1 LINC00312、EBF1 mRNA与let-7b-5p结合Fig.1 LINC00312 and EBF1 mRNA combined with let-7b-5p
2.2 IPI-504通过LINC00312影响胰腺癌细胞增殖和迁移
qRT-PCR结果(图2A)显示,与对照组比较,IPI-504组和IPI-504+敲减对照组PANC-1细胞LINC00312表达显著升高,let-7b-5p表达显著降低(P< 0.05);与IPI-504组和IPI-504+敲减对照组比较,IPI-504+敲减LINC00312组PANC-1细胞LINC00312表达显著降低,let-7b-5p表达显著升高(P< 0.05)。
CCK-8结果(图2B)显示,与对照组比较,IPI-504组和IPI-504+敲减对照组PANC-1细胞增殖活性显著降低(P< 0.05);与IPI-504组和IPI-504+敲减对照组比较,IPI-504+敲减LINC00312组PANC-1细胞增殖活性显著升高(P< 0.05)。
Transwell结果(图2C)显示,与对照组比较,IPI-504组和IPI-504+敲减对照组PANC-1细胞穿膜细胞数显著降低(P< 0.05);与IPI-504组和IPI-504+敲减对照组比较,IPI-504+敲减LINC00312组PANC-1细胞穿膜细胞数显著升高(P< 0.05)。
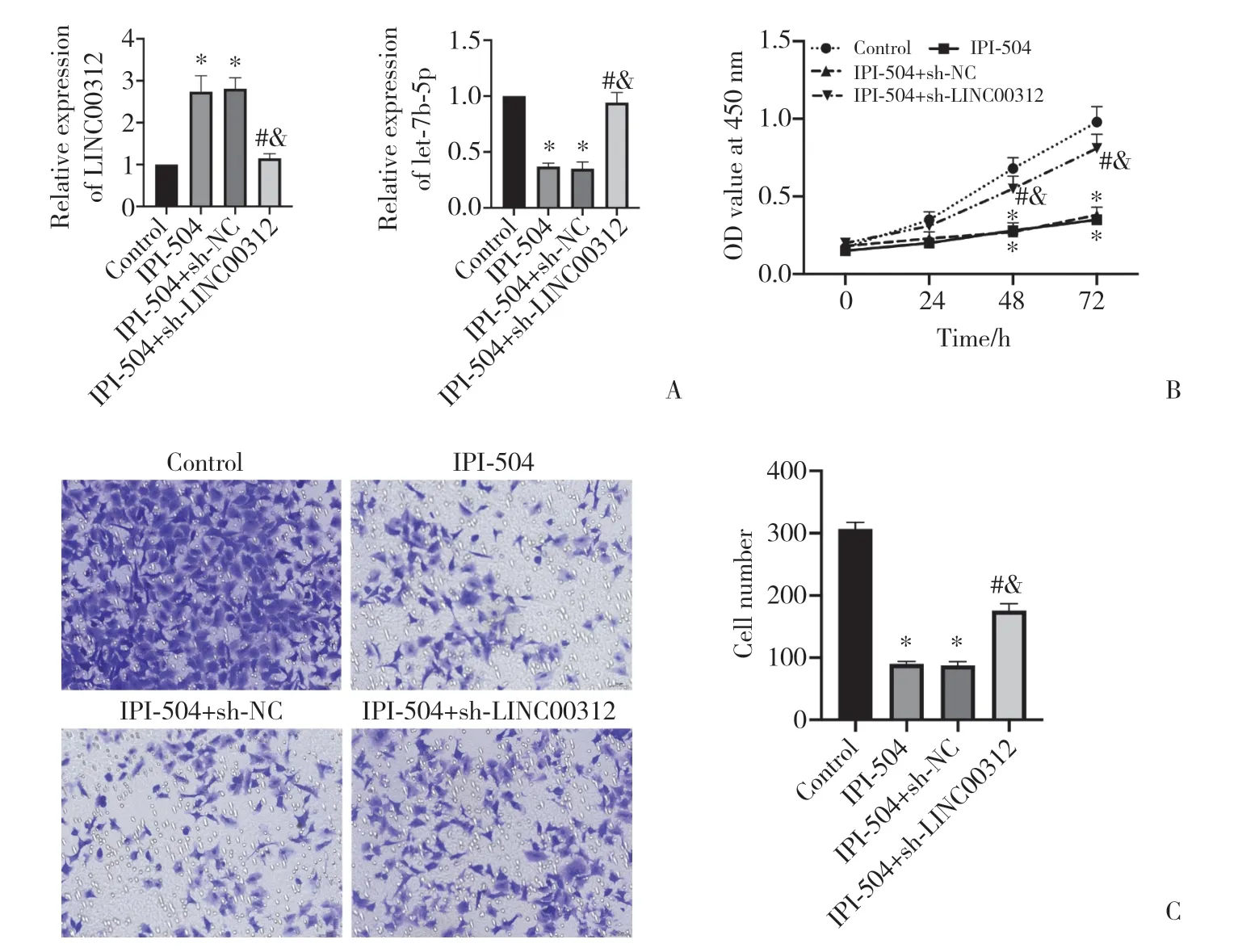
图2 IPI-504通过LINC00312影响胰腺癌细胞的增殖和迁移Fig.2 IPI-504 affects pancreatic cancer cell proliferation and migration through LINC00312
2.3 IPI-504通过let-7b-5p影响胰腺癌细胞增殖和迁移
qRT-PCR结果(图3A)显示,与对照组比较,IPI-504组和IPI-504+NC mimics 组PANC-1细胞let-7b-5p表达显著降低(P< 0.05);与IPI-504组和IPI-504+NC mimics组比较,IPI-504+let-7b-5p mimics组PANC-1细胞let-7b-5p表达显著升高(P< 0.05)。
CCK-8结果(图3B)显示,与对照组比较,IPI-504组和IPI-504+NC mimics组PANC-1细胞增殖活性显著降低(P< 0.05);与IPI-504组和IPI-504+NC mimics组比较,IPI-504+let-7b-5p mimics组PANC-1细胞增殖活性显著升高(P< 0.05)。
Transwell结果(图3C)显示,与对照组比较,IPI-504组和IPI-504+NC mimics组PANC-1细胞穿膜细胞数显著降低(P< 0.05);与IPI-504组和IPI-504+NC mimics组比较,IPI-504+let-7b-5p mimics组PANC-1细胞穿膜细胞数显著升高(P< 0.05)。
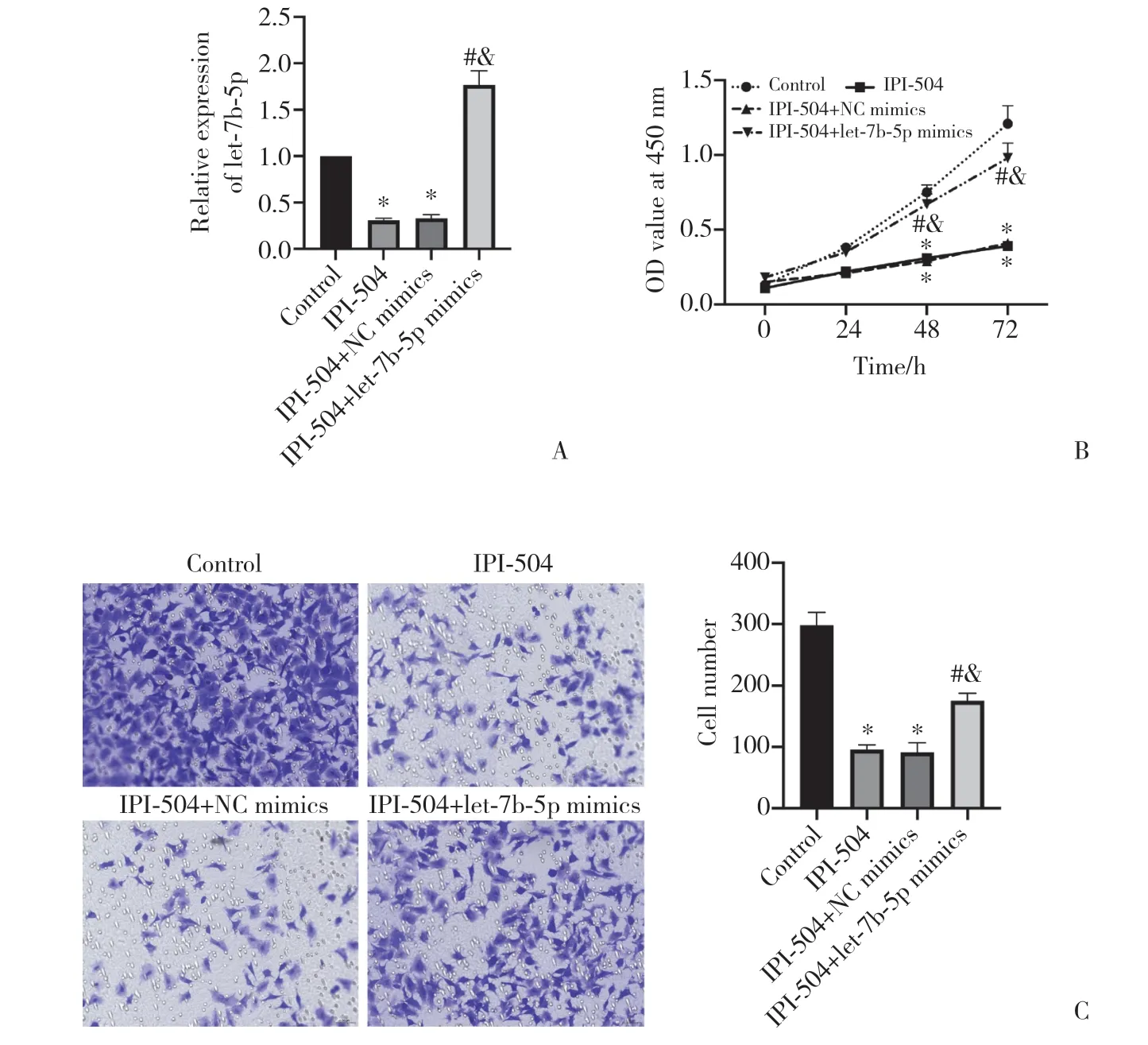
图3 IPI-504通过let-7b-5p影响胰腺癌细胞的增殖和迁移Fig.3 IPI-504 affects pancreatic cancer cell proliferation and migration through let-7b-5p
2.4 IPI-504通过EBF1影响胰腺癌细胞的增殖和迁移
Western blotting结果(图4A)显示,与对照组比较,IPI-504组和IPI-504+敲减对照组PANC-1细胞EBF1蛋白表达显著升高(P< 0.05);与IPI-504组和IPI-504+敲减对照组比较,IPI-504+敲减LINC00312组PANC-1细胞EBF1蛋白表达显著降低(P< 0.05)。
CCK-8结果(图4B)显示,与对照组比较,IPI-504组和IPI-504+敲减对照组PANC-1细胞增殖活性显著降低(P< 0.05);与IPI-504组和IPI-504+敲减对照组比较,IPI-504+敲减EBF1组PANC-1细胞增殖活性显著升高(P< 0.05)。
Transwell结果(图4C)显示,与对照组比较,IPI-504组和IPI-504+敲减对照组PANC-1细胞穿膜细胞数显著降低(P< 0.05);与IPI-504组和IPI-504+敲减对照组比较,IPI-504+敲减EBF1组PANC-1细胞穿膜细胞数显著升高(P< 0.05)。

图4 IPI-504通过EBF1影响胰腺癌细胞的增殖和迁移Fig.4 IPI-504 affects pancreatic cancer cell proliferation and migration through EBF1
3 讨论
多种lncRNA参与胰腺癌进展,如MACC1-AS1在胰腺癌组织中高表达且高表达患者生存率低,其沉默抑制胰腺癌细胞的增殖和转移能力[9]。LINC00976在胰腺癌组织和细胞系中上调,且与患者的不良生存率相关,其沉默在体内和体外抑制胰腺癌的增殖、迁移潜力和侵袭性[10]。LINC00312是在鼻咽癌中发现的一个基因间lncRNA[11]。其过表达抑制肝细胞肝癌细胞增殖,促进细胞凋亡,下调细胞周期蛋白B1并诱导G2~M细胞周期停滞,从而在肝细胞肝癌中发挥抑癌作用[12]。还有研究[13]发现,LINC00312在非小细胞肺癌组织中表达下调,其表达降低与肿瘤体积增加和晚期相关,LINC00312在体内外均能抑制细胞增殖,促进细胞凋亡。此外,LINC00312还能通过直接结合转录因子Y-Box结合蛋白1诱导肺癌细胞的迁移、侵袭和血管生成拟态[14]。MIN等[15]发现,LINC00312在甲状腺癌组织和细胞中低表达,沉默LINC00312促进甲状腺癌细胞的侵袭和增殖。多项研究证实LINC00312在多种癌症中发挥抑癌作用,但目前尚无LINC00312在胰腺癌中作用的研究。本研究在体外验证了IPI-504处理增加胰腺癌细胞LINC00312表达,且敲减LINC00312逆转了IPI-504对胰腺癌细胞增殖和迁移的抑制作用,表明IPI-504通过上调LINC00312表达抑制胰腺癌细胞的增殖和迁移。
众所周知,lncRNA通过海绵化miRNA调节其靶基因表达。因此,本研究预测了与LINC00312结合的miRNA,发现let-7b-5p与LINC00312结合。研究[6]表明,let-7b-5p在卵巢癌和前列腺癌中发挥促癌作用。本研究发现,IPI-504处理降低胰腺癌细胞let-7b-5p表达,过表达let-7b-5p逆转了IPI-504对胰腺癌细胞增殖和迁移的抑制作用,表明IPI-504诱导的LINC00312可能通过海绵化let-7b-5p抑制胰腺癌细胞增殖和迁移。进一步分析let-7b-5p下游靶基因,发现EBF1mRNA与let-7b-5p存在潜在结合位点。本研究进一步验证LINC00312/let-7b-5p轴是否通过靶向调节EBF1表达发挥作用。EBF1是参与多种细胞谱系的分化和成熟的DNA结合转录因子,其基因缺失有助于B祖细胞急性淋巴细胞白血病的耐药性和复发[8]。本研究发现,IPI-504处理增加胰腺癌细胞EBF1蛋白表达,敲减LINC00312能够降低IPI-504处理的胰腺癌细胞EBF1蛋白表达。此外,敲减EBF1逆转了IPI-504对胰腺癌细胞增殖和迁移的抑制作用,表明IPI-504通过LINC00312/let-7b-5p/EBF1轴抑制胰腺癌细胞的增殖和迁移。
综上所述,本研究发现,IPI-504上调的LINC00312通过海绵化let-7b-5p上调EBF1表达,从而抑制胰腺癌细胞的增殖和迁移,为IPI-504作为胰腺癌的潜在治疗药物提供了理论依据。
