东北林蛙皮糖胺聚糖分析及其体外免疫活性
2022-12-03奇郑冉张怡李波刘达李宜平焦丽丽
于 奇郑冉张怡李波刘达 李宜平 焦丽丽
(1.长春中医药大学药学院, 吉林 长春130117; 2.长春中医药大学吉林省人参科学研究院, 吉林 长春130117)
东北林蛙Rana dybowskiiGuenther 为蛙科林蛙属两栖动物,俗称“哈士蟆”[1],广泛分布于黑龙江、吉林、辽宁、内蒙古等地区,主产于长白山区域,是我国著名的药食两用药材[2]。东北蛙皮中具有一定量的糖胺聚糖,在抗氧化[3]、抗凝血[4]、抗肿瘤[5]及免疫调节[6]方面呈现出较强的生物活性。近年来,许多国内外学者对林蛙皮多糖的研究主要集中在提取、分离纯化及抗氧化[7⁃9]活性等方面,但对其结构特征仍不清楚。基于此,本研究以东北林蛙皮为原料,采用水提醇沉法分离纯化得到林蛙皮多糖DGP 和DGPA,初步分析两者基础结构,并对其体外免疫活性进行研究,以期为进一步研究该成分结构及构效关系奠定基础。
1 材料
1.1 试剂、药物与动物 东北林蛙皮采自吉林省舒兰市上营森林经营局桃园林场(东经127°25′36.18",北纬44°09′41.7",海拔338 m),经长春中医药大学李宜平教授鉴定为东北林蛙Rana dybowskiiGuenther 的干燥皮肤。8~10周龄ICR 雄性小鼠,体质量(20.0±2.0)g,购自长春市亿斯实验动物技术有限责任公司,实验动物生产许可证号SCXK(辽)2020⁃0001,在相对湿度40%~60%,温度22~25 ℃的无菌动物房中适应性喂养1 周。研究获长春中医药大学伦理委员会批准,实验操作严格执行国际动物实验方针。SepharoseTMCL⁃6B 凝胶柱购自美国GE Healthcare 公司。标准分子量葡聚糖、单糖对照品购自上海源叶生物科技有限公司;考马斯亮蓝试剂盒购自南京建成生物工程研究所;1640 培养基购自美国Gibco 公司;新生牛血清购自浙江天杭生物科技股份有限公司;脂多糖(LPS)、半刀豆蛋白(ConA)、青霉素、链霉素、二甲基亚砜、MTT 均购自美国Sigma 公司。无水乙醇、氢氧化钠、三氟乙酸、三氯甲烷、正丁醇、氨基磺酸、盐酸、苯酚、硫酸等试剂均购自国药集团化学试剂有限公司。
1.2 仪器 Model 680 型酶标仪购自美国Bio⁃Rad 公司;真空干燥箱购自上海精宏实验设备有限公司;恒温磁力搅拌器购自杭州仪表电机有限公司;离心机购自美国Sigma 公司;循环水式真空泵购自郑州长城科工贸有限公司;二氧化碳培养箱购自日本Sanyo 公司;UV⁃8000 型紫外分光光度计购自上海元析仪器有限公司;傅里叶红外光谱仪购自美国Thermo Fisher Scientific 公司。
2 方法
2.1 多糖制备 林蛙皮经水提[10]、醇沉后得粗多糖DGP,采用Sevage 法[7]脱蛋白后进一步用Sepharose CL⁃6B 琼脂糖凝胶柱层析,得纯化后多糖DGPA。
2.2 多糖理化性质分析 采用考马斯亮蓝法、间羟基联苯法对DGP、DGPA 总蛋白及糖醛酸水平进行检测。
2.3 多糖分子量测定 参考文献[6] 报道,色谱条件为TSKgel G3000 PWXL 色谱柱(7.8 mm×30.0 cm,5 μm);流动相超纯水;体积流量0.5 mL/min;柱温40 ℃;进样量20 μL。采用视差折射检测器,用流动相配制不同分子量对照品溶液,多糖配制为10 mg/mL 溶液,0.22 μm 微孔滤膜过滤。
2.4 多糖傅里叶变换红外光谱分析 2~3 mg 多糖与适量KBr 混合研细后压片,在4 000~500 cm-1波数范围内进行红外光谱扫描。
2.5 单糖组成分析 多糖经三氟乙酸(TFA)水解后进行PMP 衍生。参考文献[11] 报道,色谱条件为C18Thermo hyperil ODS⁃2 色谱柱(4.6 mm×25 cm,5 μm);流动相17%乙腈⁃83% PBS;体积流量1 mL/min;柱温25 ℃;进样量20 μL;检测波长245 nm。
2.6 体外免疫活性检测
2.6.1 多糖对小鼠淋巴细胞增殖转化的影响 小鼠脱颈处死,无菌条件下解剖并取出脾脏,研磨制成脾细胞悬液,1 500 r/min离心5 min,弃上清,Tris⁃NH4Cl 低渗液裂解红细胞,离心,D⁃Hanks 缓冲液洗涤,培养液将细胞密度稀释至1×106/mL,制成单细胞悬液[12],加入细胞培养板中,每孔100 μL,随机分为空白 组、ConA 组(5 μg/mL ConA)、LPS 组(10 μg/mL LPS)、DGP 组(50、100、200、400 μg/mL 多糖溶 液)、DGPA 组(50、100、200、400 μg/mL 糖胺聚糖溶液)、阳性对照组(5 μg/mL ConA或10 μg/mL LPS),培养液补至200 μL,混匀,重复3孔,在5% CO2、37 ℃条件下培养44 h后,每孔加入20 μL MTT(5 mg/mL),继续培养4 h,弃上清,加入150 μL 二甲基亚砜,于570 nm 波长处测定吸光度。
2.6.2 多糖对腹腔巨噬细胞的影响 小鼠腹腔注射6%可溶性淀粉2 mL,3 d 后处死,10 mL D⁃Hanks 缓冲液清洗腹腔,收集液体,4 ℃离心后弃上清,1640 完全培养基重悬细胞,调整细胞密度为2×106/mL,取100 μL 接种至96 孔板,在5% CO2、37 ℃下预孵3 h,PBS 清洗2~3次,除去贴壁细胞,制得纯化巨噬细胞。
2.6.2.1 多糖对腹腔巨噬细胞吞噬功能的影响 将纯化后的巨噬细胞加到待测糖样(200 μL/孔)中,继续培养24 h后吸弃上清,每孔加入100 μL 0.075%中性红溶液继续培养1 h,pH 7.4 PBS 洗去剩余中性红后,加入100 μL 细胞裂解液,24 h 后采用酶标仪于550 nm 波长处检测吸光度。
2.6.2.2 多糖对腹腔巨噬细胞NO 水平的影响 配制6 个不同浓度的NaNO2溶液,分别加到96 孔板中,加入等体积Griess 试剂,10 min 后于540 nm 波长处检测吸光度,绘制标准曲线。细胞以2×106/mL 密度接种至24 孔板,加入多糖培养24 h,吸取细胞培养液上清100 μL 加到另一培养板中,加入等体积Griess 试剂,10 min 后在540 nm 波长处测定吸光度,根据标准曲线计算NO 水平。
2.6.2.3 TNF⁃α 水平检测 腹腔巨噬细胞与多糖一起培养,取上清液,采用ELISA 试剂盒检测细胞上清TNF⁃α水平。
2.7 统计学分析 通过SPSS 23.0 软件进行处理,结果以()表示,组间比较采用单因素方差分析,两两比较采用t检验。P<0.05 表示差异具有统计学意义。
3 结果
3.1 糖胺聚糖柱层析纯化 图1 显示,DGP 过SepharoseTMCL⁃6B 柱后得到单一、对称的洗脱峰,收集相应多糖洗脱液,即为糖胺聚糖DGPA。
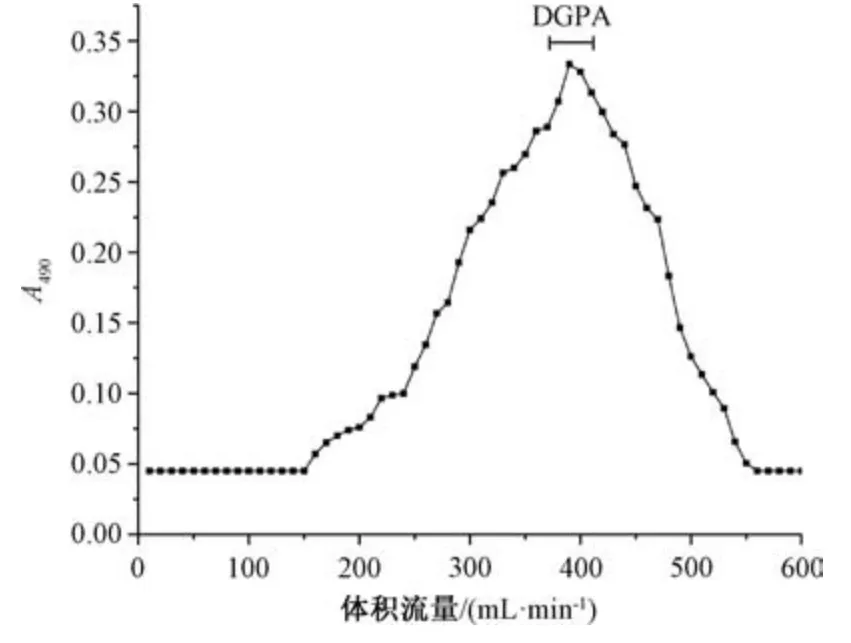
图1 糖胺聚糖DGPA SepharoseTMCL⁃6B 柱层析
3.2 多糖理化性质 DGP、DGPA 总蛋白质量分数分别为19.93%、6.24%。采用间羟基联苯法,以D⁃半乳糖醛酸含量为横坐标(X),吸光度为纵坐标(A)进行回归,得方程为A=0.010 7X+0.059 2(R2=0.998 3),DGP、DGPA糖醛酸质量分数分别为14.5%、18.6%。DGPA 经高效凝胶渗透色谱法分析,以保留时间为横坐标(X),标准分子量为纵坐标(Y)进行回归,得方程为Y=-0.354 1X+9.392 7(R2=0.996 7),测得DGPA 分子量为141 kDa。
3.3 单糖组成 图2~3 显示,DGP、DGPA 单糖组成相同,均由甘露糖、葡萄糖醛酸、葡萄糖、氨基半乳糖、半乳糖组成,前者摩尔比为0.30∶2.05∶0.17∶1∶0.23,以葡萄糖醛酸、氨基半乳糖为主,表达为81.3%;后者摩尔比为0.41∶2.67∶0.16∶1∶0.25,以糖醛酸为主,表达为59.4%。
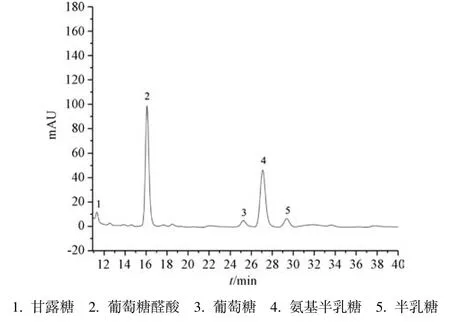
图2 DGP 单糖HPLC 色谱图
3.4 多糖红外光谱分析 图4 显示,3 370.38 cm-1左右的吸收峰为糖类⁃OH 的特征吸收峰,2 936.27 cm-1处的吸收峰为C⁃H 键强伸缩振动,1 653.10、1 544.57 cm-1左右的吸收峰说明有乙酰氨基(⁃NH2COCH3)存在,1 408.12 cm-1处的吸收峰为⁃COO-的特征吸收峰。综上所述,⁃OH、⁃C⁃H链、⁃NH2COCH3、⁃COO 是糖的特征基团,故DGPA 为糖胺聚糖。
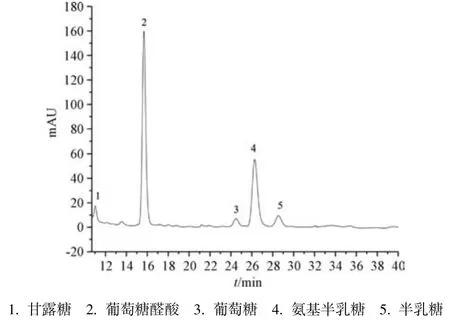
图3 DGPA 单糖HPLC 色谱图
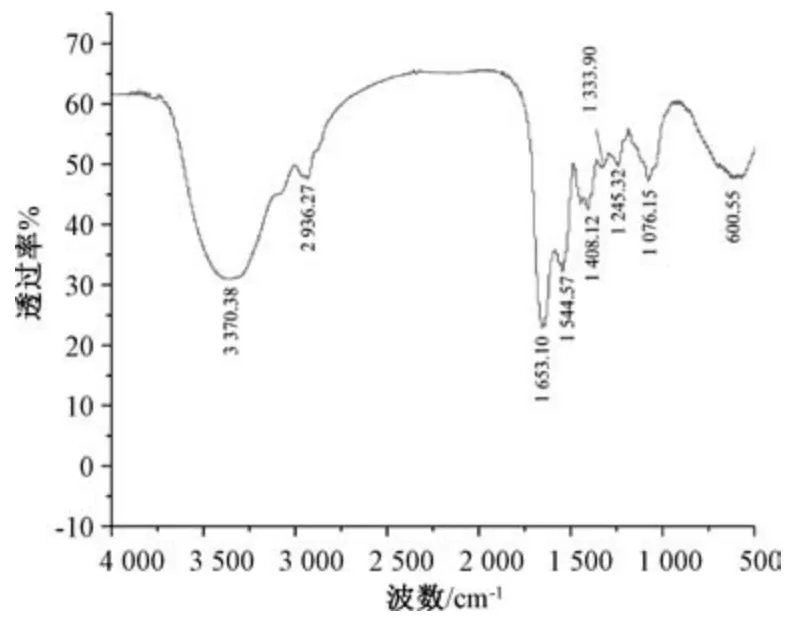
图4 DGPA 红外光谱图
3.5 多糖对小鼠脾淋巴细胞增殖的影响 图5 显示,与空白组比较,DGP 组、DGPA 组小鼠淋巴细胞增殖能力增强(P<0.05,P<0.01),并均呈剂量依赖性;与DGP 组比较,DGPA 组小鼠淋巴细胞增殖能力增强(P<0.05,P<0.01)。图6~7 显示,在50~400 μg/mL 质量浓度范围内,DGP组、DGPA 组协同ConA 作用小鼠脾淋巴细胞时,细胞增殖能力高于ConA 组(P<0.01),表明两者均能促进诱导ConA 诱导的T 淋巴细胞增殖,并呈剂量依赖性,在400 μg/mL时作用最强,为空白组的3~4 倍;在50~100 μg/mL质量浓度范围内,DGP 组、DGPA 组协同LPS作用于小鼠脾淋巴细胞时,细胞增殖能力低于LPS 组(P<0.05),表明两者均能抑制LPS 诱导B 淋巴细胞增殖;在200~400 μg/mL 质量浓度范围内,细胞增殖能力高于LPS组(P<0.01),表明两者促进LPS 诱导B 淋巴细胞增殖,并且在相同质量浓度下DGPA 组作用更优。
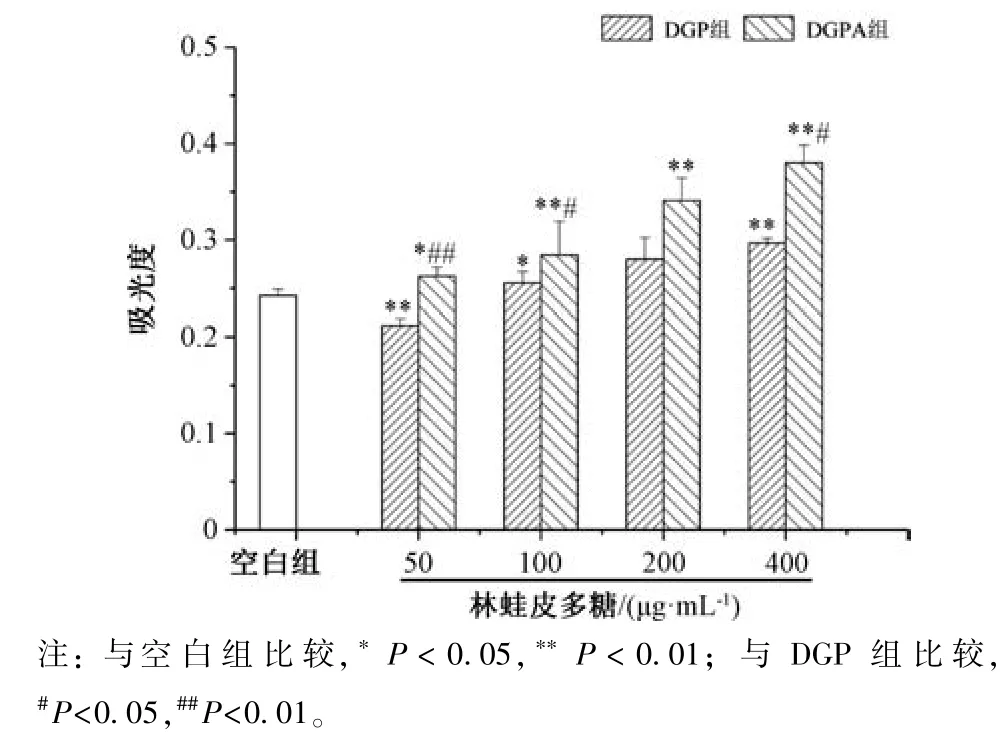
图5 多糖对小鼠脾淋巴细胞增殖的影响(,n=10)
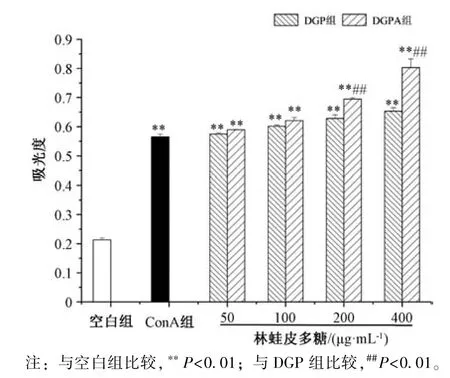
图6 多糖对ConA 诱导小鼠脾淋巴细胞增殖的影响(,n=10)
3.6 多糖对小鼠腹腔巨噬细胞吞噬功能的影响 巨噬细胞的主要功能是吞噬病原体等异物[13]。图8 显示,与空白组比较,DGPA 组小鼠巨噬细胞吞噬功能增强(P<0.05,P<0.01),并呈剂量依赖性;当质量浓度为400 μg/mL时,DGP 组、DGPA 组均能增强小鼠巨噬细胞吞噬功能,效果分别为空白组的1.25、2 倍。
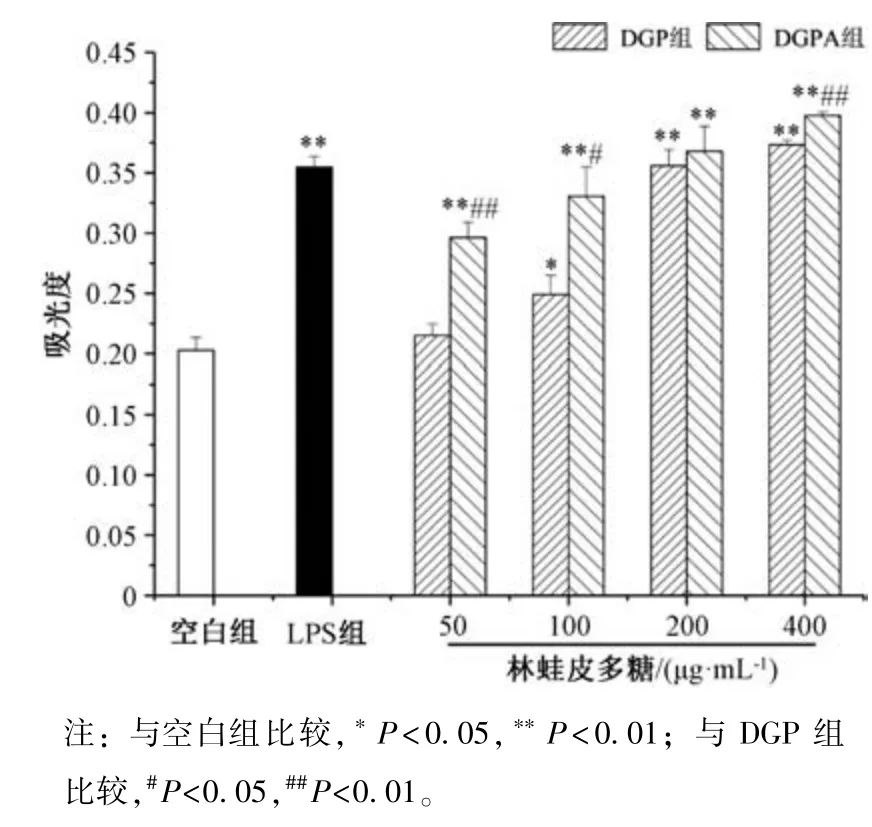
图7 多糖对LPS 诱导小鼠脾淋巴细胞增殖的影响(,n=10)
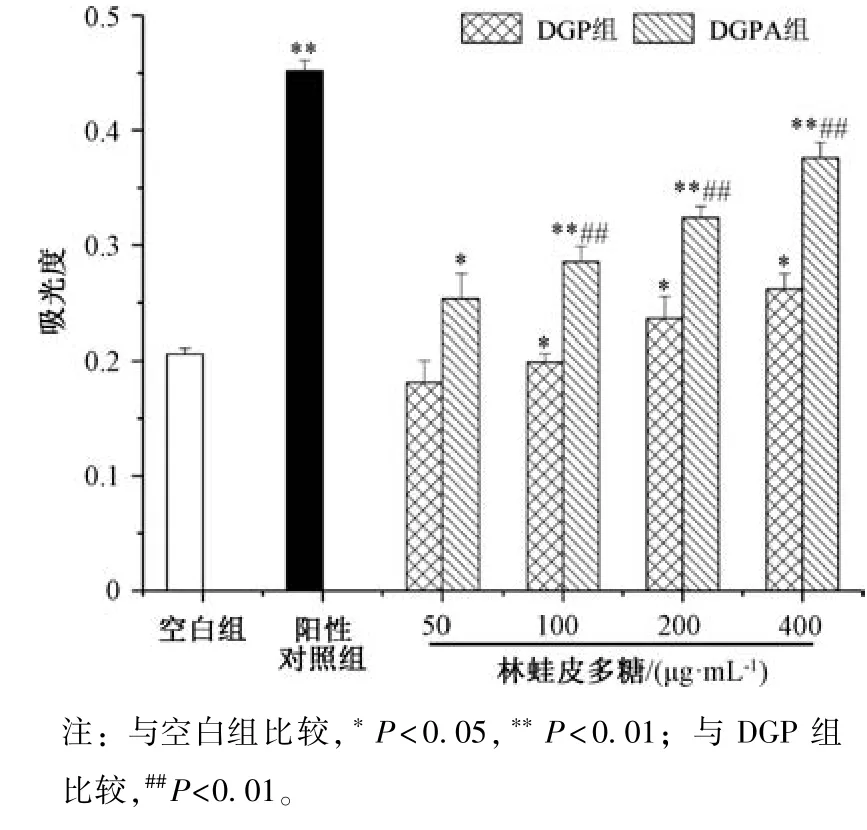
图8 多糖对小鼠腹腔巨噬细胞吞噬功能的影响(,n=10)
3.7 多糖对小鼠腹腔巨噬细胞NO 水平的影响 图9 显示,与空白组比较,DGPA 组小鼠巨噬细胞NO 水平升高(P<0.05,P<0.01),并呈剂量依赖性;当质量浓度为400 μg/mL时,DGP 组、DGPA 组均能增强小鼠巨噬细胞产生NO 的能力,效果分别为空白组的3、5 倍。
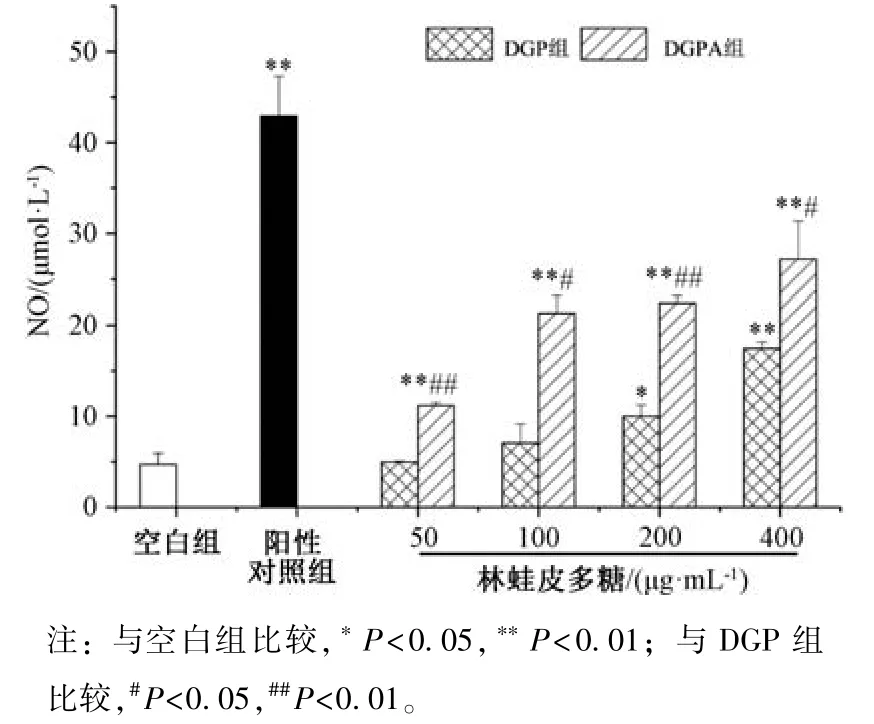
图9 多糖对小鼠腹腔巨噬细胞NO 水平的影响(,n=10)
3.8 多糖对小鼠巨噬细胞TNF⁃α 水平的影响 图10 显示,在100~400 μg/mL 质量浓度范围内,DGPA 组能增强小鼠巨噬细胞分泌细胞因子TNF⁃α 能力(P<0.05,P<0.01),并呈剂量依赖性;当质量浓度大于100 μg/mL时,DGPA组增强小鼠巨噬细胞分泌TNF⁃α 的能力大于DGP 组(P<0.05)。
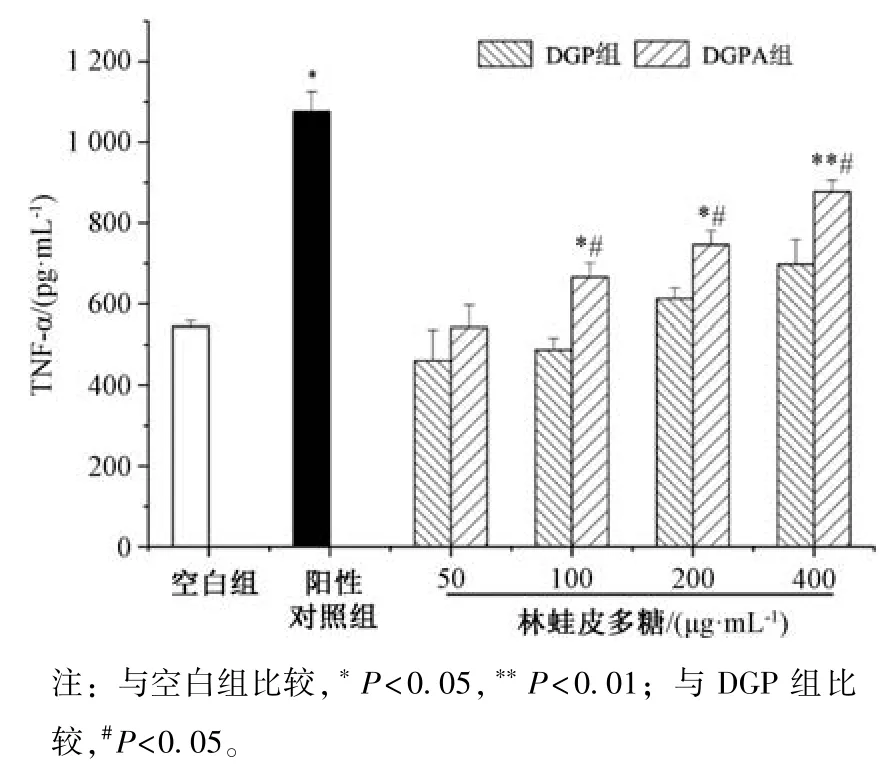
图10 多糖对小鼠腹腔巨噬细胞TNF⁃α 水平的影响(,n=10)
4 讨论
通过对分子量、单糖组成、特殊基团的研究,确定了DGPA 为糖胺聚糖类化合物。已有研究表明,糖胺聚糖类化合物等具有显著的免疫调节作用,其功能与结构密切相关[14],杨洁[15]发现仿刺参糖胺聚糖能促进DC 细胞的增殖和细胞因子IL⁃12、TNF⁃α 的分泌。多种糖胺聚糖,例如仿刺参糖胺聚糖[12]、菲律宾蛤仔糖胺聚糖[16]、珠贝母糖胺聚糖[17]、近江牡蛎糖胺聚糖[14]等均被证明具有显著的有免疫活性。本研究发现,林蛙皮糖胺聚糖具有显著的免疫调节作用,且纯化后的林蛙皮多糖DGPA 对淋巴细胞和巨噬细胞的激活作用明显优于粗多糖DGP,而这2 种多糖的单糖组成存在一定差异,尤其是纯化后多糖DGPA 的氨基半乳糖和葡萄糖醛酸的相对水平高于粗多糖DGP,而单糖组成是影响多糖活性的重要因素。因此,林蛙皮多糖DGPA 组与DGP 组的免疫活性差异可能与其单糖组成的差异有关,具体影响机制有待进一步研究。
