尿酸对果蝇生长发育及寿命等的影响及机制*
2022-12-03兰榕榆白雪王景涛尹相林王嘉淇张睿迪秦思宇关宝生邱洪斌
兰榕榆,白雪,王景涛,尹相林,3,王嘉淇,3,张睿迪,秦思宇,关宝生,3△,邱洪斌,3△
(1佳木斯大学公共卫生学院,黑龙江 佳木斯 154007;2佳木斯大学基础医学院,黑龙江 佳木斯 154007;3黑龙江省痛风研究重点实验室,黑龙江 佳木 斯154007)
尿酸(uric Acid,UA)是人体内嘌呤代谢的终产物,当体内UA水平长时间超过正常生理浓度则会引起高尿酸血症(hyperuricemia,HUA),并有一定几率发展为痛风,从某种意义来讲痛风也可以看作是机体的持续高尿酸状态(或者也可称之为尿酸化状态)。UA在体内表现出促氧化和抗氧化的双重作用,在正常生理浓度时表现为显著的抗氧化活性,有助于维持机体健康[1]。然而,UA在较低或较高浓度时则表现为促氧化活性,这一过程可能与氧化应激和炎症的发生发展密切相关[2-5]。果蝇作为人类疾病研究的经典模式生物,体积小,生命周期相对较短,因此可以大量生产且易于使用。果蝇在器官和基因水平上与人类表现出高度的同源性,75%的人类疾病基因在果蝇中具有保守的同源物[6]。同时,果蝇体内具有尿酸代谢的相关途径。在果蝇体内,摄入的嘌呤在黄嘌呤氧化酶(xanthine oxidase,XOD)的作用下转变为UA,后者在尿酸氧化酶(urate oxidase,UOD)的作用下分解为尿囊素经马氏管排出体外,同时,部分UA存于真皮细胞内供机体正常代谢之需[7]。本研究通过构建果蝇的HUA模型,观察高嘌呤饮食对果蝇蛹化、羽化、攀爬能力、产卵量和寿命的影响,探讨高浓度UA降低果蝇寿命的可能机制,为深入研究UA的生理功能提供参考资料。
材料和方法
1 果蝇品系及饲养条件
w1118野生型黑腹果蝇(佳木斯大学)培养于标准的玉米粉培养基中,培养温度为(25.0±0.5)℃,湿度为(40.0±0.5)%、光照明暗周期为12 h[7-8]。
2 实验试剂
腺嘌呤购于北京索莱宝生物科技有限公司;酵母购于英联马利;ELISA试剂盒购于北京诚林生物科技有限公司。
3 实验分组
根据前期预实验,本次实验共设4个组别,分别为对照组、低浓度干预组、中浓度干预组和高浓度干预组[7]。对照组以标准培养基饲喂,各干预组培养基在标准培养基中分别加入1 g/L(低浓度干预组)、2 g/L(中浓度干预组)和3 g/L(高浓度干预组)的腺嘌呤,制备好的培养基统一装入果蝇管中备用,培养基厚度约1.0 cm。
4 实验方法
4.1 高尿酸血症果蝇模型的制备收集羽化后8 h内果蝇1 000只,雌雄各半,每组250只。雌雄果蝇各5管,每管25只,随机分为4个实验组,每3 d更换一次新鲜培养基。
4.2 成虫体内UA及其相关酶及氧化应激水平的检测每组雌雄果蝇各取1管培养7 d后(预实验确定0.3%嘌呤浓度干预下果蝇的平均寿命在7 d左右),将果蝇按重量(g):蒸馏水(mL)=1∶9的比例,用玻璃匀浆器制成组织匀浆,离心后取上清液,用ELISA试剂盒检测各实验组果蝇体内UA、UOD、XOD的水平,以及氧化应激相关指标丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、一氧化氮(nitrogen monoxide,NO)水平和总抗氧化能力(total antioxidant capacity,T-AOC)。
4.3 成虫的寿命实验每组雌雄果蝇各取4管,用于观察果蝇生存情况。每天定时记录果蝇死亡数量,直至果蝇全部死亡,计算果蝇的平均寿命。
4.4 成虫的产卵量实验挑选羽化后8 h内的果蝇,将一只雄性果蝇和一只雌性果蝇,加入不同组别的培养基中。在每对果蝇转移到新鲜食物上24 h后开始测定,每日下午17点定时清点,大约时间周期为成年后的前30 d。每种饮食和性别至少放置10对果蝇,再进行独立重复实验。
4.5成虫的攀爬能力实验收集羽化后8 h内雌雄果蝇各60只,随机分配至各组,每组15只,培养7 d后,在没有麻醉的情况下,将果蝇转移到干净的空管中,管口装有棉花塞,每管25只果蝇。待果蝇适应3 min后,轻轻地将其拍打到管底,待其自发向上攀爬。记录20 s内成功向上攀爬过5 cm刻度及以上的果蝇数量。实验重复3次计算平均值。
4.6 幼虫蛹化率和羽化率的检测取正常培养基培养的羽化后4~5 d的成虫按雌雄比5∶1的比例进行杂交,以琼脂培养基加少许酵母培养。12 h后收卵400只,随机分配至各组,每组100只,各组干预方式同前。重复实验3次,分别记录幼虫的蛹化和羽化情况,并计算蛹化率和羽化率。
5 统计学处理
采用SPSS 19.0软件进行统计分析,计量资料用均数±标准差(mean±SD)表示。羽化率和蛹化率的比较采用χ2检验,其余各实验组数据的比较采用单因素方差分析进行统计处理,两两比较采用SNK-q检验,以P<0.05为差异有统计学意义。
结 果
1 各实验组果蝇体内UA及相关酶水平的变化
随着培养基中腺嘌呤浓度的升高,雌雄果蝇体内UA、UOD和XOD水平逐渐升高,与对照组比较有显著差异(P<0.01)。在低浓度干预组与中浓度干预组中,雄果蝇的UA水平显著高于同组中雌果蝇(P<0.01);而在高浓度组中,雄果蝇的UA水平则显著低于雌果蝇(P<0.01)。见图1A。
在低浓度干预组与中浓度干预组中,同组中雄性和雌性果蝇体内的UOD水平无显著差异;高浓度干预组中雄果蝇体内的UOD水平显著低于同组中雌果蝇(P<0.05),见图1B。对照组中雄果蝇体内的XOD水平显著低于同组中雌果蝇(P<0.01);但在低浓度干预组中,同组中雄性和雌性果蝇体内的XOD水平无显著差异;在中浓度干预组中,雄果蝇体内的XOD水平显著低于雌果蝇(P<0.01);高浓度干预组中雄果蝇体内的XOD水平显著高于雌果蝇(P<0.01),见图1C。
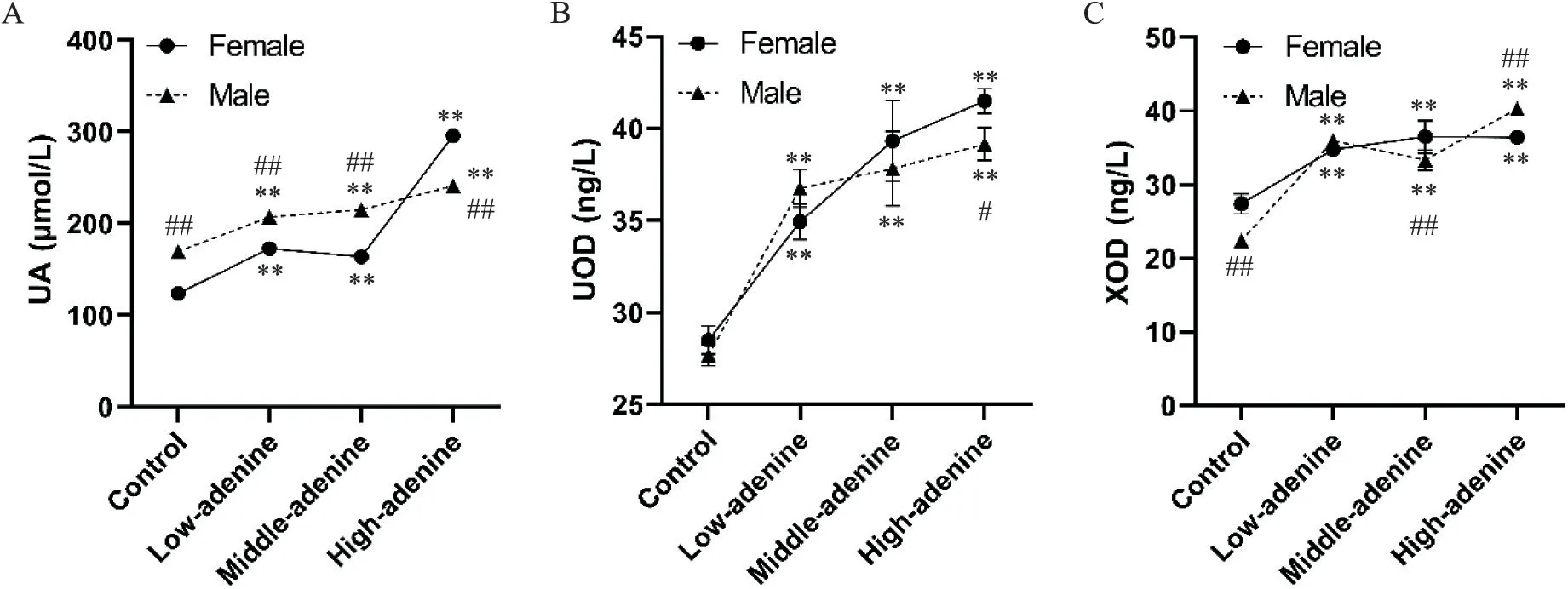
Figure 1.UA,XOD and UOD levels in female and male Drosophila.Mean±SD.n=25.**P<0.01 vs control group;#P<0.05,##P<0.01 vs female group.图1 各实验组雌、雄性果蝇体内UA、XOD和UOD的水平
2 尿酸对果蝇成虫平均寿命的影响
在确定果蝇体内UA水平随培养基中腺嘌呤浓度的升高而逐渐升高后,我们对不同UA水平果蝇成虫寿命的变化情况进行了研究。与对照组比较,各干预组果蝇平均寿命显著缩短(P<0.01)。在中浓度干预组和高浓度干预组中,雄果蝇的平均寿命显著低于同一干预组雌果蝇(P<0.01),见图2、3。
3 尿酸对果蝇成虫产卵量的影响
在确定UA水平增加会缩短果蝇成虫寿命之后,我们对不同UA水平果蝇产卵量的变化情况进行了研究。与对照组比较,中浓度干预组和高浓度干预组中果蝇的产卵量显著减少(P<0.01)。与低浓度干预组比较,中浓度干预组和高浓度干预组中果蝇的产卵量显著减少(P<0.01)。见表1。

表1 各实验组果蝇产卵量的变化情况Table 1.Eggs production of Drosophila in each group(Mean±SD.n=10)
4 尿酸对果蝇成虫攀爬能力的影响
除了对果蝇成虫的产卵量进行研究,我们还对不同UA水平果蝇攀爬能力的变化情况进行了研究。与对照组比较,中浓度干预组和高浓度干预组中雌性果蝇的攀爬能力显著降低(P<0.01)。与对照组比较,各干预组中雄性果蝇的攀爬能力显著降低(P<0.01)。对照组中雄果蝇的攀爬能力与雌果蝇无显著差异;但在低浓度干预组中,雄果蝇的攀爬能力显著低于雌果蝇(P<0.05);中浓度干预组中雄果蝇的攀爬能力与雌果蝇无显著差异;高浓度干预组中雄果蝇的攀爬能力显著低于雌果蝇(P<0.01)。见表2。
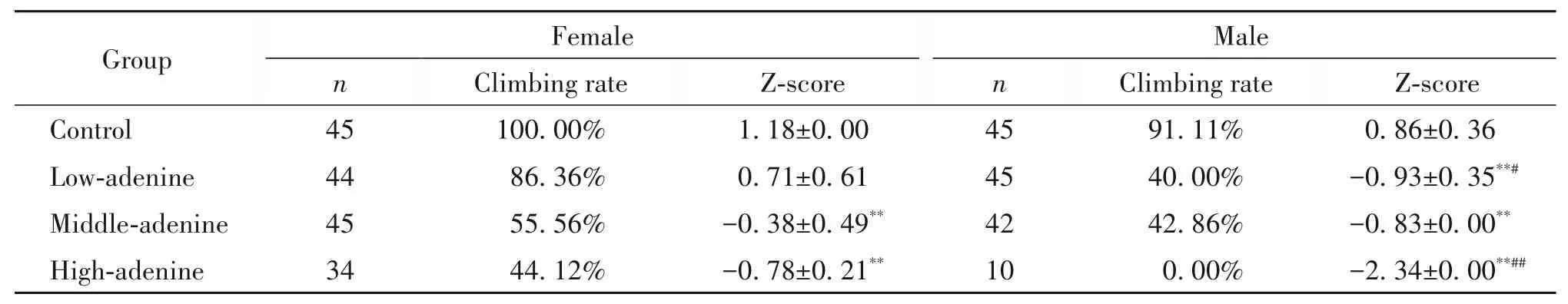
表2 各实验组雌、雄性果蝇的攀爬上线率及Z评分法标化数据表Table 2.Climbing rate and Z-score of Drosophila in each group(Mean±SD)
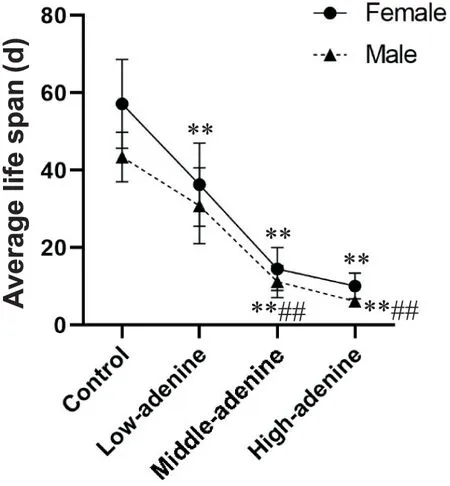
Figure 2.Average life span of female and male Drosophila in each group.Mean±SD.n=100.**P<0.01 vs control group;##P<0.01 vs female group.图2 各实验组雌、雄性果蝇的平均寿命
5 尿酸对果蝇幼虫蛹化率及羽化率的影响
另外,我们对经不同浓度腺嘌呤干预的果蝇所产卵的孵化情况进行了观察,深入研究了UA对果蝇幼虫蛹化和羽化的影响。结果显示,中浓度干预组与高浓度干预组中果蝇幼虫的蛹化率与羽化率均为0,低浓度干预组果蝇蛹化率和羽化率显著低于对照组(P<0.01)。见表3、4。

Figure 3.Survival analysis of female and male Drosophila in each group.n=100.图3 各实验组雌、雄性果蝇的生存分析
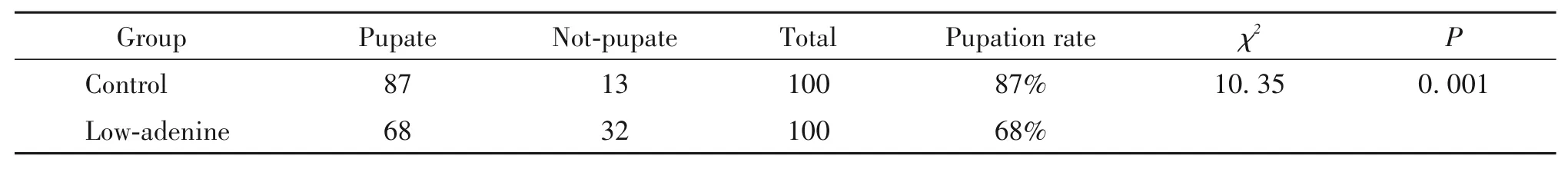
表3 各实验组果蝇幼虫蛹化率Table 3.The pupation rate of Drosophila larvae
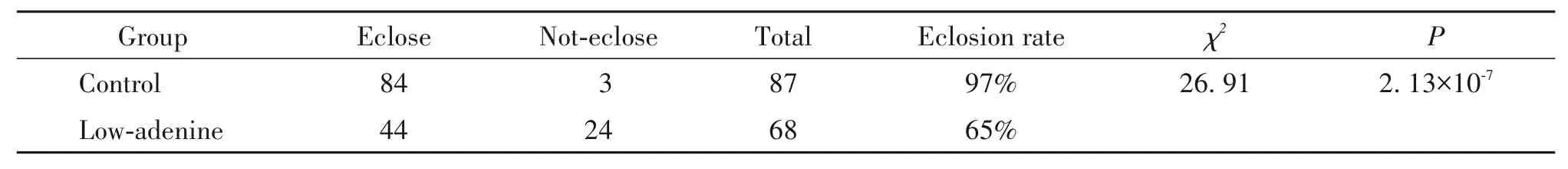
表4 各实验组果蝇幼虫羽化率Table 4.The eclosion rate of Drosophila larvae
6 尿酸对果蝇体内氧化应激相关指标的影响
在雌果蝇体内,在低浓度干预组与中浓度干预组MDA水平表现为随体内UA浓度的升高而升高,且显著高于对照组(P<0.01);而高浓度干预组MDA水平显著低于对照组(P<0.01)。各干预组SOD、CAT、GSH-Px及T-AOC水平显著高于对照组(P<0.01);其中,高浓度干预组SOD水平显著高于低浓度干预组,中浓度干预组与高浓度干预组CAT、GSHPx水平显著低于低浓度干预组,中浓度干预组与高浓度干预组T-AOC显著高于低浓度干预组(P<0.01)。各干预组NO水平显著低于对照组(P<0.01);其中,中浓度干预组与高浓度干预组NO水平显著低于低浓度干预组(P<0.01),见图4。
在雄果蝇体内,各干预组MDA水平显著高于对照组(P<0.01);但中浓度干预组与高浓度干预组MDA水平显著低于低浓度干预组(P<0.01)。各干预组SOD、CAT、GSH-Px及T-AOC水平显著高于对照组(P<0.01);其中,中浓度干预组与高浓度干预组SOD、GSH-Px、T-AOC水平显著高于低浓度干预组,中浓度干预组CAT水平显著低于低浓度干预组,而高浓度干预组CAT水平显著高于低浓度干预组(P<0.01)。各干预组NO水平显著低于对照组(P<0.01);其中,中浓度干预组与高浓度干预组NO水平显著低于低浓度干预组(P<0.01)。见图4。
讨 论
HUA的发病率逐年上升,同时伴随着慢性肾脏病、心脑血管疾病和代谢性疾病的发生[9-10]。相关调查显示,我国HUA的发病日趋年轻化、低龄化[11-12]。目前,HUA的发病机制尚不明确,有研究显示HUA与氧化应激密切相关[13-16]。本研究着重探讨了机体在高UA状态下氧化-抗氧化系统的变化,机体在高UA状态下能够产生大量氧自由基,从而降低机体抗氧化能力,导致组织细胞损伤,而氧自由基抑制剂能阻止这一进程的发生[17]。
本研究通过高嘌呤饮食构建果蝇的HUA模型,结果显示随培养基中腺嘌呤浓度的升高,果蝇成虫体内UA、UOD、XOD水平均显著升高,提示果蝇的HUA模型构建成功。另外,课题组注意到不同性别果蝇体内UA、UOD、XOD的变化也不一样,同组雌、雄果蝇体内上述指标存在显著差异,提示雌果蝇与雄果蝇相比可能存在某种机制能减少UA的积累,降低高嘌呤饮食导致的机体的损伤作用。正常情况下女性的血清尿酸(serum uric acid,SUA)水平显著低于同龄男性,且女性的SUA水平在绝经后往往会显著增加[18]。此外,许多针对绝经后妇女或男女跨性别者的研究表明,雌激素治疗可显著降低SUA水平[19-20]。女性对男性跨性别患者的男性化激素治疗可抑制雌二醇水平,并可能提高SUA水平[21]。雌激素诱导的尿酸盐肾清除率增加被认为是SUA水平性别差异的一种机制[22]。Liu等[23]研究显示,肾小管上皮细胞雌激素受体β低表达可能导致绝经前系统性红斑狼疮患者患HUA。综上所述,有理由认为,雌果蝇相较于雄果蝇对于高UA较强的抵抗能力,其机制可能与雌果蝇拥有更高的雌激素水平密切相关。
课题组通过上述模型,对高浓度UA影响果蝇成虫的寿命、产卵量、攀爬能力以及果蝇幼虫蛹化和羽化的情况进行了观察。随着SUA水平的不断提高,果蝇的平均寿命显著缩短,且这种寿命缩短的情况在雄果蝇群体中表现更加显著。然而,中浓度组果蝇体内UA与低浓度组并没有差别,但是寿命差异显著,可能是由于UA等指标的检测仅在果蝇进行了7 d的嘌呤干预,而寿命的指标的检测则对果蝇进行了终生的相应腺嘌呤浓度的长期干预,从而产生长期的蓄积作用导致中浓度组与低浓度组的寿命差异显著。
随着SUA水平的不断提高,果蝇的产卵量也受到了影响,中、高浓度干预组的产卵量显著下降。其原因可能有三:(1)生活史理论的关键原则之一是繁殖和生存是相互联系的,并且它们相互权衡[24]。高浓度UA的饮食不适合果蝇生存,雌性在恶劣条件下,保存自己的卵子,战略性地减少了对生殖的投资,有利于维持体细胞以度过饥饿期,直到资源再次变得充足。而且,大部分生物都倾向于将下一代产在优质的食物中。(2)果蝇体内UA增加提高了其氧化应激程度,雌性果蝇的生殖能力减弱。(3)雄性果蝇体内UA增加可能导致精子活力减弱[25]。
果蝇的攀爬能力也随着SUA的提高而降低,在雄性果蝇中下降更为显著。探究其原因,可能有二:(1)HUA导致的尿酸盐晶体沉积在果蝇的关节处抑制运动;(2)HUA刺激机体产生炎症反应,引起疼痛抑制了果蝇运动。与雌性果蝇相比,果蝇体内UA浓度增加对雄性果蝇攀爬能力的影响更大,可能是由于雌性果蝇的雌激素水平更高,导致其对于体内UA增加造成的不利影响有更强的抗性。
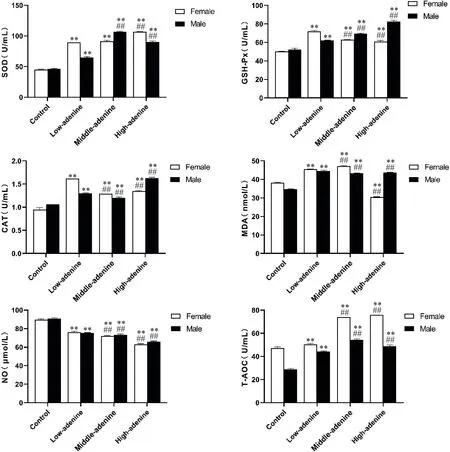
Figure 4.The changes of oxidative stress indexes of female and male Drosophila in each group.Mean±SD.n=25.**P<0.01 vs control group;##P<0.01 vs low-adenine group.图4 各实验组雌、雄果蝇氧化应激相关指标的变化情况
各干预组果蝇产卵后其蛹化率和羽化率的变化也较大,在低浓度干预组中果蝇卵的蛹化率和羽化率分别为68%和65%,中浓度干预组与高浓度干预组中果蝇卵的蛹化率与羽化率均为0,显著低于对照组。根据成虫的寿命等一系列观察指标可以说明实验组浓度选择的合理性,然而果蝇幼虫在中、高浓度干预组中的极低蛹化、羽化率可能是由于与成虫相比,幼虫或许对于高浓度UA的适应性更差。课题组将针对果蝇幼虫进一步优化UA的干预浓度,为后期开展UA的遗传效应研究奠定基础。
UA的促氧化能力可能在果蝇的上述变化中起到关键作用。对果蝇体内氧化应激的相关指标进行检测,结果显示果蝇体内的NO含量随着其体内UA水平的升高显著降低,这可能与机体UA水平升高导致体内超氧阴离子自由基(O2-)增加有关[26-27],O2-可以直接和NO相互作用,增加过氧亚硝基阴离子(ONOO-)的形成[16],其中ONOO-作为一种较强的氧化剂,造成内皮型一氧化氮合酶解偶联,同时增强血管内皮细胞中NADPH氧化酶活性,抑制NO的生成与释放,最终导致了体内氧化水平与抗氧化水平失衡,加重氧化应激损伤[28-30]。当培养基中腺嘌呤浓度在0.2%及以下时,雌雄果蝇体内的MDA水平逐渐升高,提示其体内自由基生成增多,进而加重机体的氧化损伤程度。但随着果蝇机体UA浓度的进一步升高,雌果蝇体内的MDA水平与对照组比显著降低。MDA作为自由基脂质过氧化的醛类产物,其含量能反映体内自由基的多少,从而间接推断自由基对机体的损伤程度,我们的结果提示雌果蝇尚能代偿这一浓度UA对机体的影响,笔者认为可能与雌果蝇体内的雌激素有关。另外,课题组对果蝇体内总抗氧化能力这一评价机体抗氧化系统的综合性指标[31],以及SOD、GSH-Px、CAT共同组成的抗氧化酶系统进行了实验观察。结果显示,各干预组果蝇体内SOD、CAT、GSH-Px及T-AOC水平随着体内UA水平的升高而升高,且显著高于对照组。研究结果提示,随着果蝇体内UA水平的升高,其体内自由基的生成不断增加,导致果蝇体内的氧化-抗氧化系统失衡,最终表现为对果蝇寿命的抑制,也进一步明确了氧化应激在代谢紊乱和衰老中的重要作用[32-34]。
综上所述,本研究进一步揭示了高尿酸血症与氧化应激的关系,为临床更好的治疗和预防高尿酸血症提供了参考资料。另外,也进一步证明在临床上对痛风和高尿酸血症患者进行尿酸达标治疗是非常必要的,可以在一定程度上减轻体内氧自由基的蓄积,避免氧化损伤、以及其他代谢性疾病、心血管疾病的发生和发展[29,35-36]。
