双黄连注射液指纹峰归属及制剂⁃中间体⁃药材相关性研究
2022-12-03穆琦瑄高胜美朱美娟王毅王跃飞杨静
穆琦瑄 高胜美 朱美娟王毅 王跃飞杨静∗
(1.天津中医药大学中医药研究院, 天津市中药化学与分析重点实验室, 天津301617; 2.浙江大学,浙江 杭州310058)
中药注射剂作为一种特殊剂型,化学成分复杂。构建符合中药注射液临床应用特点的质量控制方法,特别是控制中药注射液批间一致性,一直是研究者普遍关注的问题[1⁃2]。中药指纹图谱方法是控制中药注射液批间一致性的有效方法,能解决中药多成分质量控制问题[3⁃4],实现对中药多成分定性、半定量的表征[5]。双黄连注射液是由金银花、连翘、黄芩经一系列提取纯化工艺制备而成。目前,通过高效液相色谱法建立指纹图谱并得到10 个特征峰[6];并在此基础上,探究黄芩苷、芦丁、绿原酸的致敏性[7⁃8]。通过建立气相色谱指纹图谱测定挥发性成分并探究其化学成分相关性[9]。通过液质联用法探讨双黄连注射液与药材之间化学成分的相关性[10]。
本研究基于HPLC 指纹图谱分析,通过对照品比对鉴定得到11 个指纹峰和2 个非指纹峰。针对指纹图谱中未知指纹峰,以金银花连翘中间体为原料,纯化目标化合物并鉴定为连翘酯苷H,并开展双黄连注射液中指纹峰的归属研究及双黄连注射液、中间体、药材化学成分的相关性分析,以期为研究化学成分的传递规律以及完善双黄连注射液的质量评价体系提供依据。
1 材料
1.1 仪器 Waters e2695 型高效液相色谱仪(美国Waters公司);ME204 型万分之一天平、MS105DU 型十万分之一天平(瑞士梅特勒⁃托利多公司);Milli⁃Q 超纯水仪(美国Millipore 公司);FW80 型粉碎机(天津市泰斯特仪器有限公司);HYC⁃940 型医用冷藏箱(4 ℃)(青岛海尔特种电器有限公司);Centrifuge 5424R 型台式离心机(德国Eppendorf 公司);Agilent 1200 制备液相色谱仪(美国Agilent 公司);核磁共振波谱仪(瑞士Bruker 公司)。
1.2 试剂与药物 绿原酸(批号110753⁃201817,纯度>96.80%)、咖啡酸(批号110885⁃201703,纯度>99.70%)、连翘酯苷A(批号111810⁃201707,纯度>97.20%)、黄芩苷(批号110715⁃201821,纯度>95.40%)、黄芩素(批号111595⁃201808,纯度>97.90%)对照品均购自中国食品药品检定研究院;新绿原酸(批号P27A10L87091)、隐绿原酸(批号 P30A9L69104)、异连翘酯苷 A(批号Y14M6H1)、金丝桃苷(批号Y20J7X9353)、异绿原酸C(批号P25J9L66496)、千层纸素A⁃7⁃O⁃β⁃D⁃葡萄糖醛酸苷(批号Y19D5J1)、白杨素⁃7⁃O⁃β⁃D⁃葡萄糖醛酸苷(批号Y06S10H97162)对照品均购自上海源叶生物科技有限公司,纯度均大于98%。氘代二甲基亚砜(DMSO⁃d6),购自美国CIL 公司;D101 型大孔吸附树脂,购自天津市光复精细化工研究所。色谱纯甲醇、乙腈,购自美国Sigma⁃Aldrich 公司;分析纯甲醇、乙腈,购自天津市康科德科技有限公司;色谱纯冰乙酸,购自上海阿拉丁生化科技股份有限公司;水为超纯水,实验室自制。
双黄连注射液,金银花连翘中间体、黄芩中间体,金银花、连翘、黄芩均由河南福森药业有限公司提供。金银花、连翘、黄芩由河南福森药业有限公司质量控制部检验人员杨先玉鉴定为正品,样品保存于天津中医药大学中医药研究院。2018 年至2019 年生产的20 批双黄连注射液编号为S1~S20,金银花连翘中间体编号为Z1~Z10(Z1、Z2、Z6 为粉末,其他批次为浸膏)、黄芩中间体(粉末)编号为P1~P10,金银花、连翘、黄芩编号分别为J1~J5、L1~L5、H1~H5。
2 方法
2.1 双黄连注射液指纹图谱建立
2.1.1 色谱条件 YMC⁃Pack ODS⁃A 色谱柱(4.6 mm×150 mm,5 μm);流动相甲醇(A)⁃0.25% 冰乙酸(B),梯度洗脱(0~15 min,15%~35% A;15~20 min,35% A;20~50 min,35%~100% A);体积流量1 mL/min;柱温30 ℃;检测波长350 nm;进样量10 μL。
2.1.2 供试品溶液制备
2.1.2.1 双黄连注射液 精密吸取双黄连注射液2 mL,置于10 mL 量瓶中,加入50%甲醇混匀、定容,即得。
2.1.2.2 中间体 精密称取金银花连翘中间体适量粉末0.25 g(浸膏约0.40 g),分别置于10 mL 量瓶中,加入50%甲醇至刻度,溶解,摇匀,12 000 r/min 离心10 min,精密吸取上清液1 mL,置于5 mL 量瓶中,加50%甲醇混匀、定容,即得。
精密称取黄芩中间体粉末0.1 g,置于10 mL 量瓶中,加入 2 mL DMSO 助溶,再加入甲醇混 匀、定容,12 000 r/min离心10 min,精密吸取上清液1 mL,置于5 mL量瓶中,加入50%甲醇混匀、定容,即得。
2.1.2.3 药材 精密称取金银花、连翘、黄芩药材粉末各0.2 g,分别置于100 mL 圆底烧瓶中,加入50 mL 超纯水浸渍30 min,加热回流提取2次,每次1 h,放冷,滤过,合并滤液,摇匀,12 000 r/min 离心10 min,精密吸取各1 mL上清液,加入50%甲醇1 mL,摇匀,即得。
2.1.3 对照品溶液制备 新绿原酸、绿原酸、隐绿原酸、咖啡酸、异绿原酸C 对照品采用10%甲醇溶解;异连翘酯苷A 对照品采用30%甲醇溶解;连翘酯苷A、金丝桃苷对照品采用50% 甲醇溶解;白杨素⁃7⁃O⁃β⁃D⁃葡萄糖醛酸苷、千层纸素A⁃7⁃O⁃β⁃D⁃葡萄糖醛酸、黄芩素、黄芩苷对照品采用甲醇溶解,制成含新绿原酸32.77 μg/mL、绿原酸43.00 μg/mL、隐绿原酸37.73 μg/mL、咖啡酸6.050 μg/mL、异连翘酯苷A 74.66 μg/mL、连翘酯苷A 77.40 μg/mL、金丝桃苷1.659 μg/mL、异绿原酸C 16.83 μg/mL、白杨素⁃7⁃O⁃β⁃D⁃葡萄糖醛酸苷22.04 μg/mL、千层纸素A⁃7⁃O⁃β⁃D⁃葡萄糖醛酸苷56.00 μg/mL、黄芩素10.12 μg/mL、黄芩苷120.0 μg/mL 的溶液,即得。
2.1.4 双黄连注射液指纹图谱生成 采用双黄连注射液质量标准(WS3⁃B⁃2014⁃96)中指纹图谱研究方法,开展双黄连注射液的指纹峰归属及注射液⁃中间体⁃原料药材的相关性研究。
2.2 指纹峰的富集和鉴定
2.2.1 大孔树脂富集条件 取金银花连翘中间体浸膏80 g,加水溶解得到溶液,上样于处理好的D101 型大孔吸附树脂柱(2 kg),依次用水、5%乙醇、7%乙醇、10%乙醇、13% 乙醇、15% 乙醇、20% 乙醇、乙醇洗脱,并采用HPLC 示踪分析未知指纹峰化合物,收集13%、15%乙醇洗脱液,减压浓缩,得浓缩液100 mL。
2.2.2 制备液相色谱条件 一次制备条件为ZORBAX SB⁃C18色谱 柱(21.2 mm× 250 mm,7 μm);流动相甲醇(A)⁃水(B),梯度洗脱(0~30 min,30%~70% A);体积流量10 mL/min;进样量0.6 mL(13%、15% 乙醇洗脱浓缩液用甲醇1∶1 稀释)。二次制备条件为ZORBAX SB⁃C18色谱柱(21.2 mm×250 mm,7 μm);流动相甲醇⁃水(38∶62);体积流量10 mL/min;进样量1 mL(一次制备目标流分的浓缩液)。
3 结果
3.1 双黄连注射液指纹图谱色谱峰的归属 按“2.1.2”项下方法分别制备双黄连注射液、中间体、药材供试品溶液,按“2.1.3”项下方法制备对照品溶液,在“2.1.1”项色谱条件下进样测定,发现在40 min 内色谱峰基本洗脱完全,色谱图见图1。
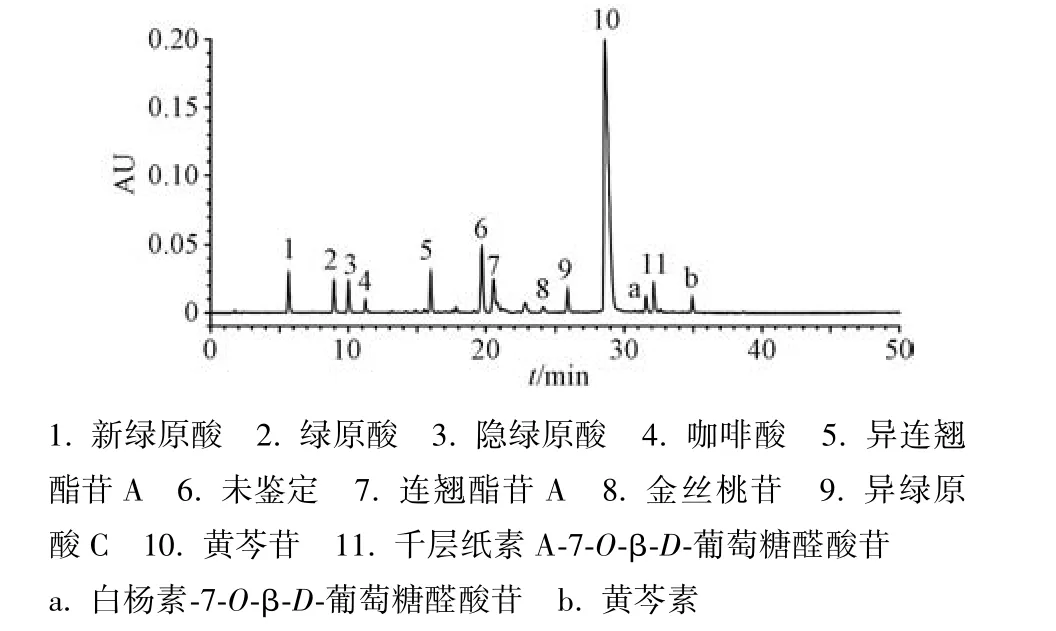
图1 双黄连注射液HPLC 色谱图
结合化合物的保留时间和光谱数据,通过对照品比对开展双黄连注射液指纹峰的归属研究,共鉴定得到12 个化合物。在双黄连注射液、金银花连翘中间体、金银花供试品溶液中均检测到新绿原酸、绿原酸、隐绿原酸、异绿原酸C,归属于金银花;在双黄连注射液、金银花连翘中间体、连翘供试品溶液均检测到异连翘酯苷A、6 号峰(未鉴定)、连翘酯苷A,归属于连翘;在双黄连注射液,金银花连翘中间体,金银花、连翘供试品溶液均检测到咖啡酸、金丝桃苷,归属于金银花、连翘;在双黄连注射液、黄芩中间体、黄芩药材中均检测到黄芩苷、千层纸素A⁃7⁃O⁃β⁃D⁃葡萄糖醛酸苷、白杨素⁃7⁃O⁃β⁃D⁃葡萄糖醛酸苷、黄芩素,为黄芩的特征化合物,归属于黄芩。
3.2 双黄连注射液、中间体、药材中化合物的相关性分析 通过检测10 批双黄连注射液,10 批金银花连翘中间体,10 批黄芩中间体,各5 批金银花、连翘、黄芩药材HPLC 色谱图发现,双黄连注射液、中间体、药材指纹峰的相关性良好,药材中主要成分均在中间体及双黄连注射液中体现,中间体与双黄连注射液的指纹峰在药材中也可追溯,见图2。
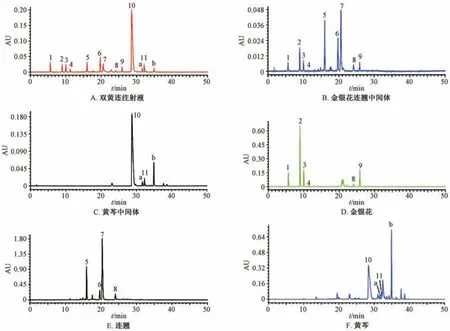
图2 双黄连注射液、中间体、药材HPLC 色谱图
3.3 未知指纹峰的结构解析 按“2.2.1”项下方法富集包含未知指纹峰化合物的目标流分,按“2.2.2”项下方法纯化目标化合物,在“2.1.1”项色谱条件下确认目标化合物,见图3。
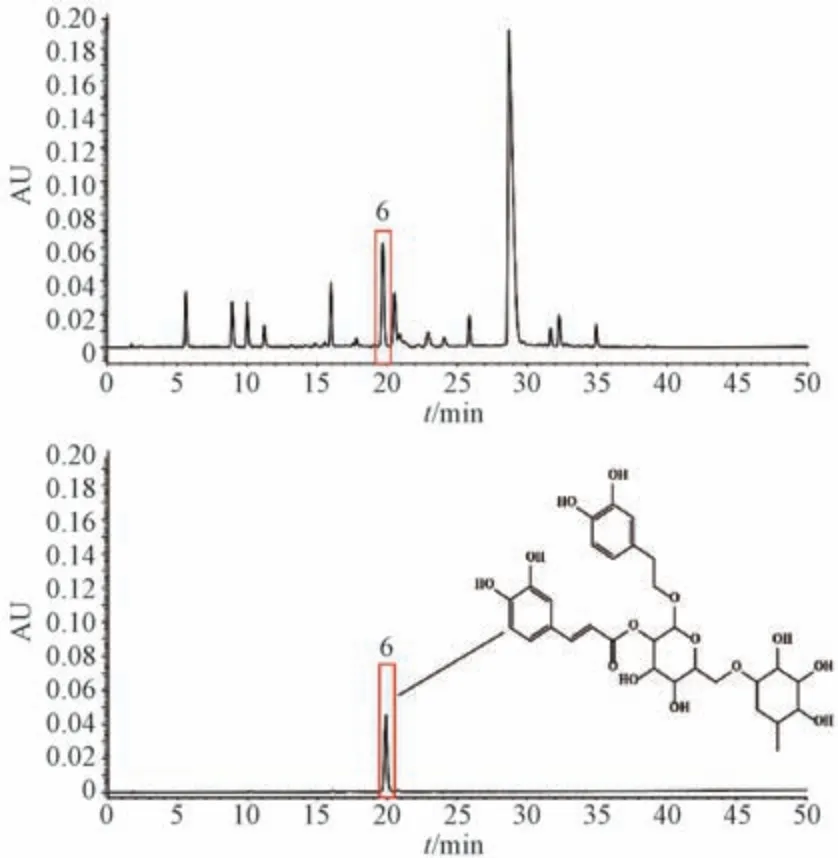
图3 6 号峰化合物色谱图及其结构
黄绿色粉末(二甲基亚砜),ESI⁃MSm/z:647 [M+Na]+。1H⁃NMR(DMSO⁃d6,600 MHz)δ:6.54(1H,brs,H⁃2),6.40(1H,dd,J=7.8,1.8 Hz,H⁃6),2.56(1H,m,H⁃7),3.75(1H,m,H⁃8),4.49(1H,d,J=7.8 Hz,H⁃1′),3.84(1H,d,J=10.8 Hz,H⁃6′),4.60(1H,brs,H⁃1″),7.06(1H,brs,H⁃2‴),6.76(1H,d,J=8.4 Hz,H⁃5‴),7.01(1H,d,J=7.8 Hz,H⁃6‴),7.48(1H,d,J=16.2 Hz,H⁃7‴),6.27(1H,d,J=16.2 Hz,H⁃8‴);13C⁃NMR(DMSO,150 MHz)δ:129.1(C⁃1),115.4(C⁃2),144.9(C⁃3),143.5(C⁃4),116.2(C⁃5),119.6(C⁃6),35.1(C⁃7),69.8(C⁃8),100.2(C⁃1′),73.4(C⁃2′),74.1(C⁃3′),70.7(C⁃4′),75.5(C⁃5′),66.6(C⁃6′),100.7(C⁃1″),70.5(C⁃2″),70.3(C⁃3″),72.0(C⁃4″),68.4(C⁃5″),18.0(C⁃6″),125.5(C⁃1‴),114.8(C⁃2‴),145.6(C⁃3‴),148.5(C⁃4‴),115.8(C⁃5‴),121.3(C⁃6‴),145.2(C⁃7‴),114.2(C⁃8‴),165.7(C⁃9‴)。以上数据与文献[11⁃12] 报道基本一致,故鉴定为连翘酯苷H。
4 讨论
4.1 双黄连注射液中化学成分的归属研究 由图4 可知,通过对双黄连注射液指纹峰归属研究表明,第Ⅰ部分是以有机酸类成分为主的金银花特征区,主要成分为绿原酸、新绿原酸、隐绿原酸、咖啡酸,其中绿原酸的相对含量较高,以绿原酸为参照,新绿原酸、隐绿原酸在金银花药材、金银花连翘中间体、双黄连注射液中的相对比值依次降低;第Ⅱ部分主要为苯乙醇苷类成分为主的连翘特征区,包括异连翘酯苷A、连翘酯苷A、连翘酯苷H;第Ⅲ部分主要为黄芩中的黄酮类化合物,包括黄芩苷、千层纸素A⁃7⁃O⁃β⁃D⁃葡萄糖醛酸苷、白杨素⁃7⁃O⁃β⁃D⁃葡萄糖醛酸苷、黄芩素。
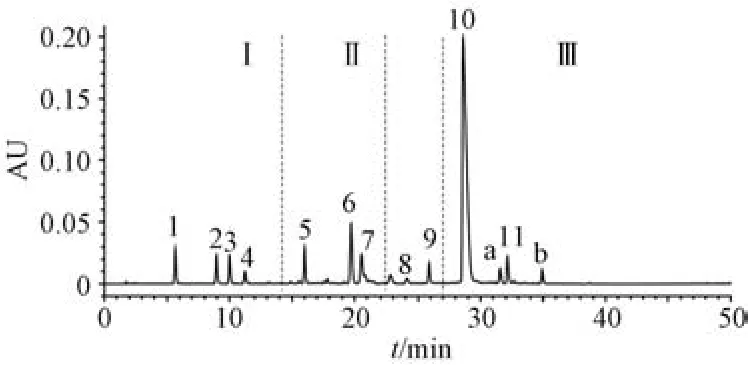
图4 双黄连注射液指纹图谱
4.2 连翘酯苷H 制备液相色谱条件优化 聚焦金银花连翘中间体中连翘酯苷H 的分离制备,以HPLC 法为示踪分析方法,采用大孔树脂优化筛选洗脱溶剂,富集目标化合物,系统考察制备液相的流动相洗脱系统(甲醇⁃水、乙腈⁃水、甲醇⁃0.1%甲酸、乙腈⁃0.1% 甲酸),综合考虑分离效果以及浓缩过程中可能发生的酸水解等问题,最终确定选用甲醇⁃水为流动相洗脱系统,通过流动相洗脱条件进一步优化分离得到连翘酯苷H。
本实验对药材、中间体、双黄连注射液指纹图谱进行系统研究,阐明双黄连注射液中化学成分的归属并鉴定得到11 个指纹峰以及2 个非指纹峰,双黄连注射液指纹图谱在不同批次注射液中具有良好的批间一致性,证明制剂⁃中间体⁃药材化学成分具有良好的相关性和质量传递性,为双黄连注射液的质量控制以及化学成分溯源提供依据。
