大黄蒽醌类有效成分抗肿瘤作用研究进展
2022-12-03陈祎凡皮佩仙李继蕾汪秋颖乐佳美
陈祎凡 皮佩仙 李继蕾 汪秋颖 乐佳美
(上海健康医学院药学院, 上海201318)
目前,恶性肿瘤的病例和死亡人数迅速上升,这对人类健康造成了极大的威胁[1]。过去十年中,手术治疗、免疫治疗、放化疗等主要癌症治疗方法有了明显进步[2],然而,由于术后易复发和转移率极高,恶性肿瘤的治疗结果仍然不佳。因此,如何安全有效地治疗恶性肿瘤一直是该领域研究的热点问题。
A:力嘉投资建立的潮阳力嘉中学在2012年7月11日举行落成庆典并交付使用。从最初投资的4000万元开始,至今已经投入了7000万元,全校共2600人,每个班平均都在60人以上,且学校的规模还在不断扩大。
随着中医药研究的不断深入,许多药用植物因其良好的疗效和安全性可作为治疗癌症的代替物。现代中医学认为恶性肿瘤病机可归纳为气滞血瘀、热毒内蕴、气血亏虚和经络瘀阻[3]。大黄作为药用植物最早出现在汉代的《神农本草经》中[4],传统医学认为其具有泻下攻积、清热泻火、凉血解毒、逐瘀通经的功效[5]。大黄因具有清热解毒的功效能从热毒内蕴这个病机有效地治疗癌症。现代医学研究发现大黄具有抗肿瘤[6]、调节肠胃菌群[7]、保护肠黏膜屏障[8]、抗炎、抑制肺纤维化[9]等药理活性,并且含有蒽醌类、蒽酮类、多糖类及鞣质类等多种有效成分[10]。大量体内外实验证明,大黄提取物蒽醌类化合物具有良好的抗癌潜力。本文就近几年来大黄蒽醌类有效成分及其抗肿瘤作用机制的研究进展进行综述,旨在为大黄进一步开发和临床应用提供更多的理论依据。
1 大黄蒽醌类有效成分
蒽醌类是目前大黄中研究最多的活性成分,同时也是大黄中的主要活性成分(含量为3%~5%),在不同来源药材及不同饮片中含量有所不同[11]。大黄中的蒽醌类物质主要是羟基分布于两侧苯环上的大黄素型蒽醌[12]。蒽醌(C14H8O2)母核被羟基、羟甲基、甲氧基、羧基取代则形成一系列蒽醌衍生物(蒽酮类、蒽醌类),蒽醌衍生物则是大黄的主要特征成分之一,并且在大黄中常以游离的形式或与糖结合成蒽醌苷存在[13]。按照母核结构大黄蒽醌类化合物可分为单蒽核类、双蒽核类,基本骨架及取代基见图1。蒽醌衍生物又可分为游离蒽醌类和结合蒽醌类,游离型蒽醌主要有大黄素、大黄酸、大黄酚、芦荟大黄素、大黄素甲醚等,结合型蒽醌以和葡萄糖结合状态为多,主要为葡萄糖苷(大黄素⁃8⁃O⁃β⁃D⁃葡萄糖苷、大黄酚⁃1⁃O⁃β⁃D⁃葡萄糖苷、大黄酸二葡萄糖苷、芦荟大黄素⁃1⁃O⁃β⁃D⁃葡萄糖苷等)或双蒽酮苷(番泻苷A~D 等)。常见蒽醌类化合物名称及分子式见表1。
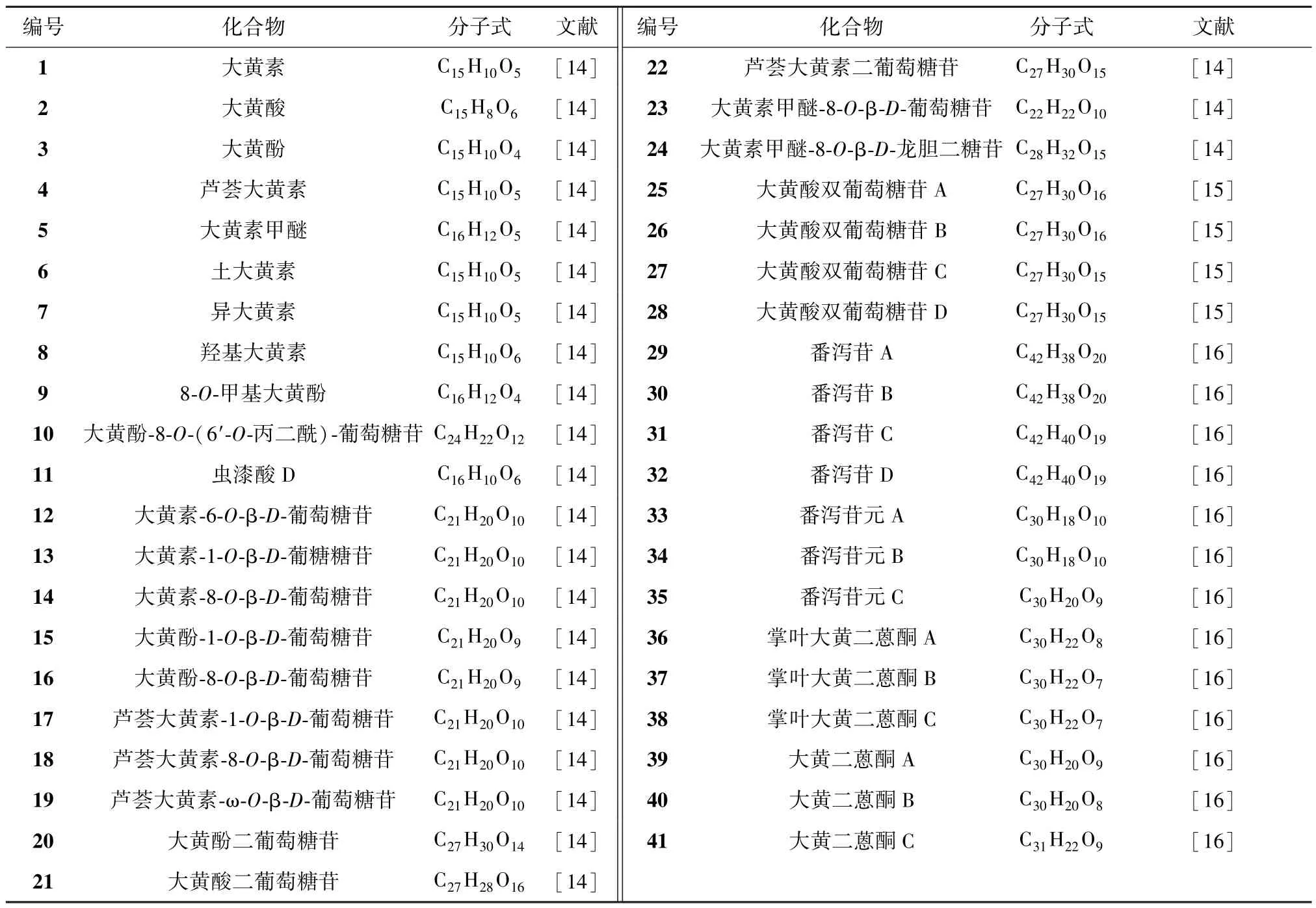
表1 大黄中蒽醌类化合物
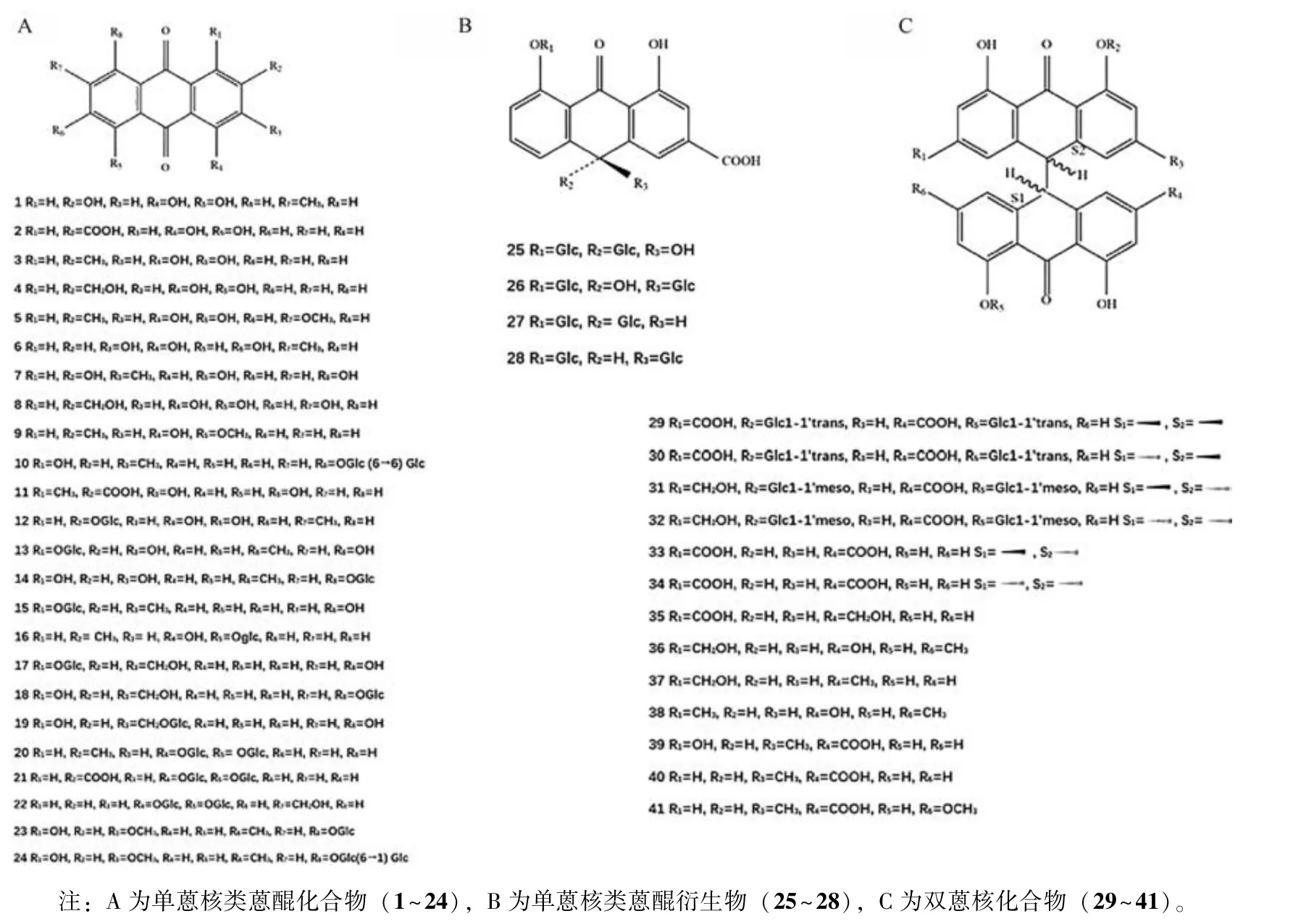
图1 大黄中蒽醌类化合物的基本骨架
研究表明,大黄通过多种途径和靶标在肿瘤发生发展的多个生物学过程中起至关重要的作用,这些抗肿瘤作用主要归因于大黄中的蒽醌类化合物。目前,大黄蒽醌类化合物主要的抗肿瘤研究集中在大黄素、大黄酸、大黄素甲醚、芦荟大黄素、大黄酚、番泻苷A,化学结构式见图2。研究发现,它们通过多种机制途径抑制抗恶性肿瘤的发生发展,具有靶向性强、副作用小的优点,可显著提高病人的存活率、减少癌症的复发,与其他抗肿瘤药物合用还可产生协同作用。

图2 大黄抗肿瘤主要蒽醌类化合物结构
2 大黄蒽醌类化合物抗肿瘤作用及机制
2.4 诱导肿瘤细胞自噬 自噬是一种除细胞凋亡之外的细胞代谢调节形式,在多种生理病理过程中起关键作用,如肿瘤发生、发展、细胞死亡和存活[64⁃65]。研究发现,自噬通过防止受损蛋白质和细胞器,特别是线粒体的毒性积累并限制氧化应激、慢性组织损伤和致癌信号,从而抑制癌症的发生[66]。天然化合物通过自噬在癌症的预防和治疗中发挥重要作用[67]。芦荟大黄素在肺癌A547、NCI⁃H1299 细胞中通过激活MAPK 信号通路并抑制Akt/mTOR 途径诱导ROS 依赖的自噬[68],并在肝癌中通过促进Bax、caspase⁃3 mRNA 及蛋白表达诱导SMMC⁃7721 细胞发生自噬,从而引发细胞凋亡[69]。大黄素也可通过促进结肠癌SW480 细胞内ROS 表达来激活细胞自噬进而诱导结肠癌细胞凋亡[70]。番泻苷A 则通过抑制JAK2/STAT3 信号传导,上调促自噬与凋亡蛋白水平,促进前列腺细胞LNCap 自噬性死亡[71]。
2.3 抑制肿瘤转移 与癌症相关的高死亡率是由肿瘤细胞从原始部位的转移性扩散引起的。侵袭和转移是指肿瘤细胞从原发病灶脱落,穿越基底膜进入血液或淋巴系统,并随血液和淋巴扩散至全身各组织器官的多因素、多步骤共同参与调控的复杂生物学过程,是恶性肿瘤重要的生物学特性之一[45]。大黄蒽醌类化合物抗癌活性的一个关键方面是对癌症转移的抑制作用。
研究发现,大黄素干预口腔鳞癌Tca8113 细胞后,其细胞周期表现为G0/G1期细胞阻滞,细胞相关蛋白CDK2、cyclin E、P21 表达降低,且大黄素呈时间和浓度依赖性地抑制Tca8113 细胞增殖[17]。大黄素对肝癌HepG2/C3A 细胞的生长具有抑制作用,其机制可能是通过刺激p53、p21 蛋白表达,导致细胞在G2/M 期停滞[18]。除了大黄素外,芦荟大黄素可使亚G1细胞周期停滞抑制胰腺癌MIAPaCa⁃2 细胞和PANC⁃1 细胞增殖[19]。另有研究发现,芦荟大黄素能够时间和剂量依赖性地抑制胶质母细胞瘤U87MG 细胞增殖且在S 期和G2/M 期阻滞,同时体内实验也发现,芦荟大黄素对U87MG 细胞也有抑制作用[20]。大黄酚能通过抑制NF⁃κB 磷酸化水平以及其下游cyclin D1、cyclin E 表达使乳腺癌MCF⁃7、MDA⁃MB⁃231 细胞周期在G1⁃S 节点停滞继而抑制乳腺癌细胞的恶性增殖[21]。
水壶:冬季锻炼往往与夏天相比不容易口渴,但不口渴并不代表不需要补水,水壶是运动的必备装备之一。运动量大的话装一些运动饮料,运动量小的话直接白水就好,切记不要喝碳酸饮料或者含咖啡因的饮料。
2.1.2 激活相关通路和靶点 Zhang 等[23]通过虚拟筛选发现,大黄素在乳腺癌化疗中是一种有效的芳香烃受体(AhR)激动剂,并通过实验验证发现,大黄素处理后的乳腺癌MCF⁃7 细胞的AhR 和细胞色素P450 1A1(CYP1A1)蛋白表达升高,提示大黄素可能通过激活AhR⁃CYP1A1 信号通路来抑制乳腺癌细胞MCF⁃7 增殖。人表皮生长因子受体2(HER⁃2)是一种原癌基因,目前已被证实在肿瘤发生发展中起着关键作用[24]。现有研究发现,大黄酸通过抑制人乳腺癌SK⁃Br⁃3 细胞中HER⁃2 蛋白表达从而抑制乳腺癌细胞的增殖分化[25]。此外,芦荟大黄素呈浓度依赖性地抑制人胃癌BGC⁃823 细胞增殖并降低β⁃catenin、TCF7L2 基因及蛋白表达,其作用机制可能与Wnt 信号通路有关[26]。
2.2 诱导肿瘤细胞凋亡 凋亡过程是复杂生物系统发育和稳态维持的基础。正常凋亡机制的失调或失败将有助于细胞转化,并为癌细胞提供生长优势。凋亡特征主要包括细胞收缩、染色质浓缩、DNA 断裂和特定半胱氨酸蛋白酶(caspase)的活化。凋亡主要通过2 种主要的信号途径启动,分别为内源性线粒体细胞色素释放途径和外源性死亡受体途径。这2 种途径都可以通过激活caspase 诱导细胞凋亡[27]。研究表明,大黄蒽醌类化合物可通过以上2 种途径促进肿瘤细胞凋亡。
在水量与水质相结合的现代水权制度中,同时对水权的水量和水质进行了规定,既明确了水权所有者的水量和水质权益,也明确了作为水权保证人的地方政府在保证水权拥有人的水量和水质要求的责任,这就要求地方政府真正担负起水量水质统一管理的职责,也为打破水量水质的分割部门管理创造了条件。
党的十九大报告指出:“发展社会主义先进文化要不忘本来、吸收外来、面向未来。”习近平新时代孝廉文化传承与创新是进一步厘清马克思主义与中华优秀传统文化之间的内在关联,坚持马克思主义的指导地位,是站在中华文化立场,立足当代中国现实基础上,发展中国特色社会主义文化的内在要求。
2.2.2 外源性死亡受体途径 Bax 是Bcl⁃2 家族的成员,是细胞凋亡内在途径的核心调节因子,在凋亡刺激下,线粒体外膜(MOM)被激活和寡聚化,以改变线粒体通透性,这被认为是凋亡的关键步骤[34]。大黄酸可剂量依赖性地诱导非小细胞肺癌PC⁃9、H460、A549 细胞凋亡,其机制可能是通过升高促凋亡蛋白Bax 表达,降低抗凋亡蛋白Bcl⁃2 表达[35]。芦荟大黄素可通过Bax 和Fas 死亡途径,调节Bcl⁃2家族蛋白的表达并激活caspase⁃3、caspase⁃8、caspase⁃9 进而诱导人肺鳞癌CH27 细胞凋亡[36]。经典死亡受体途径激活的凋亡信号通路有Fas/FasL 通路,Fas 属于凋亡诱导受体的肿瘤坏死因子(TNF)家族,通过与其配体FasL 形成死亡诱导复合物(DISC)活化caspase⁃8 及caspase 家族其他成员参与诱导细胞凋亡[37]。
2.2.1 内源性线粒体细胞色素释放途径 线粒体是调节细胞凋亡的主要细胞系,其凋亡通路能被多种刺激激活,如紫外线、内质网应激、DNA 断裂等,这些刺激最终导致线粒体膜结构发生改变而引起凋亡[28]。
研究发现,大黄酸可直接作用于线粒体,使线粒体通透性转换孔道开放以及线粒体功能受损,从而诱导肝癌HepG2 细胞凋亡,并证明线粒体通透性转换孔道在大黄酸诱导的HepG2 细胞凋亡中起着关键性作用[29]。另有研究发现,大黄素通过刺激HepG2 细胞内活性氧(ROS)堆积,使线粒体膜电位下降,进而诱导线粒体通透转运孔开放,导致细胞色素C 外流,激活caspase 蛋白家族,诱导细胞凋亡[30]。芦荟大黄素作用于结直肠癌SW620、HT29 细胞产生ROS 导致内质网应激依赖途径激活,促进结直肠癌细胞凋亡[31]。内源性ROS 产生和代谢的主要场所也是线粒体,当ROS 过量时,反作用于线粒体,破坏线粒体DNA,突变线粒体蛋白又可增加ROS 的产生,由此形成循环诱导细胞凋亡。线粒体活性氧除了可导致基因组不稳定,还能激活线粒体依赖性细胞凋亡途径[32]。因此,ROS 在肿瘤细胞内源性线粒体凋亡途径中至关重要。大黄酚可增加卵巢癌ES2 细胞中ROS 产生并破坏线粒体膜电位,增加线粒体中的钙离子浓度促进上皮性卵巢癌细胞凋亡[33]。
目前,材料具有石灰岩以及玄武岩两种不同的岩性种类形式,在公路施工的过程中,使用不同的材料后,路面的面层情况也会不同。单纯就路面的表现效果来讲,使用石灰岩作为材料的路面会在投入使用后的一段时间内呈现发白的状态,沥青薄膜也会相应的出现磨损的现象。而使用玄武岩作为材料的路面会在投入时候后的一段时间内呈现发黑的状态,其沥青薄膜的耐磨性要优于使用石灰岩的路面。
此外,PI3K/Akt 信号通路可减少细胞凋亡并促进肿瘤细胞生长,抑制该途径在细胞凋亡中起重要作用,也是治疗人类癌症的有效方法[38]。大黄素甲醚可通过抑制Akt 磷酸化,调控PI3K/Akt 通路,降低胰腺癌细胞存活率,促进其凋亡[39]。大黄素能有效抑制Akt 和细胞外信号相关激酶(ERK)的磷酸化,通过调节死亡受体途径抑制PI3K/Akt信号通路并激活p38 诱导HepG2 细胞凋亡[40]。大黄酸则通过激活NF⁃κB 经典信号通路诱导弥漫性B 细胞淋巴瘤OCI⁃LY8 细胞的凋亡[41]。NF⁃κB 属于转录因子家族,参与多种生物反应的调节,被认为是癌症发生发展中的关键因素,能与其他信号分子合作来抑制恶性肿瘤[42]。研究发现,芦荟大黄素通过抑制Notch⁃1/Akt/NF⁃κB 信号通路起到诱导细胞凋亡的作用[43],Notch⁃1 是Notch 基因家族成员之一,其可激活PI3K/Akt 信号通路,继而使活化的Akt 直接激活NF⁃κB,抑制肿瘤细胞的凋亡[44]。
2.1.1 阻滞肿瘤细胞周期 细胞分裂的正常过程通过细胞周期发生,这是一系列由细胞周期依赖性蛋白激酶(CDKs)和相关特定细胞周期蛋白在分子水平上共同协调的高度调节步骤[22]。大黄蒽醌类化合物可通过干预非正常细胞周期从而抑制肿瘤细胞的过度增殖。
2.3.1 调控肿瘤细胞的粘附能力 粘附是恶性肿瘤形成克隆性转移灶的关键步骤,健康组织中体内平衡强烈依赖于细胞间粘附和细胞间基质相互作用,介导这些相互作用的蛋白质统称为细胞粘附分子,已有许多研究阐明细胞粘附分子在恶性肿瘤的转移中起重要作用[46]。芦荟大黄素通过降低胶质瘤SHG44 细胞的粘附能力从而降低细胞体外迁移和侵袭能力[47]。N⁃cadherin、E⁃cadherin 属于细胞粘附分子中钙黏蛋白(cadherin)。N⁃cadherin 是一种钙依赖性单链跨膜糖蛋白,介导同型和异型细胞之间的粘附,已发现N⁃cadherin 在多种癌症中异常表达并且可作为肿瘤侵袭转移的治疗靶点[48]。E⁃cadherin 则是位于上皮细胞膜外的跨膜蛋白,其功能丧失是促进侵袭和转移的关键因素,并且E⁃cadherin 丢失导致细胞间粘附抑制是上皮间质转化(EMT)的关键步骤,而迁移及侵袭均依赖于EMT[49]。大黄素可通过激活Wnt/β⁃catenin 信号通路升高E⁃cadherin 表达并降低N⁃cadherin、Snail、β⁃catenin 表达来抑制EMT,从而抑制结肠癌RKO 细胞的侵袭和迁移能力[50]。最新研究发现,与单独使用大黄素相比,大黄素和顺铂联合应用后E⁃cadherin表达升高,细胞迁移速度和距离降低,从而抑制HepG2 细胞的侵袭、迁移[51]。此外,大黄素通过抑制黑色素瘤B16F10 细胞对细胞外基质(ECM)的粘附和侵袭从而抑制B16F10 细胞的肺转移[52]。
2.3.2 抑制基质金属蛋白酶(MMPs)的表达 研究表明,多种蛋白酶尤其是基质金属蛋白酶对细胞外基质和基底膜的降解与肿瘤的侵袭和转移有关,基质金属蛋白酶(MMPs)是一类锌依赖性蛋白酶,可降解ECM 和基底膜上的大多数蛋白质,在恶性肿瘤的侵袭和转移中起重要作用[53]。在这些基质金属蛋白酶中,MMP2、MMP9 在恶性肿瘤中经常过度表达,并直接影响癌细胞的侵袭。大黄素、芦荟大黄素、大黄酸可通过抑制MMP⁃2、MMP⁃9 蛋白表达从而抑制人舌癌SCC⁃4 细胞的迁移和侵袭[54]。大黄酸可能通过抑制Rac1/ROS/MMPs 信号转导通路中c⁃Jun 氨基末端激酶(JNK)、AP⁃1 蛋白磷酸化,降低基质金属蛋白酶的活性,从而抑制卵巢癌SKOV3⁃PM4 细胞侵袭和转移[55]。研究发现,番泻苷A 可抑制肝癌HepG2、SMMC⁃7721 细胞的转移,其机制可能与抑制Wnt 信号通路、TNF 信号通路、NF⁃κB 信号通路、血管内皮生长因子(VEGF)信号通路并降低MMP⁃9 蛋白表达有关[56]。
2.3.3 抑制新生血管生成 新生血管形成的过程是癌症的标志之一,也是恶性肿瘤转移的关键因素[57]。血管内皮生长因子(VEGF)是血管生成的重要原因,并且在大多数癌症中过度表达,而新生血管的生成主要通过阻断血管内皮生长因子/血管内皮生长因子受体信号来破坏血管供应,使肿瘤缺乏营养和氧气[58]。细胞适应缺氧条件的一个关键因素就是缺氧诱导因子⁃1(HIF⁃1α)的生成,HIF⁃1α 可通过直接激活血管内皮生长因子增加血管形成从而刺激肿瘤转移[59]。大黄素可能通过抑制HIF⁃1α mRNA 表达,从而降低VEGFmRNA 表达来抑制HepG2 细胞新生血管的形成[60]。在缺氧的条件下,大黄酸可抑制人胰腺癌MiaPaCa⁃2 细胞中HIF⁃1α 蛋白表达,并降低其下游靶基因VEGF 表达,从而抑制肿瘤血管形成并控制肿瘤生长[61]。此外,体内研究也发现,大黄素对胰腺癌SW1990 细胞裸鼠原位移植瘤的新生血管有抑制作用,其机制可能是大黄素改变了新生血管相关Ang⁃1、Ang⁃2、Tie⁃2、VEGF 表达[62]。大黄素还通过靶向转录调节因子NCOR2、SerRS 来抑制血管内皮生长因子VEGFA 的转录并阻断三阴性乳腺癌(TNBC)小鼠肿瘤血管生成,提高其存活率[63]。
2.1 抑制肿瘤细胞增殖 癌细胞区别于正常细胞的重要特征是不受凋亡调控的异常增殖。因此,抑制肿瘤细胞增殖是治疗恶性肿瘤的重要治疗方法之一。研究表明,大黄蒽醌类化合物(包括大黄素、芦荟大黄素、大黄酸、大黄酚等)能抑制各种癌细胞的生长和增殖,其抗增殖活性已在多种肿瘤细胞系中得到证实,包括口腔鳞癌[17]、肝细胞癌[18]、胰腺癌[19]、神经胶质瘤[20]、乳腺癌[21]等。
大家哄笑着,把这两对新人分别往团长面前推。田志芳蒙了神,她想质问向阳花,可她已被推到写有她名字的脸盆前。上面清清楚楚地用毛笔写着:
2.5 调控肿瘤相关炎性微环境 炎症被认为是癌症发生和发展的标志[72],肿瘤组织中炎症微环境是癌症领域的主要研究重点[73]。炎症促进肿瘤发生的所有阶段,癌细胞以及周围的间质细胞和炎症细胞相互作用形成肿瘤微环境(TME)[74]。致瘤性炎症通过阻断抗肿瘤免疫、使TME 向肿瘤状态发展,并通过对上皮细胞和癌细胞施加直接的肿瘤促进信号促进恶性肿瘤的发生发展[75]。大黄蒽醌类化合物被多次报道可减轻多种炎症反应进而改善炎症微环境。
常规炎症反应由多种细胞因子介导,细胞因子白细胞介素⁃1β(IL⁃1β)和肿瘤坏死因子⁃α(TNF⁃α)是主要的促炎细胞因子,并具有强大的促炎活性,可促进多种促炎介质的分泌[76]。研究发现,大黄酚可通过抑制巨噬细胞的TNF⁃α 表达从而改善脂多糖(LPS)诱导的小鼠炎症反应[77]。大黄素也可通过抑制LPS 诱发的炎症因子(IL⁃1β、TNF⁃α、IL⁃6)的释放和炎性信号通路(TLR4⁃NF⁃κB)激活,抑制结肠癌细胞转移[78]。NF⁃κB 是炎症与免疫反应的重要调节因子,能够调节多种促炎细胞因子的表达,也是关联慢性炎症与癌症的重要分子之一[79]。研究发现,大黄素可激活NF⁃κB 通路并通过减少其磷酸化和降解以及κB激酶B 的磷酸化,减弱NF⁃κB p65 的核转移及其DNA 结合活性(IKK),发挥抗炎作用[80]。
综上所述,蒽醌类化合物抗肿瘤的主要作用机制有抑制肿瘤细胞增殖,诱导肿瘤细胞凋亡,抑制肿瘤转移,诱导肿瘤自噬,调控肿瘤相关炎性微环境,具体机制见图3、表2。
降钙素:降钙素升高是甲状腺髓样癌MTC的特异性标志,可用来观察髓样癌患者术后复发的可能性。但由于儿童MTC患病率低,并且缺乏儿童降钙素的正常参考值,不作为常规检查。对于有MTC或多发性内分泌瘤家族史,或细胞学检查疑似MTC的患儿,血清降钙素应作为常规检查指标[5]。

表2 大黄蒽醌类化合物抗肿瘤的作用机制
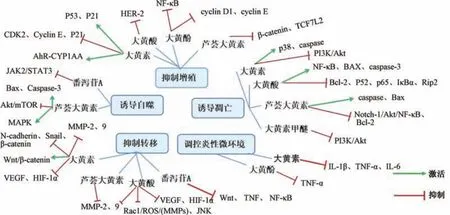
图3 大黄主要蒽醌类化合物抗肿瘤作用机制
3 讨论
大黄蒽醌类化合物已被证实具有明显的抗癌作用,且具有多层次、多靶点等特点,其可通过抑制肿瘤细胞增殖,诱导肿瘤细胞凋亡,抑制肿瘤细胞侵袭和转移,调节肿瘤细胞自噬并调控肿瘤相关炎性微环境,进而发挥抗肿瘤效果。综上所述,大黄蒽醌类化合物有望成为新的抗肿瘤药物研发的候选药物。但是部分蒽醌类化合物存在溶解度较差,生物利用度不高,体内代谢及作用机制不明,毒性较大等问题,因此积极寻找有效的载药体系,提高其生物利用度,阐明药物体内活性代谢产物及作用机制,降低肿瘤放化疗中的毒副作用尤为重要。
研究表明,同一有效成分在不同类型肿瘤细胞中发挥的作用及机制各异,这种细胞差异性可能是由不同肿瘤细胞本身的异质性及其所处的不同生存环境导致的。此外,不同的蒽醌类化合物也具有不同的抗肿瘤作用和机制。例如,大黄素对肝癌、乳腺癌、人口腔鳞癌、结肠癌、胰腺癌、人舌癌、黑色素瘤都有一定的抑制效果,其作用机制包括阻滞细胞周期G0/G1、G2/M 期;激活AhR⁃CYP1A1 信号通路、Wnt/β⁃catenin 信号通路;抑制PI3K/Akt 信号通路、MMP⁃2 和MMP⁃9 蛋白表达、LPS 诱发炎症因子的释放和炎性信号通路激活;调控ROS 调控细胞凋亡自噬等。芦荟大黄素对胰腺癌、胶质母细胞瘤、胃癌、结直肠癌、肺
鳞癌、人舌癌、肺癌、肝癌有抑制作用,其机制包括阻滞细胞周期G1、S、G2/M 期;激活Wnt/β⁃catenin、MAPK 信号通路以及Bax 和Fas 死亡途径;抑制Notch⁃1/Akt/NF⁃κB信号通路、Akt/mTOR 途径;降低肿瘤细胞粘附能力等。大黄酸对人非小细胞肺癌、弥漫性大B 细胞淋巴瘤、肝癌、人舌癌、卵巢癌、人胰腺癌等肿瘤有抑制作用,其作用机制为激活NF⁃κB 经典和非经典信号通路;抑制MMP⁃2、MMP⁃9、HIF⁃1α 表达以及Rac1/ROS/金属蛋白酶(MMPs)信号转导通路;损害线粒体功能等。大黄酚对上皮性卵巢癌、乳腺癌有抑制作用,机制与增加ROS 产生并破坏线粒体膜电位,抑制NF⁃κB 的磷酸化水平有关。除了这些常见的抗肿瘤蒽醌类化合物之外,研究发现,大黄素甲醚能通过调控PI3K/Akt 通路抑制胰腺癌细胞,番泻苷A 则通过调控Wnt 信号通路、TNF 信号通路、NF⁃κB 信号通路、血管内皮生长因子(VEGF)信号通路以及JAK2/STAT3 信号通路来抑制肝癌和前列腺癌。
目前对于蒽醌化合物的研究仍存在许多局限性,因其活性成分在复杂细胞信号通路的潜在机制和因果关系还不够深入并且缺乏一致性模型和评价标准,尤其缺乏高质量、大样本的临床数据,所以就现有研究而言无法为大黄蒽醌化合物抗肿瘤临床研究提供更多的科学依据。因此需要进一步寻找相关靶点,开展具体的临床研究评估大黄蒽醌化合物在预防和治疗各种肿瘤中的有效性和安全性。未来蒽醌类抗癌药物开发方向可以以寻找靶向性强、毒副作用小的新型药物制剂和结合药代动力学和毒理学参数的多药联合应用为研究重点,为进一步推进该类化合物向临床应用转化提供参考。
